U.S. Pharm. 2008; 33 (4) (Complément en oncologie): 20-30.
RÉSUMÉ: Environ 75% des femmes ménopausées atteintes d’un cancer du sein ont une maladie à récepteurs hormonaux positifs (HR +).1 Le tamoxifène était la norme de traitement du cancer du sein HR + chez les femmes ménopausées jusqu’à l’avènement des inhibiteurs sélectifs de l’aromatase de troisième génération, qui sont l’anastrozole, le létrozole et l’exémestane.3,4 Ces agents ont démontré une survie sans maladie supérieure dans les essais cliniques par rapport au tamoxifène, mais leur bénéfice lorsqu’ils sont utilisés pendant plus de cinq ans chez les femmes ménopausées atteintes d’un cancer du sein HR + n’a pas été établi.3,4
On estime que les trois quarts des femmes ménopausées atteintes d’un cancer du sein sont atteintes d’une maladie à récepteurs hormonaux positifs (HR+).1 Tamoxifène – un modulateur sélectif des récepteurs aux œstrogènes avec des effets œstrogéniques sur les os, le tissu endométrial et les lipides et anti!= effets oestrogéniques sur le tissu mammairewas était la thérapie standard pour le cancer du sein HR + chez les femmes ménopausées jusqu’à l’introduction des inhibiteurs sélectifs de l’aromatase de troisième génération (AIS).2-4 Ces agents – l’anastrozole, le létrozole et l’exémestane – ont démontré une survie sans maladie supérieure par rapport au tamoxifène dans les essais cliniques.3,4 Les effets indésirables associés à l’utilisation du tamoxifène – cancer de l’endomètre, complications thromboemboliques et résistance au tamoxifène – ont encouragé le développement de thérapies dotées d’un mécanisme d’action différent, telles que les EI.2
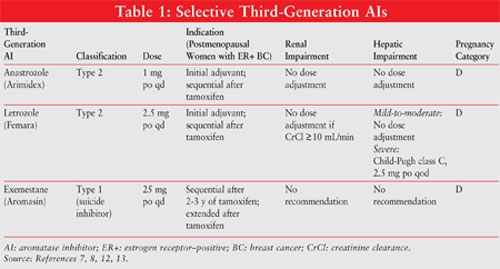
Voir le TABLEAU 1 pour un résumé des informations importantes sur l’AIS de troisième génération.
Contexte
Le chirurgien écossais George Beatson a décrit la contribution hormonale des œstrogènes à la carcinogenèse en relation avec le cancer du sein en 1896.5 Beatson a reconnu que l’ablation des ovaires (ovariectomie) était bénéfique dans femmes atteintes d’un cancer du sein inopérable.5 Cet état de privation d’œstrogènes induit chirurgicalement a contribué à l’inhibition de la croissance tumorale dans les cellules cancéreuses du sein chez les femmes atteintes de la maladie HR +.5
L’aminoglutéthimide, initialement formulé comme agent anticonvulsivant, a été la première IA non spécifique initialement promue à la fin des années 1970 comme agent de deuxième intention après le tamoxifène pour les femmes ménopausées atteintes d’un cancer du sein HR + avancé.6 Des effets secondaires toxiques tels que la suppression des surrénales et la nécessité d’un traitement par stéroïdes ont entraîné le retrait de l’aminoglutéthimide du marché.6 Chez les femmes ménopausées atteintes d’un cancer du sein HR + à un stade précoce et tardif, les IA de troisième génération présentent un meilleur profil de toxicité, une plus grande sélectivité, une plus grande puissance et une efficacité clinique améliorée par rapport aux agents plus âgés. 6
Classification4,7
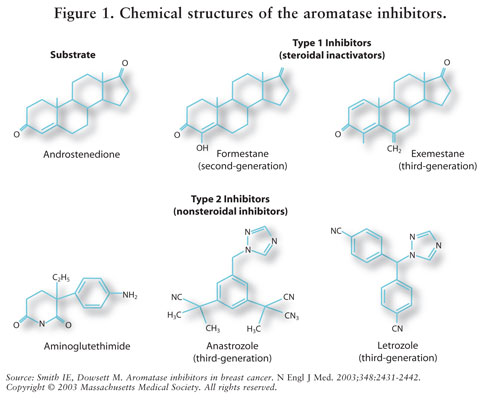
Les inhibiteurs stéroïdiens de type 1 (non compétitifs, irréversibles) ou non stéroïdiens de type 2 (compétitifs, réversibles). L’exémestane, un inhibiteur de type 1, se lie de manière irréversible au site de la molécule d’aromatase et est connu comme un inhibiteur du suicide. Les inhibiteurs de type 2, l’anastrozole et le létrozole, se lient de manière réversible à l’aromatase. Voir la FIGURE 1 pour les structures chimiques des différents AIs.
Mécanisme d’action
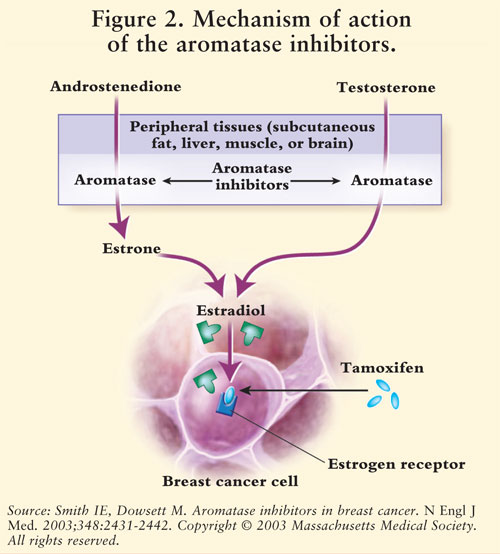
La synthèse des œstrogènes est médiée par l’enzyme aromatase.7 L’aromatase convertit l’androstènedione et la testostérone en estrone et en estradiol.5,7 AIs réduisent les œstrogènes chez les femmes ménopausées, inhibant ainsi son effet cancérigène sur le tissu mammaire.7 Étant donné que les ovaires des femmes préménopausées fonctionnent toujours, les EI ne sont pas indiqués pour cette population en dehors des essais cliniques; chez ces femmes, les EI stimuleraient l’hypothalamus et l’hypophyse pour augmenter la production de gonadotrophines.4 Voir FIGURE 2.
Toxicités6,8
Les effets indésirables des EI comprennent un dysfonctionnement cardiovasculaire tel que l’hypertension, la vasodilatation, l’œdème et douleur thoracique. Une étude plus approfondie est nécessaire pour évaluer le plein effet de l’AIS sur la fonction cardiaque. Les patients peuvent présenter une diminution de la densité minérale osseuse (DMO), un risque accru de fracture, des symptômes vasomoteurs, une sécheresse vaginale, des douleurs musculo-squelettiques, des maux de tête, de l’insomnie, une dépression, une toux accrue, une dyspnée, une gêne gastro-intestinale, une prise de poids et éventuellement des taux de lipides élevés. La perte osseuse est un effet secondaire prédominant; des bisphosphonates tels que l’acide zolédronique ont été utilisés pour la contrer. Les patients sous EI doivent recevoir une supplémentation en vitamine D et en calcium. Les effets indésirables prolongés et les effets sur la fonction cognitive de la thérapie par IA n’ont pas encore été déterminés.9 les EI sont contre-indiqués chez la femme enceinte.
Interactions médicamenteuses
L’anastrozole inhibe les CYP1A2, CYP2C9 et CYP3A4.10,11 Le létrozole est métabolisé par les CYP2A6 et CYP2C19, et l’exémestane métabolise les inducteurs du CYP3A4.8,10-13 du CYP3A4 tels que la rifampicine, la phénytoïne, la carbamazépine et le millepertuis peuvent provoquer une diminution des taux d’exémestane lorsqu’ils sont administrés de manière concomitante. Le tamoxifène 8,12,13 provoque une diminution de 38% du létrozole et une diminution de 27% de l’anastrozole lorsqu’il est co-administré.2,7,8,14
Indications et posologie
Anastrozole 10,11: L’Anastrozole 1 mg une fois par jour est indiqué pour le cancer du sein précoce en tant que traitement adjuvant initial chez les femmes ménopausées atteintes d’une maladie sensible aux hormones et en première intention pour les maladies métastatiques ou localement avancées HR + ou HR-inconnues. Il est également approuvé pour une utilisation après un traitement au tamoxifène chez les femmes atteintes d’une maladie progressive. Un ajustement posologique n’est pas nécessaire en cas d’insuffisance rénale ou d’insuffisance hépatique légère à modérée.
Létrozole11,12: Létrozole 2.5 mg une fois par jour sont indiqués pour les femmes ménopausées atteintes d’un cancer du sein à un stade précoce HR + en traitement initial ou en traitement adjuvant prolongé après le tamoxifène. Il est également indiqué pour les maladies métastatiques HR + ou HR-inconnues. Des ajustements posologiques sont recommandés en cas d’insuffisance hépatique sévère.
Exémestane11,14: L’exémestane 25 mg de po une fois par jour est indiqué comme traitement adjuvant deux à trois ans après le tamoxifène pour les femmes ménopausées atteintes d’un cancer du sein précoce HR +, pour un total de cinq années consécutives de traitement hormonal. Il peut également être utilisé pour les maladies qui ont progressé après un traitement au tamoxifène. Il devrait être pris après un repas. L’ajustement de la dose n’est pas nécessaire en cas d’insuffisance hépatique ou rénale
Essais cliniques
Les toxicités liées au tamoxifène telles que le cancer de l’endomètre ont incité le lancement d’essais cliniques à grande échelle sur l’utilisation d’EI de troisième génération chez les femmes ménopausées atteintes d’un cancer du sein HR +. Divers modèles d’essai ont été utilisés pour évaluer la performance de ces agents par rapport au tamoxifène.6 Des résultats supérieurs en termes d’efficacité clinique et de profils de toxicité ont établi l’EI comme une nouvelle norme de traitement adjuvant chez les femmes ménopausées atteintes d’un cancer du sein HR +.6
ATAC15: ATAC (Arimidex, Tamoxifène seul ou en association), une étude multicentrique randomisée en double aveugle, a comparé trois groupes de traitement: tamoxifène 20 mg + placebo anastrozole, anastrozole 1 mg + placebo tamoxifène et une combinaison de tamoxifène 20 mg + anastrozole 1 mg. L’objectif principal était d’évaluer l’innocuité et l’efficacité du tamoxifène par rapport à l’anastrozole et à l’association de l’anastrozole et du tamoxifène sur une période de cinq ans. Un total de 9 366 patients – 3 125 dans le bras anastrozole, 3 116 dans le bras tamoxifène et 3 125 dans le bras combiné – ont été traités pendant une médiane de 33 mois.
Après trois ans, l’anastrozole a démontré un DFS de 89,4% contre 87,4% pour le tamoxifène (hazard ratio 0,83, IC à 95%, P =.013). L’anastrozole a diminué le taux de cancer du sein controlatéral (CLBC) par rapport au tamoxifène (rapport de cotes 0,42, IC à 95%, P =.007). Le bras combiné a été fermé car aucun bénéfice clinique au-delà du tamoxifène n’a été constaté. L’anastrozole était associé à des effets indésirables tels que le cancer de l’endomètre (P =.02), saignement vaginal, écoulement (P<.0001), événements cérébrovasculaires (P =.0006), événements thromboemboliques veineux (P =.0006), et des bouffées de chaleur (P<.0001); le tamoxifène était associé à moins de fractures et à moins de douleurs articulaires (P<.0001). Après 68 mois, l’anastrozole a augmenté le DFS (HR 0,87, IC À 95%, P =.01) et le temps de récurrence (HR 0,79, IC à 95%, P =.0005) et une diminution des métastases à distance (HR 0,86, IC À 95%, P =.04) et CLBC (diminution de 42 %, P =.01).16 Après un intervalle de suivi médian de 100 mois, les patients HR+ sous anastrozole ont montré une amélioration du DFS (HR 0,85; P =.003), occurrence de CLBC (HR 0,60, P =.004), temps de récurrence (HR 0,76, P =.0001), et le temps de récurrence à distance (HR 0,84, P =.022) par rapport aux patients sous tamoxifène. La différence absolue dans les taux de récurrence s’est améliorée par rapport à 2.8% après cinq ans à 4,8% après neuf ans. Les taux de fracture de l’anastrozole étaient plus élevés pendant le traitement, mais la différence diminuait considérablement après la période de suivi de 100 mois. La période de traitement prolongée présentait un risque de fracture de 1,15 avec l’anastrozole contre 1,02 avec le tamoxifène. Le risque de cancer de l’endomètre a été réduit sous et hors traitement par anastrozole par rapport au tamoxifène, avec un taux annuel de 0,043 contre 0,14 et 0,014 contre 0,12, respectivement. Aucune différence de survie globale n’a été identifiée.
MA.1712,17: MA.17 était un essai randomisé, contrôlé par placebo et en double aveugle évaluant l’efficacité de cinq ans de traitement au létrozole chez des femmes ménopausées atteintes d’un cancer du sein qui avaient déjà terminé cinq ans de traitement adjuvant au tamoxifène. Les patients ont reçu du létrozole 2,5 mg ou un placebo par jour pendant cinq ans. Le critère d’évaluation principal était le DFS; les critères d’évaluation secondaires étaient la qualité de vie, le profil de sécurité étendu et le système d’exploitation. Sur les 5 187 patients, 2 593 ont reçu du létrozole et 2 594 ont reçu un placebo; le suivi médian était de 2,4 ans.
Dans l’analyse préliminaire, il y avait 207 récidives locales ou métastatiques de cancer du sein ou de tumeurs malignes initiales de CLBC, 75 dans le groupe létrozole et 132 dans le groupe placebo. Les taux de DFS sur quatre ans projetés pour les deux groupes étaient respectivement de 93 % et de 87 % (P?.001 pour l’évaluation du DFS). Dans le bras du létrozole, le DFS avait une HR de 0,61 (IC à 95%, P?.001). Le létrozole a démontré une diminution de 43% de l’incidence du cancer du sein (HR 0,57, IC à 95%, P =.00008).4 À l’exception des patients ganglionnaires positifs (P =.04), OS n’a pas atteint de signification statistique (HR 0,82, P =.30).4 patients dans le bras du létrozole ont présenté des symptômes vasomoteurs de bas grade, des myalgies et de l’arthrite. L’ostéoporose était plus fréquente (mais pas significativement) dans le bras létrozole par rapport au placebo (5,8 % vs 4,5 %; P =.07), et les taux de fractures étaient comparables entre les bras. L’étude a été fermée après une médiane de 2,4 ans en raison d’une diminution des événements de cancer du sein dans le bras létrozole. Un traitement adjuvant prolongé par le létrozole après cinq ans de tamoxifène a amélioré le DFS.
BIG 1-987,9,18: L’étude Breast International Group (BIG) 1-98, un essai randomisé multicentrique en double aveugle, a inclus 8 028 femmes ménopausées atteintes d’un cancer du sein à un stade précoce HR +. L’étude comprenait quatre bras de traitement qui évaluaient cinq ans de monothérapie au tamoxifène, cinq ans de monothérapie au létrozole, le tamoxifène pendant deux ans puis un passage au létrozole pendant trois ans ou au létrozole pendant deux ans puis un passage au tamoxifène pendant trois ans. L’objectif principal était le DFS; les objectifs secondaires étaient le temps aux métastases à distance, la sécurité et le système d’exploitation. La SFD a augmenté chez les patients ayant reçu du létrozole par rapport à ceux ayant reçu du tamoxifène (HR 0,81, IC à 95%, réduction relative de 19%, P =.003), avec une différence absolue de 1,5% à trois ans. Le tamoxifène a augmenté la survenue d’événements thromboemboliques par rapport au létrozole (OR 0,38, P <.0001). Les fractures osseuses ont été augmentées dans le bras du létrozole (OU 1,44, P =.006).
IES14,19: L’ES (Étude intergroupe sur l’exémestane) était une étude de phase III multicentrique randomisée, en double aveugle, dont l’objectif était de déterminer si le passage à l’exémestane après deux à trois ans de tamoxifène était plus efficace que la poursuite du tamoxifène pendant cinq ans. L’essai a inclus 4 742 femmes ménopausées randomisées dans deux bras de traitement; 2 362 sujets devaient passer à l’exémestane 25 mg po qd après deux à trois ans de tamoxifène 20 mg po qd pour compléter cinq ans de traitement, et les 2 380 autres devaient recevoir du tamoxifène 20 mg po qd pendant cinq ans. Le DFS était le critère d’évaluation principal; les paramètres d’évaluation secondaires étaient l’OS, le profil de toxicité étendu et la fréquence de la CLBC.
Les événements indésirables survenus sur une période médiane de 30,6 mois comprenaient la fréquence des CLBC, une récidive locale ou métastatique et le décès. Il y a eu 449 événements – 183 dans le bras de l’exémestane et 266 dans le bras du tamoxifène. Le bras d’exémestane avait une HR non ajustée de 0,68 (IC à 95%, P<.001 par le test log-rank), qui a démontré une diminution du risque de 32% et était analogue à un avantage dans le DFS de 4.75 (IC à 95%) à trois ans. Après trois ans, le bras exémestane avait un DFS de 91,5% (IC à 95%) contre 86,8% (IC à 95%) dans le bras tamoxifène. Il n’y avait pas de différence significative dans l’OS entre les deux groupes, avec 93 décès dans le bras de l’exémestane et 106 décès dans le bras du tamoxifène. Il y avait une différence significative dans la fréquence de CLBC (P =.04)2 20 sujets dans le bras tamoxifène et neuf dans le bras exémestane. L’utilisation de l’exémestane pour compléter les cinq années de traitement après deux à trois ans de tamoxifène a amélioré le DFS par rapport à cinq ans de tamoxifène.
Prévenir la perte osseuse due à la thérapie par l’IA 20
Les femmes ménopausées sont sujettes à une diminution de la DMO en raison de la réduction des niveaux d’œstrogènes. La thérapie par IA chez la patiente atteinte d’un cancer du sein ménopausique exacerbe cette tendance. Le Denosumab, un anticorps expérimental monoclonal entièrement humain, lie l’activateur du récepteur du ligand du facteur nucléaire kB (RANKL) et empêche l’activité du RANKL. RANKL est vital pour l’activité ostéoclastique, ce qui signifie la dégradation de l’os. Le denosumab et le risédronate, un bisphosphonate, sont en cours d’évaluation pour leur capacité à contrer la perte osseuse associée au traitement par IA.
Étude sur le Denosumab20: Une étude de phase III multicentrique et randomisée a évalué l’utilisation de 60 mg de denosumab administrés par voie sous-cutanée une fois tous les six mois chez des femmes ménopausées prenant des EI pour un cancer du sein HR + non métastatique. L’objectif était d’évaluer le changement de la DMO de la colonne lombaire du début à 12 mois. Sur les 252 patients, 127 ont été affectés au denosumab et 125 au placebo. Les deux bras ont reçu du calcium et de la vitamine D. La DMO a été évaluée par absorptiométrie par rayons X à double énergie. Après 12 et 24 mois de traitement par denosumab ou placebo, il y avait une différence de 5,5% et 7,6%, respectivement, dans l’augmentation de la DMO dans la région lombaire en faveur du dénosumab (P <.0001 pour les deux mois). Le denosumab a présenté un profil de toxicité comparable à celui du placebo. Le traitement par le Denosumab depuis plus de 24 mois n’a pas encore été évalué.
Sous-étude sur les os IBIS-II 21: La Sous-étude sur les os de l’Étude d’Intervention Internationale sur le cancer du sein -II (IBIS-II) a été dérivée d’IBIS-II, qui a évalué les femmes ménopausées présentant une probabilité accrue de développer un cancer du sein qui ont été randomisées en anastrozole ou placebo pendant cinq ans. La sous-étude, avec un effectif actuel de 700 patients, évalue le risédronate par rapport au placebo pour la prévention de la perte de DMO chez les femmes ayant de faibles scores T au départ. Un sous-ensemble de patients de l’essai IBIS-II a été affecté à l’une des trois stratégies de traitement différentes de la sous-étude. Après un an de traitement, 350 patients sous anastrozole et 350 patients sous placebo d’IBIS-II ont reçu des résultats de sous-étude. La strate 1 comprenait 227 patients sous anastrozole avec des scores T normaux (score T?1), la strate 2 comprenait 80 patients atteints d’ostéopénie (ñ2.5? Score T < 1) qui ont été affectés au risédronate 35 mg une fois par semaine ou au placebo, et la strate 3 comprenait 43 patients atteints d’ostéoporose (ñ4 < Score T < 2,5) qui ont été affectés au risédronate 35 mg une fois par semaine.
Chez les patients présentant une ostéopénie ou une ostéoporose au départ, le risédronate semblait inhiber la perte osseuse associée à l’anastrozole. Dans la strate II, le risédronate a démontré des effets favorables sur la préservation de la DMO pour la hanche totale, mais pas pour le rachis lombaire (P =.005 et P =.15, respectivement, contre placebo). Aucun effet indésirable grave ou interaction médicamenteuse n’a été associé au risédronate.
Essai d’AIs chez les femmes préménopausées (SOFT) 21-26
Environ 33% des femmes de moins de 50 ans recevront un diagnostic de cancer du sein invasif. 22 L’essai sur la suppression de la fonction ovarienne (SOFT, IBCSG 24-02, BIG 2-02) étudie l’utilisation du traitement par IA chez les femmes préménopausées atteintes d’un cancer du sein HR +. L’essai, qui a un nombre ciblé de patients de 3 000, implique des femmes préménopausées atteintes d’un cancer du sein HR + qui ont terminé une chimiothérapie ou qui ont été opérées uniquement. L’ablation ovarienne est établie par l’administration de triptoréline (une hormone libérant des gonadotrophines) une fois par mois pendant cinq ans, une ovariectomie chirurgicale ou une irradiation pelvienne. Les patients seront randomisés dans l’un des trois bras, le premier bras recevant du tamoxifène une fois par jour pendant cinq ans, le deuxième bras recevant du tamoxifène pendant cinq ans en association avec une ablation ovarienne et le troisième bras recevant de l’exémestane pendant cinq ans en association avec une ablation ovarienne. Les patients recevront de l’exémestane ou du tamoxifène pendant cinq ans.
Essais de chimioprévention 23-27
Le tamoxifène est indiqué pour la chimioprévention du cancer du sein.6 Son profil de toxicité est une cause de contrainte en ce qui concerne l’utilisation thérapeutique.6 L’AIS peut réduire l’incidence du cancer du sein HR + chez les patientes à haut risque en raison d’une diminution de l’incidence du CLBC par rapport au tamoxifène dans les essais cliniques tels que l’ATAC.6
Les études de chimioprévention de l’IA comprennent l’essai 31-03 du Groupe d’étude international sur le cancer du sein (IBCSG) (IBCSG 31-03) et la CARTE de l’Institut national du cancer du Canada.3 procès. L’objectif principal de l’essai IBCSG 31-03 multicentrique, international, randomisé et contrôlé par placebo est d’évaluer l’utilisation de l’anastrozole pour la prévention du cancer du sein chez les femmes ménopausées. Sa principale mesure de résultat est l’incidence du cancer du sein invasif et non invasif; la mesure de résultat secondaire est l’incidence de l’ostéoporose et des fractures.5 L’essai IBCSG 31-03 a un effectif cible de 6 000 personnes. cartographie.3 l’essai évalue l’exémestane comme agent chimiopréventif chez les femmes ménopausées. L’objectif principal de la CARTE contrôlée par placebo.3 l’essai vise à évaluer l’efficacité de l’exémestane dans la diminution de l’incidence du cancer du sein invasif.
Utilisations futures potentielles: Rapports de cas
Le létrozole a été utilisé après l’échec du clomiphène à induire la fertilité chez 22 femmes atteintes du syndrome des ovaires polykystiques. Le létrozole a induit l’ovulation dans 75% des cycles contre 44,4% des cycles induits par le clomiphène. Quatre grossesses ont résulté des ovulations induites par le létrozole, et aucun effet indésirable significatif n’a été associé au létrozole.28,29
Une femme obèse de 57 ans atteinte d’endométriose à la suite d’une hystérectomie et d’une salpingo-ovariectomie bilatérale a reçu de l’anastrozole après un traitement au mégestrol. La patiente n’avait aucune lésion de l’endomètre après neuf mois.28,30
Un patient atteint du syndrome de McCune-Albright a reçu de l’anastrozole pour une puberté prématurée; l’estradiol du patient s’est normalisé après 2,5 ans d’anastrozole et l’âge osseux a avancé de six mois.28,31 Une augmentation des œstrogènes peut induire une gynécomastie et un hypogonadisme hypogonadotrope.28,31 La diminution des œstrogènes avec une IA a entraîné une gonadotrophine et une testostérone normales chez les hommes atteints de gynécomastie et d’hypogonadisme hypogonadotrope. 28,31,32
Le létrozole a été étudié chez des patientes atteintes d’un cancer de l’ovaire en rechute; les patientes ayant reçu du létrozole présentaient une stabilisation de la maladie.28,33 létrozole néoadjuvant a été administré à 10 femmes ménopausées atteintes d’un cancer de l’endomètre; le médicament a démontré des changements cliniques constructifs et n’a eu aucun impact chirurgical négatif.28,34
Lorsque le traitement par testolactone par rapport à l’anastrozole a été comparé chez les hommes infertiles, l’efficacité des deux agents était similaire.28,35 Patients atteints du syndrome de Klinefelter ont eu un traitement plus efficace avec la testolactone qu’avec l’anastrozole.28,35
Conclusions
Les EI de troisième génération ont montré une SFD supérieure chez les femmes ménopausées atteintes d’un cancer du sein HR +, mais le bénéfice clinique de plus de cinq ans de traitement par IA chez ces patientes n’a pas été établi.4 L’essai National du Projet d’Adjuvant Chirurgical du Sein et de l’intestin (NSABP) B-33 (exémestane) et une randomisation ultérieure de l’AMM.l’essai 17 (létrozole) examinera l’utilisation de ces AIs par rapport au placebo pendant cinq ans supplémentaires.4 Les EI sont une alternative appropriée pour les femmes ménopausées HR + chez qui le tamoxifène est contre-indiqué.4
Les effets bénéfiques des AIS de troisième génération comprennent un profil de toxicité plus tolérable et un DFS supérieur par rapport au tamoxifène. Le niveau d’efficacité entre ces agents et le tamoxifène est comparable. Une incertitude demeure quant à la durée choisie du traitement, au profil de toxicité à long terme et à la séquence d’administration appropriée des EI.4 Nouvelles études sont nécessaires pour produire des modulateurs d’aromatase sélectifs qui produiront moins de toxicité que les AIS.25,36-37
1. Robertson JFR. Fulvestrant (FaslodexÆ)how comment améliorer un bon médicament. Oncologue . 2007;12:774-784.
2. Osborne CK. Traitement médicamenteux: tamoxifène dans le traitement du cancer du sein. En anglais J Med. 1998;339:1609-1618.
3. Réseau national Complet sur le cancer. Lignes directrices de pratique clinique du RCNN en oncologiev v.1.2008. Cancer du sein. www.nccn.org/professionals/physician_gls/f_guidelines.asp . Consulté le 11 octobre 2007.
4. Winer EP, Hudis C, Burstein HJ, et al. American Society of Clinical Oncology technology assessment on the use of aromatase inhibitors as adjuvant therapy for postmenopausal women with hormone receptor-positive breast cancer: status report 2004. J Clin Oncol. 2005;23:619-629.
5. Dunn BK, Wickerham DL, Ford LG. Prévention des cancers hormonaux: cancer du sein. J Clin Oncol. 2005;23:357-367.
6. Smith IE, Dowsett M. Inhibiteurs de l’aromatase dans le cancer du sein. En anglais J Med. 2003;348:2431-2442.
7. Goss PE, Strasser K. Inhibiteurs de l’aromatase dans le traitement et la prévention du cancer du sein. J Clin Oncol. 2001;19:881-894.
8. Lacy CF, Armstrong LL, Goldman MP, et coll., dir. Manuel d’information sur les médicaments. 13e éd. Hudson, OH : Lexi-Comp; 2005: 117 598 871.
9. Ellis MJ, ed. Inhibiteurs de l’aromatase pour le traitement du cancer du sein. Manhasset, NY: Oncology Publishing Group, CMP Healthcare Media; 2005: 29-45.
10. Notice d’emballage Arimidex (anastrozole). Wilmington, DE: AstraZeneca Pharmaceuticals LP; mai 2007.
11. Arora A, Potter JF. Aromatase inhibitors: current indications and future prospects for treatment of postmenopausal breast cancer. J Am Geriatr Soc. 2004;52:611-616.
12. Femara (letrozole) package insert. East Hanover, NJ: Novartis Pharmaceuticals Corp; December 2006.
13. Shaw G. In preventing breast cancer occurrence…anastrozole beats tamoxifen in ATAC. Clin Oncol News . 1/2008. www.clinicaloncology.com/index.asp?si vous avez besoin d’un service, vous pouvez le faire en utilisant la fonction de service ci-dessous. Consulté le 17 mars 2008.
14. Notice d’emballage de l’aromasine (exémestane). New York, New York : Pfizer Inc; février 2007.
15. Baum M, Budzar AU, Cuzick J, et al, pour le Groupe des trialistes de l’ATAC. Anastrozole seul ou en association avec le tamoxifène contre le tamoxifène seul pour le traitement adjuvant des femmes ménopausées atteintes d’un cancer du sein précoce: premiers résultats de l’essai randomisé ATAC. Lancet. 2002;359:2131-2139.
16. Howell A, Cuzick J, Baum M, et al, pour le Groupe des trialistes de l’ATAC. Résultats de l’essai ATAC (Arimidex, Tamoxifène, seul ou en association) après l’achèvement d’un traitement adjuvant de 5 ans pour le cancer du sein. Lancet. 2005;365:60-62.
17. Goss PE, Ingle JN, Martino S, et al. Un essai randomisé de létrozole chez des femmes ménopausées après cinq ans de traitement au tamoxifène pour un cancer du sein à un stade précoce. En anglais J Med. 2003;349:1793-1802.
18. Thrlimann B, Keshaviah A, Coates AS et al, pour le groupe collaboratif Breast International Group (BIG) 1-98. Une comparaison du létrozole et du tamoxifène chez les femmes ménopausées atteintes d’un cancer du sein précoce. En anglais J Med. 2005;353:2747-2757.
19. Coombes RC, Hall E, Gibson LJ, et al, pour l’étude intergroupe Exémestane. Un essai randomisé de l’exémestane après deux à trois ans de traitement au tamoxifène chez des femmes ménopausées atteintes d’un cancer primaire du sein. En anglais J Med. 2004; 350:
1081-1092.
20. Ellis G, Bone HG, Chlebowski R, et al. Une étude de phase 3 de l’effet du traitement par le denosumab sur la densité minérale osseuse chez les femmes recevant des inhibiteurs de l’aromatase pour le cancer du sein non métastatique. Communication présentée à: le 30e Symposium annuel sur le cancer du sein de San Antonio; 13-16 décembre 2007; San Antonio, TX. Résumé 47.
21. Singh S, Cuzick J, Edwards R et coll. Effet de l’anastrozole sur la densité minérale osseuse après un an de traitement: résultats de la sous-étude osseuse de l’Étude Internationale d’intervention sur le cancer du sein (IBIS-II). Document présenté à: le 30e Symposium annuel sur le cancer du sein de San Antonio; 13-16 décembre 2007; San Antonio, TX. Résumé 28.
22. Dellapasqua S, Colleoni M, Gelber RD, Goldhirsch A. Thérapie endocrinienne adjuvante pour les femmes préménopausées atteintes d’un cancer du sein précoce. J Clin Oncol. 2005;23:1736-1750.
23. Institut National du cancer. Traitement du cancer du sein (PDQ). www.cancer.gov/cancertopics/pdq/treatment/breast/healthprofessional . Consulté le 26 décembre 2007.
24. Essais cliniques du Baylor College of Medicine. Essai de Suppression de la fonction ovarienne (SOFT). www.breastcenter.tmc.edu/clinic/trials/soft.htm . Consulté le 26 décembre 2007.
25. Aebi S, Castiglione-Gertsch M. Traitement endocrinien adjuvant pour les très jeunes patients. Poitrine. 2003;12:509-515.
26. ClinicalTrials.gov . Suppression de la fonction ovarienne plus le tamoxifène ou l’exémestane par rapport au tamoxifène seul dans le traitement des femmes préménopausées atteintes d’un cancer du sein hormono-sensible. www.clinicaltrials.gov /. Consulté le 26 décembre 2007.
27. Jean-Pierre J. Inhibiteurs de l’aromatase pour la prévention du cancer du sein. J Clin Oncol. 2005;23:1636-1643.
28. Karaer O, Oruá S, Koyuncu FM. Inhibiteurs de l’aromatase: applications futures possibles. Acta Gynécologie Obstétrique Scand. 2004:83:699-706.
29. Mitwally MF, Casper RF. Utilisation d’un inhibiteur de l’aromatase pour l’induction de l’ovulation chez les patients présentant une réponse inadéquate au citrate de clomifène. Fertil Steril. 2001;75:305-309.
30. Bulun SE, Yang S, Fang Z, et al. Rôle de l’aromatase dans la maladie de l’endomètre. J Biochem stéroïde Mol Biol. 2001;79:19-25.
31. Feuillan P, Merke D, Leschek EW, Cutler GB. Utilisation d’inhibiteurs de l’aromatase dans la puberté précoce. Cancer Endocr Lié. 1999;6:303-306.
32. Shozu M, Sebastian S, Takayama K, et al. Excès d’œstrogènes associé à de nouvelles mutations de gain de fonction affectant le gène de l’aromatase. En anglais J Med. 2003;348:1855-1865.
33. Bowman A, Gabra H, Langdon SP et coll. La réponse CA 125 est associée à l’expression des récepteurs aux œstrogènes dans un essai de phase II du létrozole dans le cancer de l’ovaire: identification d’un sous-groupe sensible au système endocrinien. Clin Cancer Res. 2002; 8: 2233-2239.
34. Berstein L, Maximov S, Gershfeld E, et al. Thérapie néoadjuvante du cancer de l’endomètre avec le létrozole, inhibiteur de l’aromatase: effets endocriniens et cliniques. Eur J Obstétricien Gynécologique Reprod Biol. 2002;105:161-165.
35. Raman JD, Schlegel PN. Inhibiteurs de l’aromatase pour l’infertilité masculine. J Urol. 2002;167:624-629.
36. Simpson ER, Dowsett M. Aromatase et ses inhibiteurs: importance pour le traitement du cancer du sein. Récent Prog Horm Res. 2002; 57:317-338.