Quel est le potentiel redox d’une cellule ?
Mode lecteur
Les potentiels Redox sont utilisés pour caractériser le coût de l’énergie libre et la direction des réactions impliquant un transfert d’électrons, l’une des réactions biochimiques les plus omniprésentes et les plus importantes. De telles réactions de réduction-oxydation sont caractérisées par un changement d’énergie libre qui partage certaines caractéristiques conceptuelles avec celles utilisées pour décrire le pKa dans les réactions acide-base où le transfert de protons est impliqué plutôt que le transfert d’électrons. Dans cette vignette, l’une des plus abstraites du livre, nous discutons de la façon dont le potentiel redox peut être utilisé comme mesure de la force motrice d’une réaction d’oxydoréduction donnée d’intérêt. En revanche, contrairement au pH, il n’y a aucun sens dans lequel on peut attribuer un seul potentiel redox à une cellule entière.
Le potentiel redox, ou plus exactement le potentiel de réduction, d’un composé fait référence à sa tendance à acquérir des électrons et donc à être réduit. Certains lecteurs se souviendront peut-être du mnémonique « OILRIG” qui nous rappelle que « l’oxydation est une perte, la réduction est un gain”, où la perte et le gain sont des électrons. Considérons une réaction qui implique un transfert d’électrons : Aox + ne-↔ Ared où n électrons sont absorbés par la forme oxydée (Aox) pour donner la forme réduite (Ared) du composé A. La différence de potentiel rédox ΔE entre le donneur et l’accepteur d’électrons est liée au changement d’énergie libre associé ΔG de la réaction via ΔG = nFΔE où n est le nombre d’électrons transférés et F est la constante de Faraday (96 485 J/mol/V ou ≈100 kJ/mol/V). En inspectant les valeurs tabulées de ces potentiels, il est possible de développer une intuition de la tendance au transfert d’électrons et donc de la direction de la réaction.

Figure 1: Une « tour redox” montrant le potentiel redox des demi-réactions métaboliques courantes. Les processus métaboliques peuvent être considérés comme des électrons en mouvement entre les molécules, capturant souvent une partie de l’énergie libérée lorsque les électrons passent d’une énergie élevée à des états d’énergie inférieure, comme dans la glycolyse ou la respiration. Les électrons donnés par les « demi-réactions » sur le dessus peuvent être consommés dans une demi-réaction plus bas sur la tour pour compléter une réaction thermodynamiquement favorable. Par exemple, le processus net de glycolyse implique l’oxydation du glucose en pyruvate couplée à la réduction du NAD + en NADH. Comme l’oxydation du glucose se situe au sommet de la tour et que la réduction du NAD+ est en dessous, ce flux d’électrons est thermodynamiquement favorable. En comparant avec la barre d’échelle d’hydrolyse de l’ATP, nous pouvons également voir que ce flux d’électrons est suffisamment favorable pour générer de l’ATP. La respiration aérobie implique de nombreux transferts d’électrons intermédiaires à travers la chaîne de transport des électrons. Plusieurs de ces transitions sont montrées, y compris le succinate d’oxydation en fumarate qui est couplé mécaniquement à la réduction de l’ubiquinone en ubiquinol dans les membranes mitochrondriales internes. Chacun de ces transferts d’électrons intermédiaires doit être thermodynamiquement favorable à lui seul pour que la respiration se poursuive. En comparant à « l’échelle d’hydrolyse de l’ATP », nous pouvons voir que les transformations individuelles de la chaîne de transport des électrons ne sont pas assez énergétiques pour générer de l’ATP par elles-mêmes. Pourtant, ils sont suffisamment favorables pour pomper un proton à travers la cellule ou la membrane mitochondriale. C’est la base énergétique de la chimiosmose: les cellules stockent des quanta d’énergie trop faibles pour la synthèse de l’ATP dans le gradient de protons à travers une membrane. Cette énergie est ensuite utilisée pour générer de l’ATP en convertissant le gradient H+ en liaisons phosphoanhydride sur l’ATP via l’ATP synthase.
Bien que l’ATP soit souvent prétendu être la monnaie énergétique de la cellule, en fait, pour l’équilibre énergétique de la cellule, les porteurs de puissance réductrice ne sont pas moins importants. L’exemple le plus important de ces porteurs est la molécule NADH sous ses formes réduites ou oxydées (NAD+). Nous pouvons utiliser le potentiel redox pour relier ces deux protagonistes moléculaires, et estimer une borne supérieure sur le nombre de molécules d’ATP pouvant être produites à partir de l’oxydation du NADH (produite, par exemple, dans le cycle TCA). Le couple NAD + / NADH a un potentiel redox de E = -0,32 V et il est oxydé par l’oxygène pour donner de l’eau (protons provenant des milieux) avec un potentiel redox de E = + 0,82 V. Les deux sont représentés sur la Figure 1 dans le cadre d’une « tour redox” de demi-réactions biologiques clés qui peuvent être liées pour trouver le changement global du potentiel redox et donc l’énergie libre. Pour la réaction considérée ci-dessus d’oxydation du NADH par l’oxygène, l’énergie libre associée maximale pouvant être extraite est donc
ΔG = n x F x ΔE = 2 x 100 kJ/(molxV) x(0,82-(-0,32)) V= 230 kJ/mol≈ 90 kBT,
où n = 2 et F≈100kJ/mol/V. Comme l’hydrolyse de l’ATP a un changement d’énergie libre de≈50kJ/mol/V. mol dans des conditions physiologiques, nous constatons que 228 kJ/mol suffisent pour produire un maximum de 228/50≈4,5 ATPs. Dans la cellule, l’oxydation du NADH passe par plusieurs étapes de la respiration et entraîne le transfert de 10 protons à travers la membrane contre le potentiel électrochimique (BNID 101773). Ces transferts de protons correspondent à une autre façon de capter l’énergie biochimique. Cette énergie est ensuite utilisée par l’ATPase pour produire 2-3 ATPs. Nous constatons ainsi qu’environ la moitié de l’énergie libérée lors du transfert des électrons du NADH à l’oxygène est conservée dans l’ATP. S’assurer que la réaction se déroule de manière directionnelle pour produire de l’ATP plutôt que de la consommer nécessite qu’une partie de l’énergie soit « gaspillée” car le système doit être hors d’équilibre.
Pourquoi devrait-on discuter des potentiels redox des demi-réactions et non des énergies libres des réactions complètes? Les unités elles-mêmes doivent leurs origines à la capacité dans le domaine de l’électrochimie de mesurer en laboratoire la différence de tension, c’est-à-dire le potentiel mesuré en volts, à travers deux chambres contenant des porteurs d’électrons différents, et d’arrêter la réaction nette avec une tension. L’utilité des potentiels redox pour les demi-réactions réside dans la capacité d’assembler des combinaisons de différents donneurs et accepteurs pour évaluer la faisabilité thermodynamique et le gain d’énergie de chaque réaction considérée. Si vous avez k composés de transfert d’électrons possibles, les réactions possibles ~k2 peuvent être prédites en fonction uniquement des k potentiels redox.
Tout comme nous parlons du pH d’une solution, à première estimation, nous pourrions imaginer qu’il serait possible de parler d’un potentiel redox apparemment analogue de la cellule. La connaissance de la concentration des formes réduites et oxydées d’une paire de réactions donnée définit leur potentiel redox de pool via la relation
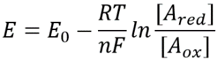
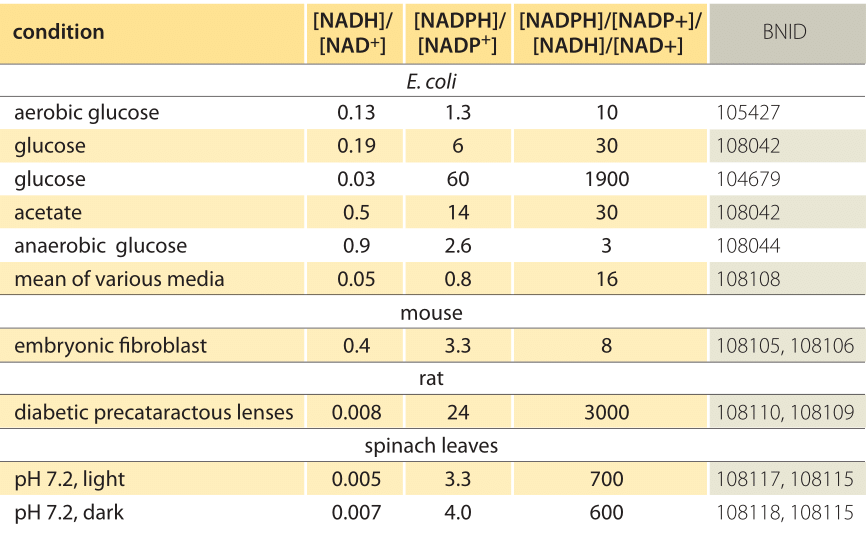
Tableau 1 : rapports de concentration des paires donneuses d’électrons communes NAD/NADH et NADP/NADPH. Comme on peut le voir, le premier est relativement oxydé et le second relativement réduit avec un rapport entre eux généralement beaucoup plus grand que 1.
Cette équation (dite équation de Nernst) fournit la valeur du potentiel redox dans des conditions de concentration typiques de la cellule par opposition aux conditions d’état standard (où par définition =). À titre d’exemple, considérons le don d’un électron à NAD + résultant en la forme oxydée NADH. Dans la matrice mitochondriale, un rapport de 10 fois plus de la forme oxydée est rapporté (BNID 100779) comme indiqué dans le tableau 1. Dans ce cas, nous trouvons que le facteur est ≈30 mV et donc le potentiel rédox passe de -0,32 V à -0,29 V. Pour s’assurer que la direction d’effet que nous avons obtenue est raisonnable, nous remarquons qu’avec une surabondance de la forme oxydée, la tendance à être oxydée par l’oxygène est un peu plus faible comme le montre le fait que le potentiel redox est maintenant plus proche qu’auparavant de celui de la paire d’échange d’électrons oxygène / eau (+ 0,82V).
Une cellule n’est pas à l’équilibre et il y a un couplage faible entre différentes paires redox. Cette situation conduit à l’établissement de différents potentiels redox pour des paires redox coexistantes dans la cellule. Si les flux de production et d’utilisation des formes réduites et oxydées d’une paire redox, Ared et Aox et d’une autre Bred et Box, sont beaucoup plus importants que leur flux d’interconversion, Ared+Box <>Aox+Bred alors A et B peuvent avoir des potentiels redox très différents. En conséquence, il est mal défini de s’interroger sur le potentiel redox global de la cellule car il sera différent pour différents composants de la cellule. En revanche, le pH de la cellule (ou d’un compartiment de celle-ci) est bien mieux défini puisque l’eau sert de milieu universel qui couple les différentes réactions acido-basiques et équilibre ce que l’on appelle le potentiel chimique de toutes les espèces.
Pour un couple redox donné dans un compartiment cellulaire donné, le rapport de concentration des deux formes prescrit le potentiel redox de manière bien définie. Les composés qui échangent rapidement des électrons seront en équilibre relatif et partageront donc un potentiel rédox similaire. Pour voir comment ces idées se déroulent, il est donc très utile de considérer une paire redox qui participe à de nombreuses réactions cellulaires clés et, par conséquent, est étroitement liée à l’état redox de nombreux composés. Le glutathion dans le cytoplasme est un composé tel qu’il participe à la réduction et à l’oxydation des liaisons thiol très répandues (celles contenant du soufre) dans les acides aminés cystéine de nombreuses protéines. Le glutathion est un tripeptide (composé de 3 acides aminés), le central une cystéine qui peut être sous une forme réduite (GSH) ou oxydée où elle forme un dimère avec une cystéine à partir d’une autre molécule de glutathion (notée GSSG). La demi-réaction pour le glutathion est donc de 2 x GSH <> GSSG+2e–+2H+. L’autre demi-réaction est souvent une liaison soufrée qui est « ouverte » dans une protéine réceptive se maintenant ainsi sous forme réduite grâce à l’action constante du glutathion. Le glutathion est également un acteur dominant dans la neutralisation des composés réactifs qui ont une forte tendance à arracher des électrons et donc à oxyder d’autres molécules. De tels composés sont fabriqués sous stress oxydatif comme par example lorsque la capacité des réactions de transfert d’électrons de respiration ou de photosynthèse est atteinte. Collectivement appelés ROS (espèces réactives de l’oxygène), ils peuvent créer des ravages dans la cellule et sont impliqués dans de nombreux processus de vieillissement. Le double rôle du glutathion dans le maintien des protéines repliées correctement et la limitation des ROS ainsi que sa concentration relativement élevée et sa réactivité de transfert d’électrons en font le principal indicateur de l’état redox de la cellule. La concentration de glutathion dans la cellule est ≈10mM (BNID 104679, 104704, 111464), ce qui en fait le deuxième métabolite le plus abondant dans la cellule (après le glutamate), ce qui lui assure un rôle dominant en tant que donneur d’électrons dans le contrôle redox de la fonction protéique. Dans d’autres fonctions des cellules, il existe d’autres paires d’électrons dominantes. Dans les réactions anaboliques biosynthétiques, la paire NADP + / NADPH et dans les réactions cataboliques de dégradation, il s’agit de NAD + / NADH.
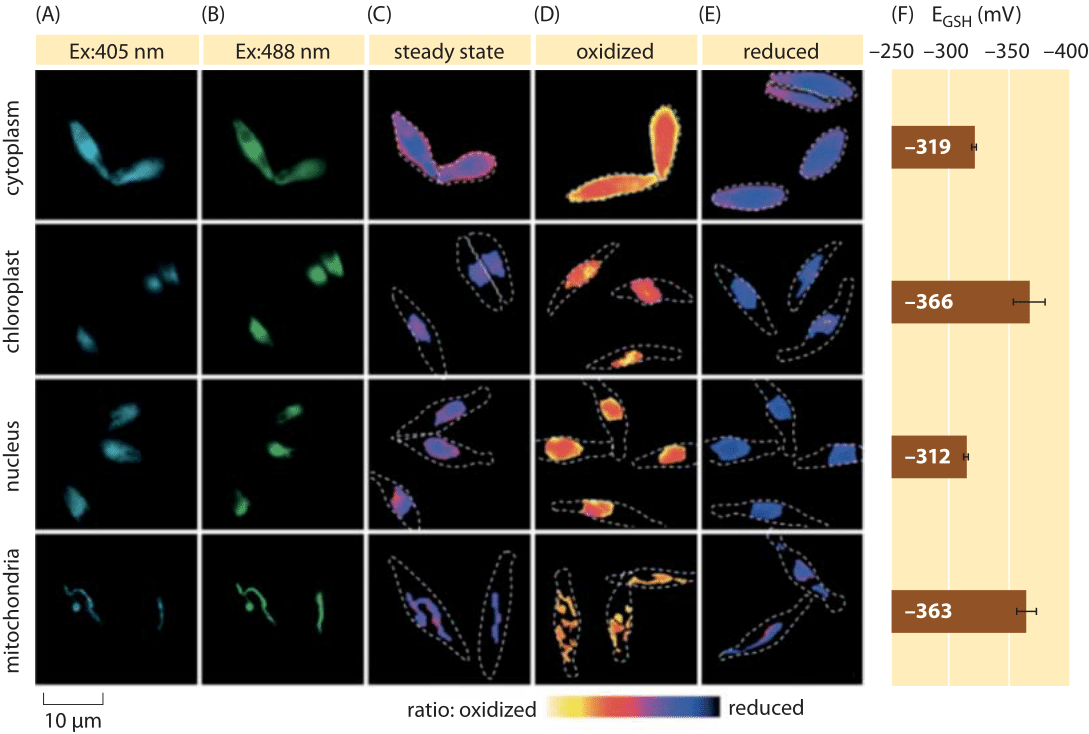
Figure 2: Imagerie du potentiel redox subcellulaire du pool de glutathion chez les algues diatomées in vivo. Imagerie par microscopie à fluorescence de cellules de P. tricornutum exprimant roGFP2 dans diverses localisations subcellulaires. Des images de fluorescence à deux longueurs d’onde d’excitation (A, B) ont été divisées pour obtenir des valeurs ratiométriques (C). Pour l’étalonnage, les images ratiométriques sont capturées dans des conditions d’oxydant fort (150 mm H2O2) (D) et de réducteur (1 mm TNT) (E). Les lignes pointillées représentent le contour des cellules, dessinées en fonction des images en champ lumineux. (F) Le potentiel d’oxydoréduction à l’état d’équilibre du pool de glutathion, EGSH en mV, a été calculé sur la base de l’équation de Nernst en utilisant le niveau d’oxydation sous des valeurs de pH données pour chaque organite. Adapté de : S. Graff van Creveld et al., ISME J., 9:385, 2015.
Comment mesure-t-on les potentiels redox dans les cellules vivantes ? Encore un autre bénéficiaire de la révolution des protéines fluorescentes a fait l’objet de potentiels redox. Un GFP rapporteur a été conçu pour être sensible à l’oxydoréduction par incorporation d’acides aminés cystéine qui affectent la fluorescence en fonction de leur réduction par le pool de glutathion. La figure 2 montre le résultat de l’utilisation d’un tel rapporteur pour examiner le potentiel redox du glutathion dans différents compartiments d’une diatomée.
À partir de mesures de l’état redox du pool de glutathion dans différents organites cellulaires et dans des conditions variables, nous pouvons déduire le rapport des concentrations des formes réduites à oxydées. Les valeurs vont d’environ -170 mV dans l’ER et dans les cellules apoptotiques à environ -300 mV dans la plupart des autres organites et dans les cellules de prolifération (BNID 103543, 101823, 111456, 111465). Étant donné que le potentiel redox standard du glutathion est de -240 mV (BNID 111453, 111463), quel est alors le rapport entre le glutathion réduit et le glutathion oxydé? En utilisant l’équation de Nernst (ou de manière équivalente, à partir de la distribution de Boltzmann), une variation dix fois du rapport produit/ réactif correspond à une augmentation de ≈6 kJ/mol en énergie libre (≈2 kBT). Étant donné les 2 électrons transférés dans la réaction GSH/ GSSG, ce changement de rapport de concentration est généralement égal à 30mV, bien que pour le glutathion, la stoechiométrie de 2 molécules de GSH fusionnant en une molécule liée de manière covalente à GSSG ne constitue qu’une approximation. Le changement de 100 mV rapporté dans toutes les conditions reflète un rapport de concentrations entre des quantités à peu près égales des formes réduites et oxydées (dans les cellules apoptotiques) à plus de 1 000 fois plus de concentration de la forme réduite. En effet, dans la plupart des conditions cellulaires, la forme oxydée n’est qu’une très petite fraction du pool global, mais a toujours des implications physiologiques.
Un aspect déroutant des réactions redox est que le transfert peut prendre plusieurs formes. Dans un cas, il ne s’agit que d’électrons comme dans les réactions effectuées par les cytochromes dans les chaînes de transfert d’électrons. Dans un autre cas courant, il s’agit d’une combinaison d’électrons et de protons comme dans le cofacteur NAD + / NADH où deux électrons et un proton (H +) sont transférés. Enfin, il y a les réactions où le même nombre d’électrons et de protons est transféré alors que l’on serait naturellement tenté de discuter du transfert d’hydrogènes. C’est par example le cas pour la réaction globale d’oxydation du glucose où l’oxygène est réduit en eau. Deux hydrogènes ont donc été transférés, faut-il donc discuter du transfert d’électrons, d’hydrogènes ou de protons ? La définition du potentiel redox (donnée ci-dessus) se concentre uniquement sur l' »état” de l’électron. Qu’en est-il des protons et qu’arrive-t-il à ceux-ci lorsque l’on rencontre une chaîne de réactions de transfert d’électrons où certains composés intermédiaires contiennent les protons d’hydrogène et d’autres non? L’explication réside dans l’eau environnante et leur pH. La réaction se produit à un pH donné, et les composés réactifs sont en équilibre avec ce pH et ainsi émettre ou recevoir un proton n’a aucun effet sur l’énergétique. Le milieu aqueux sert de pool où les protons peuvent être « stationnés” lorsque la réaction de transfert est uniquement composée d’électrons (analogie empruntée au très accessible livre d’introduction en biochimie « The chemistry of life” de Steven Rose). Ces protons stationnés peuvent être empruntés à des stades ultérieurs, comme cela se produit au stade final de la respiration oxydative où la cytochrome oxydase prélève des protons du milieu. Parce que l’on suppose que l’eau est omniprésente, il n’est pas nécessaire de tenir compte des protons, sauf pour connaître le pH dominant qui dépeint la tendance à donner ou à recevoir des protons. This is the reason why we discuss electron donors and acceptors rather than hydrogen donors and acceptors.




