Un bon point de départ pour trouver la configuration électronique d’un ion est la configuration électronique de l’atome neutre.
Dans votre cas, vous devez trouver la configuration électronique de l’anion fluorure, # »F » ^(-) #, alors commencez par écrire la configuration électronique d’un atome de fluor neutre, # »F » #.
Le fluor est situé dans la période 2, groupe 17 du tableau périodique et a un numéro atomique de #9 #. Cela vous indique que l’atome de fluor neutre a un total d’électrons #9 # entourant son noyau.
Sa configuration électronique sera
# »F: »1s^2 2s^2 2p ^5#
Maintenant, l’anion # »F » ^(-) # est formé lorsque l’électron #1# est ajouté à un atome de fluor neutre.
Notez que la sous-coque 2p de l’atome neutre contient #5 # électrons. Sa capacité maximale est en fait de #6 # électrons, deux électrons pour chaque p-orbitale.
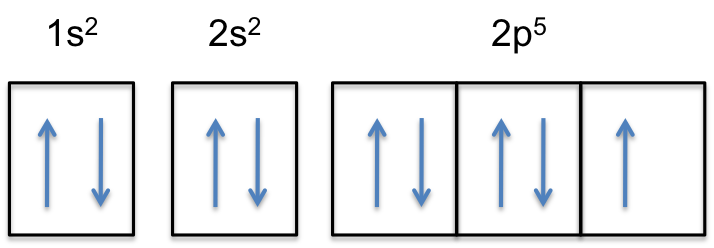
Cela signifie que la # couleur (rouge) (« extra electron ») # sera ajoutée à l’une des trois orbitales 2p, disons à #2p_y #.
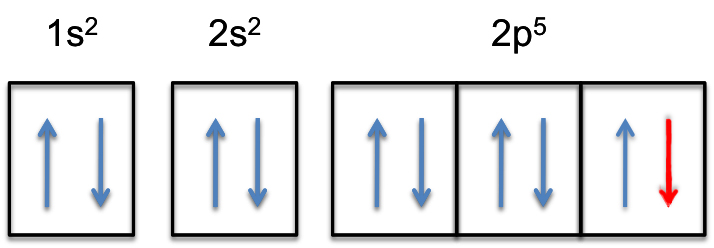
La sous-coque 2p sera maintenant complètement remplie, c’est-à-dire qu’elle contiendra #6# électrons.
La configuration électronique de l’anion fluorure sera donc
#color(green)(/bar(ul(color(white)(a/a) color(black)(« F » ^(-):couleur (blanc) (a) 1s ^ 2color (blanc) (a) 2s^2 color (blanc) (a) 2p^ 6) color (blanc) (a /a) |))) #
Notez que l’anion fluorure a un total de #8 # électrons dans sa deuxième coque, la coque la plus externe. Cela vous indique que l’anion a un octet complet.
Parce que l’anion fluorure est isoélectronique avec le néon, # »Ne » #, vous pouvez écrire sa configuration électronique en utilisant la notation abrégée des gaz nobles comme
# »F » ^(-): #
Ici
# # – la configuration électronique de l’anion fluorure néon