Supposons que vous ayez cet halogénure d’alkyle et que vous deviez déterminer tous les produits d’une réaction d’E2 lorsqu’elle est traitée avec une base forte telle que l’éthoxyde de sodium.

Rappelez-vous dans les réactions E2, nous allons d’abord identifier tous les hydrogènes β et dessiner les produits d’élimination en fonction de chaque ensemble de ces hydrogènes β. Dans ce cas, on a des hydrogènes β sur le côté droit du groupe partant (Br) et sur les deux groupes méthyle.

Donc, un produit va être l’alcène où la double liaison est au milieu :

D’autre part, les hydrogènes sur chaque groupe méthyle donnent le même alcène puisqu’ils sont équivalents comme le confirment le plan de symétrie et la structure de les alcènes :

Ce qui est intéressant, c’est qu’un seul de ces deux alcènes est le produit principal. Le rapport est d’environ 80: 20 en faveur de l’alcène le plus substitué:

La raison en est la stabilité des alcènes. Rappelez-vous que les alcènes les plus substitués sont plus stables. L’ajout de groupes sur la double liaison augmente la stabilité de l’alcène :

Maintenant, en vérifiant nos produits, nous pouvons voir qu’il s’agit d’un mélange d’un alcène trisubstitué avec un alcène disubstitué et l’alcène trisubstitué est le produit majeur de cette réaction d’élimination:
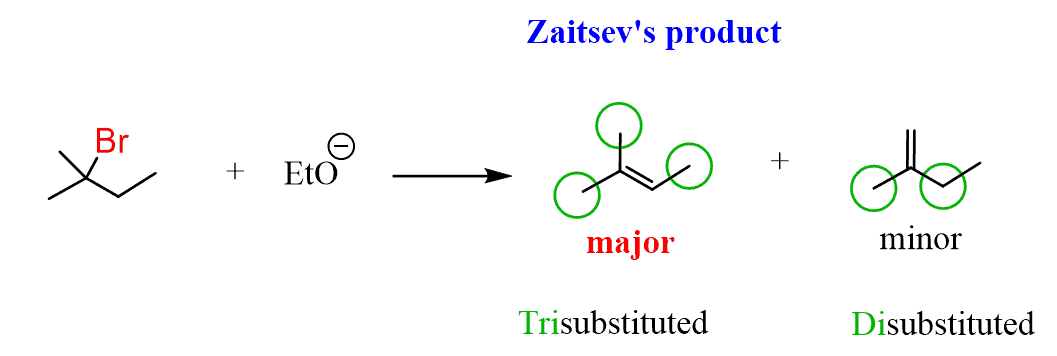
Ainsi, l’alcène le plus substitué est le produit principal de l’élimination de l’E2 en raison de sa plus grande stabilité.
Le chimiste russe Alexander Zaitsev a été le premier à observer ce schéma et la réaction porte son nom. La règle de Zaitsev stipule que dans une réaction d’élimination, plus l’alcène substitué est le produit principal.
La règle de Zaitsev n’est pas toujours suivie dans les réactions E2.
Par exemple, si l’on traite le même halogénure d’alkyle avec une base stériquement encombrée (grande/volumineuse) comme par exemple le tert-butoxyde de potassium, on voit la tendance inverse. L’alcène le moins substitué est le produit principal malgré le fait qu’il soit moins stable.

Ceci est connu sous le nom de règle de Hoffman qui stipule que si nous traitons l’halogénure d’alkyle (ou d’autres substrats appropriés) avec une base fortement entravée stériquement, le produit principal sera l’alcène moins substitué.
La raison en est qu’il est plus facile pour la base volumineuse d’accéder aux protons qui ne sont pas gênés par d’autres carbones.
Et comme les protons des groupes méthyle sont plus accessibles que les protons du groupe CH2, l’alcène moins substitué se forme plus rapidement et est le produit majeur dans ce cas.
Donc, pour résumer, si vous avez besoin de l’alcène le plus substitué, utilisez une base stériquement non entravée.
Si l’alcène substitué par les lies est la cible, utilisez une base entravée par le stérium.

Les bases stériquement et non encombrées les plus courantes sont indiquées ci-dessus.
Ces deux règles sont très applicables en synthèse organique car elles permettent de contrôler quel alcène nous voulons synthétiser. Et ces alcènes peuvent en outre être utilisés pour la préparation d’autres produits.
Régiosélectivité de la réaction E2
Les règles de Zaitsev et de Hoffman démontrent le principe de régiosélectivité dans les réactions d’élimination.
Régiosélectif signifie que la réaction produit sélectivement un régioisomère comme produit principal. Les deux alcènes sont des régioisomères puisque les doubles liaisons sont dans des régions différentes. C’est une façon de s’en souvenir, mais aussi de remarquer que les alcènes sont des isomères constitutionnels. La régiosélectivité est donc la formation préférée d’un isomère constitutionnel.