Votre conseiller vous indique qu’il souhaite que vous utilisiez la CLHP pour analyser votre composé. Vous savez que vous avez déjà entendu parler de cette technique, mais vous ne vous souvenez plus de ce que signifie la CLHP, et encore moins de la façon de le faire! Nous y sommes tous allés, et je parie que vous auriez aimé accorder plus d’attention à cette conférence!
N’ayez crainte – dans cette série d’articles, je vais vous rappeler la puissance de la colonne HPLC 🙂
Dans ce premier article, je vais vous expliquer le principe de la HPLC et vous rappeler ses utilisations – vous serez prêt pour le laboratoire en un rien de temps!
Comment fonctionne la CLHP ?
La chromatographie liquide haute performance, ou HPLC, est un nom long pour une technique puissante basée sur le simple fait que les composés individuels se comportent différemment dans l’eau.
La CLHP sépare et purifie les composés en fonction de leur polarité, ou de leur tendance à aimer ou à détester l’eau. Pour mettre la polarité en contexte, considérez que l’huile est un liquide apolaire qui ne se mélange pas à l’eau. L’éthanol, en revanche, est polaire et, comme beaucoup d’entre vous le savent, se mélange très bien à l’eau (Vodka et coca-cola, n’importe qui??).
J’ai essayé de simplifier l’ensemble du processus dans la figure 1 ci-dessous, mais regardons d’abord les principaux composants impliqués dans la CLHP. Excuses à l’avance pour un jargon inévitable!
Les composants
La colonne HPLC
On parle aussi de phase stationnaire. C’est le cheval de bataille de la machine HPLC, elle est fabriquée à partir d’une variété de substances (souvent de la silice) et est de nature très compacte. Les particules de silice sont fonctionnalisées par de longues chaînes carbonées. Les chaînes carbonées sont apolaires et donc plus la chaîne est longue, plus la colonne devient apolaire. Les colonnes contenant des chaînes à 18 carbones sont couramment utilisées et sont connues sous le nom de colonnes C18.
L’échantillon de CLHP
Les types d’échantillons varient considérablement selon le champ et le type de composés en question. La CLHP peut être utilisée pour analyser des composés dans des échantillons biologiques (urine, sang, salive et muscles), des échantillons environnementaux, la chimie médicinale (médicaments) et la microbiologie (toxines produites par des champignons et des bactéries).
Injection de l’échantillon
Les échantillons sont injectés dans la colonne HPLC. Cela était effectué manuellement, ce qui signifie qu’une pauvre âme devait rester assise près de la machine HPLC pendant des heures en injectant chaque échantillon avec une seringue, parfois toute la nuit!
Heureusement, les nouveaux modèles ont un injecteur automatique, réduisant l’entrée manuelle et permettant un débit plus élevé. Les machines modernes sont équipées d’un logiciel permettant à l’utilisateur de saisir une liste d’échantillons, combien et dans quel ordre ils doivent être injectés. Ainsi, vous pouvez profiter de votre déjeuner pendant que votre CLHP fonctionne tout seul!
La phase mobile
Il ne s’agit en réalité que d’un mélange d’eau et d’un solvant organique (généralement de l’acétonitrile ou du méthanol). La phase mobile tire son nom du fait qu’elle se déplace dans la colonne et en même temps élue (ou élimine) les composés de la colonne.
Les composés sont souvent élués le long d’un gradient de concentration. Si vous êtes comme moi, concentration et gradient sont deux mots que vous détestez voir se réunir dans une phrase! Cela signifie simplement que le pourcentage d’eau dans la phase mobile diminue avec le temps, tandis que le pourcentage de solvant apolaire augmente simultanément. Cela signifie que la phase mobile devient progressivement plus apolaire. Ne vous inquiétez pas trop des dégradés pour l’instant, car ils apparaîtront à nouveau dans un article de suivi.
L’exécution de la CLHP
La CLHP peut être effectuée dans un certain nombre de modes. La méthode la plus couramment utilisée est connue sous le nom de phase inversée (RP-HPLC) et c’est ce que je décris ici. Dans ce mode, les composés sont séparés en commençant par les composés les plus polaires et en terminant par les composés apolaires. Pour tous les modes, une pompe à haute puissance déplace l’échantillon et la phase mobile dans la colonne. Une course typique peut prendre entre 10 et 60 minutes.
Le principe de la CLHP – un examen plus approfondi
Maintenant que vous avez une idée des composants impliqués, passons au principe un peu plus en détail.
J’ai mentionné ci-dessus que la CLHP sépare les composés sur la base de la polarité. Mais comment cela fonctionne-t-il réellement? Anglais s’il vous plaît! Au fur et à mesure que le gradient entre en jeu, la concentration en solvant augmente tandis que la concentration en eau diminue. Cela rend la phase mobile de plus en plus apolaire. Les composés contenus dans l’échantillon colleront aux chaînes carbonées de la colonne, les composés les plus apolaires collant les plus forts et les composés les plus polaires collant faiblement.
La figure 1 montre ce qu’il advient d’un échantillon contenant un mélange de composés après injection dans la colonne. Les composés se lient à la colonne et sont rincés à différents moments, selon qu’ils sont plus susceptibles de coller à la colonne ou à la phase mobile lors de son pompage. Le temps que chaque composé élue (ou évacue) de la colonne est connu sous le nom de temps de rétention de ce composé (Rf).
Figure 1: Le principe de la CLHP
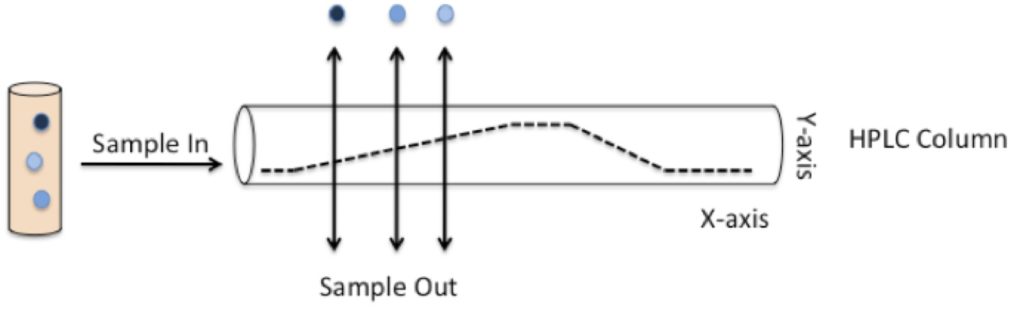
Figure 1: Des composés de polarités différentes (indiqués comme des nuances de bleu assombrissant) sont injectés dans la colonne de la CLHP (cylindre entier). La phase mobile est pompée à travers la colonne, et l’ajout de solvant le long d’un gradient de concentration (représenté en pointillés noirs) diminue continuellement la polarité globale de la phase mobile (axe Y). Les composés sont capables de coller à la colonne ou à la phase mobile, selon leur polarité. Les composés finiront par adhérer à la phase mobile lorsque leur polarité correspond à celle de la phase mobile. Ils se dissocieront alors de la colonne et seront élués à un moment donné (axe des abscisses) pendant la course. Ce temps est connu sous le nom de Rf pour ce composé.
Comprendre la sortie
La sortie ou les résultats d’une exécution HPLC sont généralement considérés comme un chromatogramme (Figure 2). Il s’agit d’une série horizontale de pics représentant des composés élués de la colonne avec différentes valeurs Rf. Les équipements HPLC modernes sont souvent couplés à un détecteur à matrice de diodes (DAD), ce qui permet à l’utilisateur d’examiner le chromatogramme résultant de composés séparés dans des longueurs d’onde de 190 nm à 900 nm. Si les composés étudiés sont connus, l’utilisateur peut choisir de ne regarder que 1 ou quelques longueurs d’onde sélectionnées. Par exemple, la cocaïne peut être observée à 254 nm.
Figure 2: Un chromatogramme HPLC typique

Figure 2: Ce chromatogramme montre la séparation des composés d’une réaction chimique, et le chromatogramme est visualisé à 254 nm. Deux pics principaux se produisent à 8,20 et 9 minutes, représentant deux composés avec ces temps de rétention. Le nombre d’unités d’absorbance (AU) est indiqué sur l’axe des ordonnées tandis que le temps de la course est indiqué sur l’axe des abscisses.
Applications
En biologie et en médecine, la CLHP est souvent utilisée comme outil analytique pour analyser des échantillons biologiques et environnementaux pour détecter la présence ou l’absence de composés connus (par exemple des métabolites, des médicaments, des toxines, des pesticides) et peut aider à identifier des composés inconnus.
En chimie, cependant, la CLHP est couramment utilisée pour surveiller les réactions chimiques, ainsi que pour déterminer la pureté des produits. De plus, le procédé de CLHP peut être modifié en CLHP préparative, ce qui permet de purifier les composés d’intérêt pour une utilisation ultérieure.
La CLHP peut sembler très compliquée au début, mais rassurez-vous, tout comme la plupart des autres techniques de laboratoire, cela a beaucoup plus de sens lorsque vous le faites réellement.
Restez à l’écoute pour mes articles de suivi dans les semaines à venir, dans lesquels je vais passer en revue quelques conseils sur la façon dont vous pouvez tirer le meilleur parti de votre exécution de CLHP en fonction de votre objectif de recherche, ainsi que discuter objectivement de la façon dont la CLHP peut être utilisée dans votre recherche.
Y a-t-il d’autres aspects de cette technique que vous aimeriez aborder plus en détail? Si c’est le cas, nous aimerions avoir de vos nouvelles!
Happy HPLC-ing 🙂
Cela vous a-t-il aidé? Ensuite, veuillez partager avec votre réseau.