mekkora a sejt redoxpotenciálja?
Reader Mode
A Redoxpotenciálokat arra használják, hogy jellemezzék a szabad energiaköltséget és az elektronátvitellel járó reakciók irányát, amely az egyik legelterjedtebb és legfontosabb biokémiai reakció. Az ilyen redukciós-oxidációs reakciókat egy szabad energiaváltozás jellemzi, amely bizonyos fogalmi jellemzőket oszt meg azzal, amelyet a PKA leírására használnak sav-bázis reakciókban, ahol protontranszferről van szó, nem pedig elektrontranszferről. Ebben a matricában, amely a könyv egyik legelvontabb, megvitatjuk, hogyan lehet A redoxpotenciált felhasználni egy adott érdekes oxidációs-redukciós reakció hajtóerejének mérésére. Ezzel szemben a pH-val ellentétben nincs értelme egyetlen redoxpotenciált hozzárendelni egy egész sejthez.
egy vegyület redoxpotenciálja, pontosabban redukciós potenciálja arra utal, hogy hajlamos elektronokat szerezni és ezáltal redukálni. Néhány olvasó talán emlékszik a mnemonikus “OILRIG” – re, amely arra emlékeztet minket, hogy” az oxidáció veszteség, a redukció nyereség”, ahol a veszteség és a nyereség az elektronok. Vegyünk egy olyan reakciót, amely elektrontranszfert foglal magában: Aox + ne– az AOX ahol n elektronokat vesz fel az oxidált forma (Aox), hogy az a vegyület redukált formáját (Ared) kapjuk. A redoxpotenciál különbség az elektrondonor és az akceptor között a kapcsolódó szabadenergia-változással függ össze, amely során a reakció során a következő reakció lép fel: a reakció során a reakció során a reakció során a reakció során a reakció során a reakció során a reakció során a reakció során a reakció során a reakció során a reakció során a reakció során a reakció során a reakció során a reakció során a reakció során a reakció során az elektronok száma (n), az elektronok száma (F) pedig Faraday állandója (96 485 J/mol/V vagy 100 kJ/mol/V). Ezeknek a potenciáloknak a táblázatos értékeinek vizsgálatával lehetőség nyílik arra, hogy intuíciót alakítsunk ki az elektrontranszfer hajlamára, tehát a reakció irányára.

1.ábra: “redox torony”, amely a gyakori metabolikus félreakciók redox potenciálját mutatja. Az anyagcsere folyamatok mozgó elektronoknak tekinthetők a molekulák között, gyakran megragadják a felszabaduló energia egy részét, amikor az elektronok nagy energiából alacsonyabb energiájú állapotokba mozognak, mint a glikolízis vagy a légzés során. A tetején lévő “félreakciók” által adományozott elektronok a toronynál alacsonyabb félreakcióban fogyaszthatók, hogy termodinamikailag kedvező reakciót hajtsanak végre. Például a glikolízis nettó folyamata magában foglalja a glükóz piruváttá történő oxidációját, amely a NAD+ NADH redukciójához kapcsolódik. Mivel a glükóz oxidációja a torony tetején helyezkedik el, a NAD+ redukciója pedig alatta van, ez az elektronáramlás termodinamikailag kedvező. Az ATP hidrolízis skála sávjával összehasonlítva azt is láthatjuk, hogy ez az elektronáramlás elég kedvező az ATP előállításához. Az aerob légzés sok köztes elektronátvitelt foglal magában az elektrontranszport láncon keresztül. Ezen átmenetek közül több látható, beleértve az oxidációt szukcinát fumaráttá, amely mechanikusan kapcsolódik az ubiquinon ubiquinol redukciójához a belső mitokrondriális membránokban. Ezen közbenső elektrontranszferek mindegyikének önmagában termodinamikailag kedvezőnek kell lennie a légzés folytatásához. Az “ATP hidrolízis skálával” összehasonlítva láthatjuk, hogy az elektrontranszport láncban az egyes transzformációk nem elég energikusak ahhoz, hogy önmagukban ATP-t generáljanak. Mégis elég kedvezőek ahhoz, hogy protont pumpáljanak a sejten vagy a mitokondriális membránon. Ez a kemioszmózis energetikai alapja: a sejtek túl kicsi energiát tárolnak az ATP szintéziséhez a membránon átívelő protongradiensben. Ezt az energiát később ATP előállítására használják a H átalakításával+ gradiens foszforanhidrid kötésekké az ATP-n keresztül ATP szintáz.
bár az ATP-t gyakran állítják a sejt energia pénznemének, valójában a sejt energetikai egyensúlya szempontjából a redukáló erő hordozói maguk sem kevésbé fontosak. Ezeknek a hordozóknak a legfontosabb példája a NADH molekula redukált vagy oxidált (NAD+) formáiban. A redoxpotenciált felhasználhatjuk e két molekuláris főszereplő összekapcsolására, és megbecsülhetjük a NADH oxidációjával előállítható ATP molekulák számának felső határát (például a TCA ciklusban). A NAD+/NADH pár redoxpotenciálja E = -0,32 V, és oxigénnel oxidálódik, hogy vizet adjon (a közegből származó protonok), amelynek redoxpotenciálja E = +0,82 V. mindkettőt az 1.ábra mutatja a kulcsfontosságú biológiai félreakciók “redox torony” részeként, amelyek összekapcsolhatók a teljes redoxpotenciál-változás és így a szabad energia megtalálásához. A reakció minősül a fenti a NADH oxidáció által oxigén, a legnagyobb összefüggő szabad energia nyerhető, így
ΔG = n x F x ΔE = 2 x 100 kJ/(molxV) x (0.82-(-0.32)) V = 230 kJ/mol≈ 90 kBT,
ahol n=2, F≈100kJ/mol/V., Mint az ATP hidrolízis van egy szabad energia változás ≈50kJ/mol alatt élettani körülmények között megtaláljuk 228 kJ/mol elegendő, hogy készítsen egy maximum 228/50≈4.5 ATPs. A sejtben a NADH oxidációja a légzés több lépésén keresztül megy végbe, és 10 proton átvitelét eredményezi a membránon az elektrokémiai potenciállal szemben (BNID 101773). Ezek a proton transzferek megfelelnek a biokémiai energia rögzítésének egy másik módjának. Ezt az energiát az ATPáz 2-3 ATP előállítására használja fel. Így azt találjuk, hogy az elektronok NADH-ból oxigénbe történő átvitelében felszabaduló energia körülbelül fele az ATP-ben konzerválódik. Annak biztosítása, hogy a reakció irányított módon haladjon az ATP előállításához, ahelyett, hogy elfogyasztaná, megköveteli, hogy az energia egy része “elpazarolódjon”, mivel a rendszernek egyensúlyon kívül kell lennie.
miért kellene a félreakciók redox potenciáljáról beszélni, nem pedig a teljes reakciók szabad energiáiról? Maguk az egységek köszönhetik eredetüket annak a képességnek, hogy az elektrokémia területén a laboratóriumban megmérik a feszültségkülönbséget, azaz a voltban mért potenciált két különböző elektronhordozót tartalmazó kamrában, és a nettó reakciót feszültséggel leállítják. A redox potenciál hasznossága a félreakciók esetében abban rejlik, hogy képesek különböző donorok és akceptorok kombinációit összeállítani, hogy felmérjék minden megfontolt reakció termodinamikai megvalósíthatóságát és energianyereségét. Ha k lehetséges elektrontranszfer-vegyületei vannak, akkor a ~k2 lehetséges reakciók csak a K redoxpotenciálok alapján jósolhatók meg.
ahogy egy oldat pH-járól beszélünk, először azt gondolhatnánk, hogy lehetséges lenne a sejt látszólag analóg redoxpotenciáljáról beszélni. Egy adott reakciópár redukált és oxidált formáinak koncentrációjának ismerete meghatározza azok redoxpotenciálját a reláción keresztül
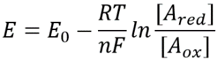
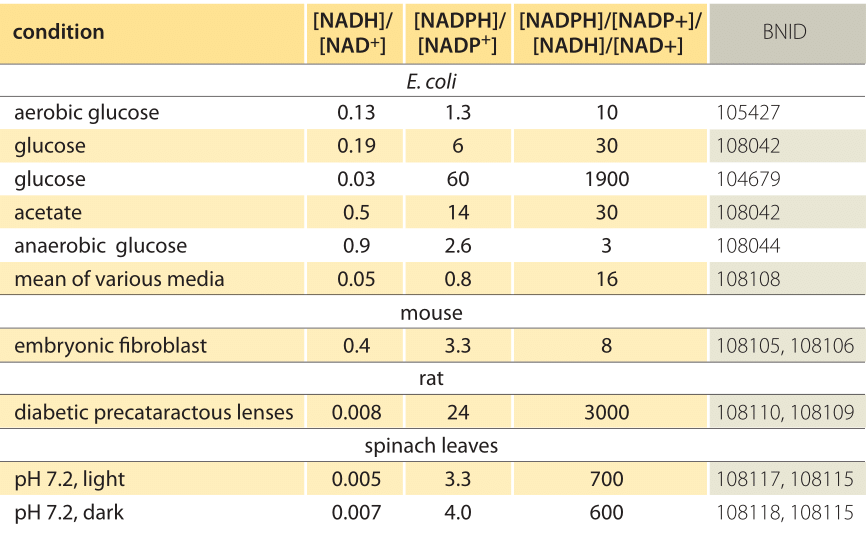
1.táblázat: a közös elektrondonor Párok koncentrációs aránya NAD/NADH és NADP/NADPH. Mint látható, az első viszonylag oxidált, a második pedig viszonylag csökkent, köztük általában sokkal nagyobb arányban, mint 1.
Ez az egyenlet (ún Nernst-egyenlet) megadja a redoxpotenciál értékét a cellára jellemző koncentrációs körülmények között, szemben a standard állapotfeltételekkel (ahol definíció szerint =). Példaként vegye figyelembe az elektron adományozását a NAD+ – hoz, ami NADH oxidált formát eredményez. A mitokondriális mátrixban az oxidált forma 10-szeres arányáról számoltak be (BNID 100779) az 1.táblázat szerint. Ebben az esetben azt találjuk, hogy a tényező 30 MV, így a redoxpotenciál -0,32 V-ról -0,29 V-ra változik. Annak érdekében, hogy a kapott hatás iránya ésszerű legyen, észrevesszük, hogy az oxidált forma túlcsordulásával az oxigén oxidációs hajlama valamivel alacsonyabb, amint azt az a tény is mutatja, hogy a redoxpotenciál most közelebb van, mint korábban az oxigén/víz elektroncserélő páréhoz (+0,82 V).
egy sejt nincs egyensúlyban, és a különböző redoxpárok között gyenge a kapcsolat. Ez a helyzet különböző redoxpotenciálok kialakulásához vezet a redox Párok együttéléséhez a sejtben. Ha egy redox pár redukált és oxidált formáinak, az Ared és Aox, valamint egy másik tenyésztett és doboz termelési és felhasználási folyamata sokkal nagyobb, mint az interkonverziós fluxusuk, az Ared+Box<>AOX+tenyésztett, akkor az A és B nagyon különböző redox potenciállal rendelkezik. Ennek eredményeként rosszul definiálható a sejt teljes redoxpotenciáljáról kérdezni, mivel a sejten belüli különböző komponensek esetében eltérő lesz. Ezzel szemben a sejt (vagy annak valamilyen rekeszének) pH-ja sokkal jobban meghatározható, mivel a víz univerzális közegként szolgál, amely összekapcsolja a különböző sav-bázis reakciókat, és egyensúlyba hozza az összes faj kémiai potenciálját.
egy adott redox pár esetében egy adott sejtrekeszben a két forma koncentrációs aránya jól meghatározott módon írja elő a redoxpotenciált. Az elektronokat gyorsan cserélő vegyületek relatív egyensúlyban lesznek, így hasonló redoxpotenciállal rendelkeznek. Ahhoz, hogy lássuk, hogyan játszanak ezek az ötletek, ezért a leghasznosabb egy olyan redoxpárt figyelembe venni, amely számos kulcsfontosságú sejtreakcióban részt vesz, és ennek eredményeként szorosan kapcsolódik számos vegyület redox állapotához. A citoplazmában található glutation olyan vegyület, amely számos fehérje cisztein aminosavaiban részt vesz a rendkívül elterjedt tiolkötések (ként tartalmazó kötések) redukciójában és oxidációjában. A glutation egy tripeptid (3 aminosavból áll), a központi cisztein, amely redukált (GSH) vagy oxidált formában lehet, ahol dimert képez egy másik glutationmolekula ciszteinjével (GSSG). A glutation félreakciója tehát 2 x GSH <> GSSG + 2e– + 2h+. A másik fél reakció gyakran egy kénkötés, amelyet” nyitnak ” egy receptív fehérjében, így redukált formában tartják a glutation állandó hatása miatt. A glutation domináns szerepet játszik a reaktív vegyületek semlegesítésében is, amelyek nagy tendenciát mutatnak az elektronok megragadására és ezáltal más molekulák oxidálására. Az ilyen vegyületeket oxidatív stressz alatt állítják elő, például amikor elérik a légzés vagy a fotoszintézis elektrontranszfer-reakcióinak kapacitását. Együttesen ROS-nak (reaktív oxigén fajok) nevezik pusztítást okozhatnak a sejtben, és számos öregedési folyamatban részt vesznek. A glutation kettős szerepe a fehérjék megfelelő hajtogatásában és a ROS korlátozásában, valamint viszonylag magas koncentrációja és elektrontranszfer reaktivitása teszi a sejt redox állapotának elsődleges proxyjává. A glutation koncentrációja a sejtben 10 mm (bnid 104679, 104704, 111464), így a sejt második leggyakoribb metabolitja (a glutamát után), biztosítva, hogy domináns szerepet játsszon elektrondonorként a fehérje redox szabályozásában funkció. A sejtek más funkcióiban más domináns elektronpárok is vannak. A bioszintetikus anabolikus reakciókban a NADP+ / NADPH pár, a bontási katabolikus reakciókban pedig NAD+ / NADH.
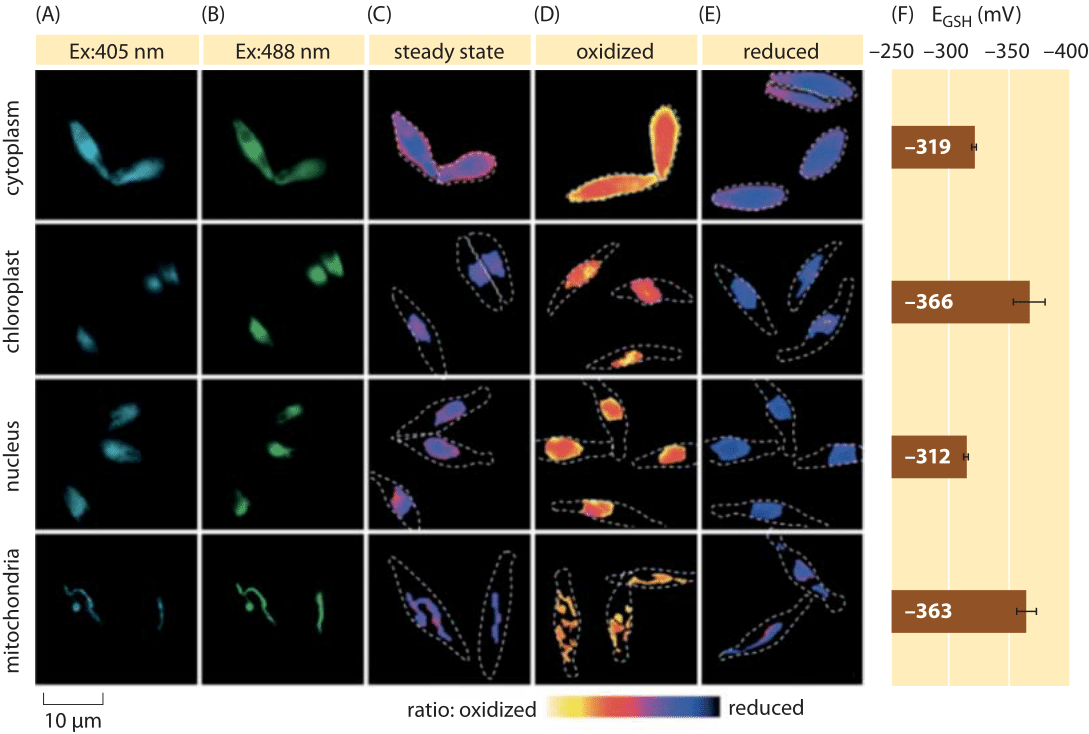
2.ábra: a glutation-medence szubcelluláris redoxpotenciáljának képalkotása kovamoszat algákban in vivo. A roGFP2-t expresszáló P. tricornutum sejtek fluoreszcens mikroszkópos képalkotása különböző szubcelluláris lokalizációkban. A fluoreszcencia képeket két gerjesztési hullámhosszon (A, B) osztottuk, hogy ratiometrikus értékeket kapjunk (C). A kalibráláshoz a ratiometrikus képeket erős oxidálószer (150 mM H2O2) (D) és redukálószer (1 mM DTT) (E) körülmények között kell rögzíteni. A szaggatott vonalak a sejtek körvonalait képviselik, a fényes mező képei alapján rajzolva. (F) a glutation-medence egyensúlyi állapotú redoxpotenciálját, az egsh-t mV-ben, a Nernst-egyenlet alapján számítottuk ki, az egyes organellákra adott pH-értékek alatti oxidációs szint felhasználásával. Adaptálva: S. Graff van Creveld et al., ISME J., 9:385, 2015.
hogyan lehet mérni a redoxpotenciálokat az élő sejtekben? A fluoreszcens fehérje forradalom egy másik kedvezményezettje a redox potenciál volt. Egy riporter GFP-t úgy terveztek, hogy redoxérzékeny legyen cisztein aminosavak beépítésével, amelyek befolyásolják a fluoreszcenciát a glutation-medence általi redukciójuk alapján. A 2. ábra azt mutatja, hogy egy ilyen riporter hogyan vizsgálta a glutation redoxpotenciált a kovamoszat különböző rekeszeiben.
a glutation-medence redox állapotának méréséből különböző sejtszervecskékben és különböző körülmények között következtethetünk a redukált és oxidált formák koncentrációjának arányára. Az értékek az ER-ben és az apoptotikus sejtekben körülbelül -170 mV-tól a legtöbb más organellában és proliferációs sejtben körülbelül -300 mV-ig terjednek (BNID 103543, 101823, 111456, 111465). Tekintettel arra, hogy a glutation standard redoxpotenciálja -240 mV (BNID 111453, 111463), akkor mekkora a redukált oxidált glutation aránya? A Nernst-egyenlet (vagy ekvivalens módon a Boltzmann-eloszlásból) alkalmazásával a termék/reagens Arány tízszeres változása megfelel a szabad energia 6 kJ/mol (2 Kbt) növekedésének. Tekintettel a GSH/GSSG reakcióban átvitt 2 elektronra, ez a koncentrációarány-változás általában 30 MV, bár a glutation esetében 2 GSH molekula sztöchiometriája egyesül egy GSSG kovalensen kötött molekulával, ez csak közelítést eredményez. A körülmények között jelentett 100 mV-os változás a redukált és oxidált formák (apoptotikus sejtekben) körülbelül azonos mennyisége közötti koncentrációk arányát tükrözi a redukált forma több mint 1000-szeresére. Valójában a legtöbb sejtes körülmények között az oxidált forma csak a teljes medence nagyon kis része, de még mindig fiziológiai következményekkel jár.
a redox reakciók egyik zavaró aspektusa, hogy az átvitel többféle formát ölthet. Egy esetben csak elektronok, mint a citokrómok által az elektronátviteli láncokban végrehajtott reakciókban. Egy másik gyakori esetben elektronok és protonok kombinációja, mint a NAD+/NADH kofaktorban, ahol két elektron és egy proton (H+) kerül átvitelre. Végül ott vannak azok a reakciók, ahol ugyanannyi elektron és proton kerül át, amikor az ember természetesen kísértésbe esne, hogy megvitassa a hidrogén átadását. Ez a helyzet például a glükóz oxidációjának általános reakciójára, ahol az oxigén vízre redukálódik. Így két hidrogén került át, tehát meg kell vitatni az elektronok, hidrogének vagy protonok átadását? A redoxpotenciál (fent megadott) meghatározása csak az elektron “állapotára”összpontosít. Mi a helyzet a protonokkal, és mi történik ezekkel, amikor az ember elektrontranszfer-reakciók láncolatával találkozik, ahol egyes köztes vegyületek hidrogénprotonokat tartalmaznak, mások pedig nem? A magyarázat a környező vízben és azok pH-jában rejlik.a reakció egy adott pH-n történik, és a reagáló vegyületek egyensúlyban vannak ezzel a pH-val, így a proton kibocsátása vagy befogadása nincs hatással az energetikára. A vizes közeg medenceként szolgál, ahol a protonok “parkolhatók”, ha az átviteli reakció kizárólag elektronokból áll (az analógia Steven Rose nagyon hozzáférhető bevezető biokémiai könyvéből,” Az élet kémiája ” kölcsönzött). Ezeket a parkolt protonokat a következő szakaszokban lehet kölcsönvenni, amint az az oxidatív légzés utolsó szakaszában történik, ahol a citokróm-oxidáz protonokat vesz fel a közegből. Mivel feltételezzük, hogy a víz mindenütt jelen van, nem kell figyelembe venni a protonokat, kivéve az uralkodó pH ismeretét, amely a protonok adására vagy fogadására való hajlamot ábrázolja. This is the reason why we discuss electron donors and acceptors rather than hydrogen donors and acceptors.




