Varmekurver
Figur \(\PageIndex{3}\) viser en varmekurve, et plott av temperatur versus oppvarmingstid, for en 75 g prøve av vann. Prøven er i utgangspunktet is ved 1 atm og -23°C; når varme tilsettes, øker temperaturen på isen lineært med tiden. Hellingen på linjen avhenger av både isens masse og den spesifikke varmen (Cs) av is, som er antall joules som kreves for å øke temperaturen på 1 g is med 1°C. Etter hvert som temperaturen på isen øker, absorberer vannmolekylene i iskrystallen mer og mer energi og vibrerer mer kraftig. Ved smeltepunktet har de nok kinetisk energi til å overvinne attraktive krefter og bevege seg i forhold til hverandre. Etter hvert som mer varme tilsettes, øker ikke temperaturen i systemet ytterligere, men forblir konstant ved 0°C til all isen har smeltet. Når all isen er omgjort til flytende vann, begynner temperaturen på vannet igjen å øke. Nå øker imidlertid temperaturen langsommere enn før fordi den spesifikke varmekapasiteten til vann er større enn isens. Når temperaturen på vannet når 100°C, begynner vannet å koke. Også her forblir temperaturen konstant ved 100°C til alt vannet er omgjort til damp. På dette tidspunktet begynner temperaturen igjen å stige, men med raskere hastighet enn sett i de andre fasene fordi dampens varmekapasitet er mindre enn is eller vann.
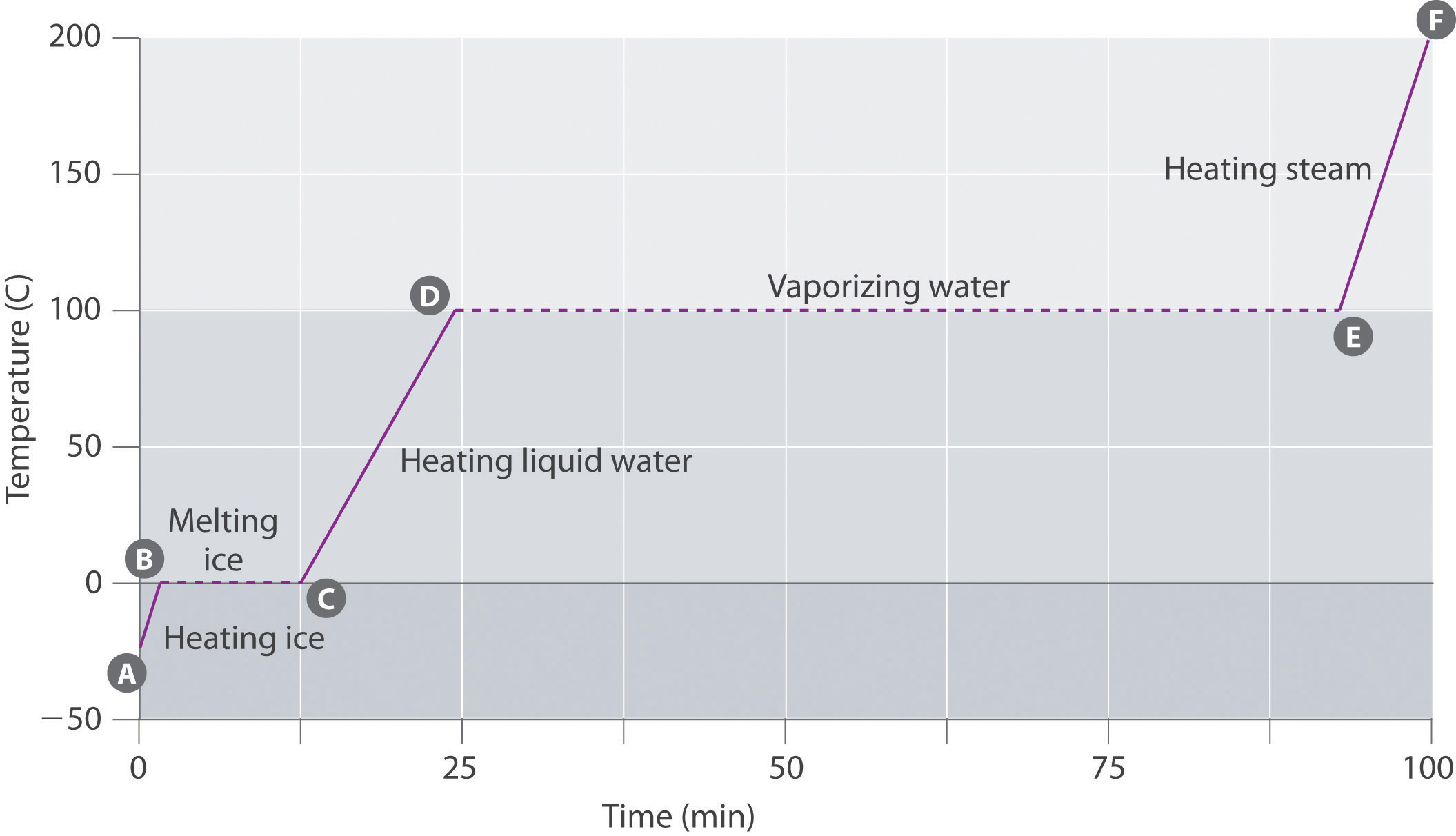
dermed endres ikke temperaturen i et system under en faseendring. I dette eksemplet, så lenge selv en liten mengde is er til stede, forblir temperaturen på systemet ved 0°C under smelteprosessen, og så lenge selv en liten mengde flytende vann er til stede, forblir temperaturen på systemet ved 100°C under kokeprosessen. Hastigheten som varme tilsettes, påvirker ikke temperaturen på is / vann eller vann / dampblanding fordi den tilsatte varmen brukes utelukkende for å overvinne de attraktive kreftene som holder den mer kondenserte fasen sammen. Mange kokker tror at maten vil koke raskere hvis varmen er skrudd opp høyere slik at vannet koker raskere. I stedet vil potten med vann koke til tørrhet før, men temperaturen på vannet er ikke avhengig av hvor kraftig det koiler.
temperaturen på en prøve endres ikke under en faseendring.
hvis varme tilsettes med konstant hastighet, som I Figur \(\PageIndex{3}\), er lengden På de horisontale linjene, som representerer tiden hvor temperaturen ikke endres, direkte proporsjonal med størrelsen på entalpiene knyttet til faseendringene. I Figur \(\PageIndex{3}\) er den horisontale linjen ved 100°C mye lengre enn linjen ved 0 hryvnias C fordi dampens entalpi er flere ganger større enn fusjonens entalpi.en overopphetet væske er en prøve av en væske ved temperaturen og trykket der den skal være en gass. Overopphetede væsker er ikke stabile; væsken vil til slutt koke, noen ganger voldsomt. Fenomenet overoppheting forårsaker «bumping» når en væske oppvarmes i laboratoriet. Når et reagensrør som inneholder vann oppvarmes over En Bunsenbrenner, kan for eksempel en del av væsken lett bli for varm. Når den overopphetede væsken konverterer til en gass, kan den skyve eller «støte» resten av væsken ut av reagensrøret. Ved å plassere en rørestang eller et lite stykke keramikk (en» kokende chip») i reagensrøret, kan bobler av damp dannes på overflaten av objektet, slik at væsken kokes i stedet for å bli overopphetet. Superheating er grunnen til at en væske oppvarmet i en jevn kopp i en mikrobølgeovn ikke kan koke før koppen er flyttet, når bevegelsen av koppen tillater bobler å danne.