Kokepunkt
når en væske oppvarmes, øker den gjennomsnittlige kinetiske energien til partiklene. Fordampningshastigheten øker ettersom flere og flere molekyler er i stand til å unnslippe væskens overflate i dampfasen. Til slutt nås et punkt når molekylene gjennom hele væsken har nok kinetisk energi til å fordampe. På dette punktet begynner væsken å koke. Kokepunktet er temperaturen der damptrykket av en væske er lik det ytre trykket. Figuren nedenfor illustrerer kokingen av væske.
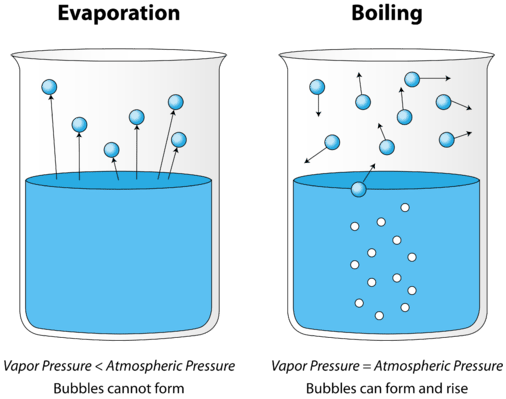
på bildet til venstre er væsken under kokepunktet, men noe av væsken fordamper. Til høyre har temperaturen blitt økt til bobler begynner å danne seg i væskens kropp. Når damptrykket inne i boblen er lik det ytre atmosfæriske trykket, stiger boblene til væskens overflate og brister. Temperaturen ved hvilken denne prosessen oppstår, er væskens kokepunkt.
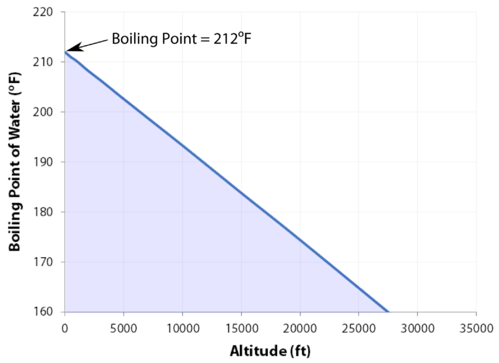
det normale kokepunktet er temperaturen der væskens damptrykk er lik standardtrykk. Fordi atmosfærisk trykk kan endres basert på plassering, endres kokepunktet til en væske med det ytre trykket. Det normale kokepunktet er en konstant fordi det er definert i forhold til standard atmosfærisk trykk på \(760 \: \text{mm} \: \ce{Hg}\) (eller \(1 \: \text{atm}\) eller \(101.3 \: \text{kPa}\)).