Redoksreaksjoner handler om elektroner som overføres fra ett stoff til et annet, så det er nyttig å ha et system for å holde oversikt over hvilke gevinster og hva som mister elektroner, og hvor mange elektroner som er involvert. Journalføringssystemet for redoksreaksjoner kalles Oksidasjonsnumre. Du kan også huske noe som kalles elektronegativitet fra tidligere kjemi klasser.
Elektronegativitet
evnen til et bundet atom til å tiltrekke delte elektroner mot seg selv.når to atomer av forskjellige elementer er bundet sammen av en kovalent binding (deling av elektroner), deles elektronene vanligvis ikke likt mellom de to atomene på grunn av forskjeller i deres elektronegativiteter. Tenk på dette som en slepebåt for elektroner. Noen ganger trekker begge atomer med samme styrke på delte elektroner; andre ganger er det tydelig en sterkere spiller som vil trekke elektronene nærmere seg selv.
Vurder bindingen mellom et hydrogenatom (med en valenselektron) og et oksygenatom (med sine seks valenselektroner):
|
|
+
|
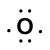 |
=
|
 |
Because oxygen has a higher electronegativity than hydrogen, the shared electrons are closer to the oxygen atom than to hydrogenatomet. Dette er ikke den totale overføringen av elektroner som ville skape en ion, men delvise ladninger danner. Hydrogenenden av bindingen er delvis positiv (+1) fordi den delvis har mistet en elektron, og oksygenenden av H–O er delvis negativ (-1) fordi den delvis har fått den ene elektronen fra hydrogen:
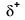 |
|
 |
|
Our molecule is incomplete, however, because there is a lone electron around oxygen. Let’s add one more hydrogen to complete our water molecule:
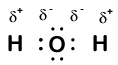
Vi ser at hver av de to hydrogenene har «mistet» en elektron til oksygen. Oksygen har «fått» to elektroner-en fra hvert hydrogen. Igjen, disse er ikke sanne ioner, men det er nyttig å tenke på dem på samme måte.
Ladninger gitt til atomer i et molekyl på denne måten kalles oksidasjonsnumre. Vi kan bruke oksidasjonsnumre for å holde oversikt over hvor elektroner er i et molekyl, og hvordan de beveger seg under en reaksjon. I vårt vanneksempel tildeles hydrogen et oksidasjonsnummer på + 1 fordi hvert enkelt hydrogen har «mistet» en elektron. Oksygen har et oksidasjonsnummer på + 2 fordi det enkle oksygenatomet har «fått» totalt to elektroner, en fra hvert hydrogen.
Her er et annet molekyl som involverer hydrogen OG oksygen—hydrogenperoksid, H2O2:
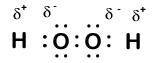
i hydrogenperoksid har hvert hydrogen fortsatt et oksidasjonsnummer på +1 fordi hvert hydrogen «gir opp» et enkelt elektron til oksygen. Oksygen har imidlertid nå et oksidasjonsnummer på -1 fordi hvert oksygen får bare ett elektron fra sitt nærliggende hydrogen. Elektronene mellom de to identiske oksygenatomer deles likt, så det er ingen delvis ladning som følge av den bindingen.Et positivt eller negativt tall tilordnet et atom i et molekyl eller ion som reflekterer en delvis gevinst eller tap av elektroner.Å Vite oksidasjonsnummeret til hvert enkelt element i et molekyl vil være et viktig skritt i vår forståelse av redoksreaksjoner. Heldigvis vil det vanligvis ikke innebære tegning electron dot diagrammer. I stedet er det en rekke regler som vi kan bruke til å bestemme oksidasjonsnumre. Her er hovedreglene:
| oksidasjonsnummeret til et rent element (i seg selv og ikke en ion) er null. |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
The oxidation number of a monatomic ion (by itself or as part of an ionic compound) is equal til sin kostnad.Alkalimetaller-elementer i den første kolonnen i det periodiske bordet – vil alltid ha et oksidasjonsnummer på + 1; Alkalimetaller (kolonne 2) er nesten alltid +2. |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| The oxidation number of hydrogen is almost always +1 when it is in a compound. |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
oksidasjonsnummeret av oksygen er nesten alltid -2 når det er i en forbindelse. unntakene:
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
summen av oksidasjonstallene i en forbindelse er null. for å bestemme oksidasjonsnummeret Til Mn I Mn2O7 må vi jobbe bakover:
-2 × 7 atomer = -14 totalt siden summen av oksidasjonstall må være null, må det totale oksidasjonstallet Mn være + 14 for å avbryte oksygen er -14, men siden det er 2 mn atomer, vil hvert enkelt atom ha et oksidasjonstall på +7:
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
summen av oksidasjonstallene i et polyatomisk ion er lik ladningen på den ion. igjen, arbeid bakover for å bestemme oksidasjonsnummeret til noe ikke-oksygen eller ikke-hydrogenatom. for å bestemme oksidasjonsnummeret Til Cr I Cr2O72 -:
-2 × 7 = -14
+12 + (-14) = -2
= +7
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
It is viktig å merke seg at oksidasjon nummer alltid refererer til hvert enkelt atom i forbindelsen, ikke til summen for det elementet.FOR EKSEMPEL, I H2O, vil den totale positive «ladningen» for begge hydrogenatomer være +2 (som balanserer med -2 fra oksygen), men hvert hydrogen har et oksidasjonsnummer på +1.
Bidrag& Attribusjoner
denne siden ble laget av innhold via følgende bidragsytere og redigert (lokalt eller omfattende) Av LibreTexts utviklingsteam for å møte plattformstil, presentasjon og kvalitet:Ck-12 Foundation av Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson og Jean Dupon.