Læringsmål
- Bruk cellenotasjon for å beskrive galvaniske celler
- Beskriv de grunnleggende komponentene i galvaniske celler\
Galvaniske celler, også kjent som voltaiske celler, Er elektrokjemiske celler der spontane oksidasjonsreduksjonsreaksjoner produserer elektrisk energi. Ved å skrive ligningene er det ofte praktisk å skille oksidasjonsreduksjonsreaksjonene i halvreaksjoner for å lette å balansere den generelle ligningen og for å understreke de faktiske kjemiske transformasjonene.
Vurder hva som skjer når et rent stykke kobbermetall plasseres i en løsning av sølvnitrat (Figur \(\PageIndex{1}\)). Så snart kobbermetallet er tilsatt, begynner sølvmetall å danne og kobberioner passerer inn i løsningen. Den blå fargen på løsningen helt til høyre indikerer tilstedeværelsen av kobberioner. Reaksjonen kan deles inn i sine to halvreaksjoner. Halvreaksjoner skiller oksidasjonen fra reduksjonen, slik at hver kan betraktes individuelt.
ligningen for reduksjonshalvreaksjonen måtte dobles, slik at antallet elektroner » oppnådd «i reduksjonshalvreaksjonen utgjorde antall elektroner» tapt » i oksidasjonshalvreaksjonen.

Galvaniske eller voltaiske celler involverer spontane elektrokjemiske reaksjoner der halvreaksjonene separeres (Figur \(\PageIndex{2}\)) slik at strømmen kan strømme gjennom en ekstern ledning. Begeret på venstre side av figuren kalles en halvcelle, og inneholder en 1 M løsning av kobber (II) nitrat med et stykke kobbermetall delvis nedsenket i løsningen. Kobbermetallet er en elektrode. Kobberet gjennomgår oksidasjon; derfor er kobberelektroden anoden. Anoden er koblet til et voltmeter med en ledning og den andre terminalen på voltmeteret er koblet til en sølvelektrode med en ledning. Sølv gjennomgår reduksjon; derfor er sølvelektroden katoden. Halvcellen på høyre side av figuren består av sølvelektroden i en 1 M løsning av sølvnitrat(AgNO3). På dette punktet strømmer ingen strøm-det vil si ingen signifikant bevegelse av elektroner gjennom ledningen fordi kretsen er åpen. Kretsen er lukket ved hjelp av en saltbro, som overfører strømmen med bevegelige ioner. Saltbroen består av en konsentrert, ikke-reaktiv elektrolyttløsning som natriumnitrat (NaNO3) – løsningen som brukes i dette eksemplet. Når elektroner strømmer fra venstre til høyre gjennom elektroden og ledningen, passerer nitrationer (anioner) gjennom den porøse pluggen til venstre inn i kobber(II) nitratløsningen. Dette holder begeret til venstre elektrisk nøytralt ved å nøytralisere ladningen på kobber (II) ioner som produseres i løsningen når kobbermetallet oksyderes. Samtidig beveger nitrationene seg til venstre, natriumioner (kationer) beveger seg til høyre, gjennom den porøse pluggen og inn i sølvnitratoppløsningen til høyre. Disse ekstra kationer «erstatte» sølvioner som er fjernet fra løsningen som de ble redusert til sølv metall, holde begeret på høyre elektrisk nøytral. Uten saltbroen ville rommene ikke forbli elektrisk nøytrale og ingen signifikant strøm ville strømme. Men hvis de to rommene er i direkte kontakt, er det ikke nødvendig med en saltbro. I det øyeblikket kretsen er fullført, leser voltmeteret +0,46 V, dette kalles cellepotensialet. Cellepotensialet opprettes når de to ulike metaller er koblet sammen, og er et mål på energien per enhetsladning tilgjengelig fra oksidasjonsreduksjonsreaksjonen. Volt er DEN avledede si-enheten for elektrisk potensial
\
I denne ligningen er a strømmen i ampere og C ladningen i coulombs. Merk at volt må multipliseres med ladningen i coulombs (C) for å oppnå energien i joules (J).
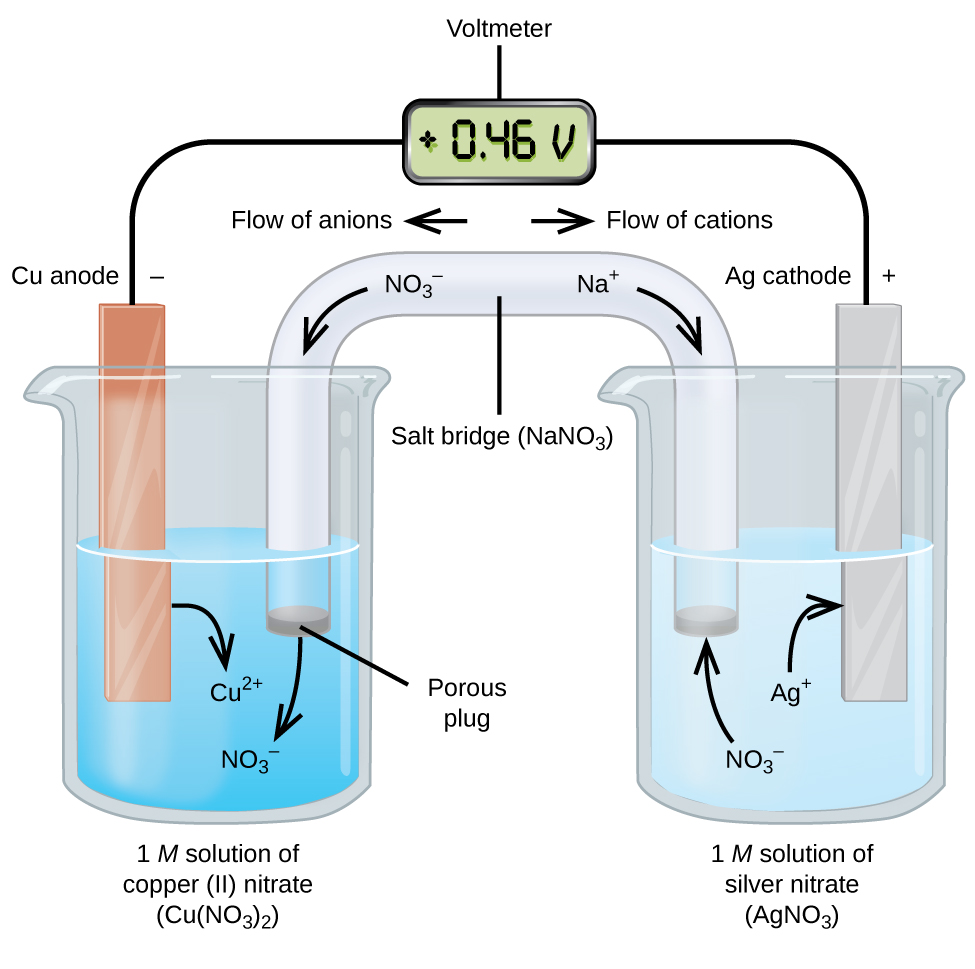
når den elektrokjemiske cellen er konstruert på denne måten, indikerer et positivt cellepotensial en spontan reaksjon og at elektronene strømmer fra venstre til høyre. Det skjer mye I Figur \(\PageIndex{2}\), så det er nyttig å oppsummere ting for dette systemet:
- Elektroner flyter fra anoden til katoden: venstre til høyre i standard galvanisk celle i figuren.
- elektroden i venstre halvcelle er anoden fordi oksidasjon skjer her. Navnet refererer til strømmen av anioner i saltbroen mot den.
- elektroden i høyre halvcelle er katoden fordi reduksjon skjer her. Navnet refererer til strømmen av kationer i saltbroen mot den.
- Oksidasjon skjer ved anoden (den venstre halvcellen i figuren).
- Reduksjon skjer ved katoden (høyre halvcelle i figuren).
- cellepotensialet, +0,46 V, i dette tilfellet, skyldes de iboende forskjellene i naturen til materialene som brukes til å lage de to halvcellene.
- saltbroen må være tilstede for å lukke (fullføre) kretsen, og både en oksidasjon og reduksjon må oppstå for at strømmen skal strømme.
det er mange mulige galvaniske celler, så en kortnotasjon brukes vanligvis til å beskrive dem. Cellenotasjonen (noen ganger kalt et cellediagram) gir informasjon om de ulike artene som er involvert i reaksjonen. Denne notasjonen fungerer også for andre typer celler. En vertikal linje,│, betegner en fasegrense og en dobbel linje,‖, saltbroen. Informasjon om anoden er skrevet til venstre, etterfulgt av anodeoppløsningen, deretter saltbroen (når den er tilstede), deretter katodeoppløsningen, og til slutt informasjon om katoden til høyre. Cellenotasjonen for den galvaniske cellen I Figur \(\PageIndex{2}\) er da
\
Merk at tilskuerioner ikke er inkludert, og at den enkleste formen for hver halvreaksjon ble brukt. Når det er kjent, er de første konsentrasjonene av de forskjellige ioner vanligvis inkludert.
En Av De enkleste cellene er Daniell-cellen. Det er mulig å konstruere dette batteriet ved å plassere en kobberelektrode på bunnen av en krukke og dekke metallet med en kobbersulfatløsning. En sinksulfatløsning flyter på toppen av kobbersulfatløsningen; deretter plasseres en sinkelektrode i sinksulfatløsningen. Ved å koble kobberelektroden til sinkelektroden kan en elektrisk strøm strømme. Dette er et eksempel på en celle uten saltbro, og ioner kan strømme over grensesnittet mellom de to løsningene.
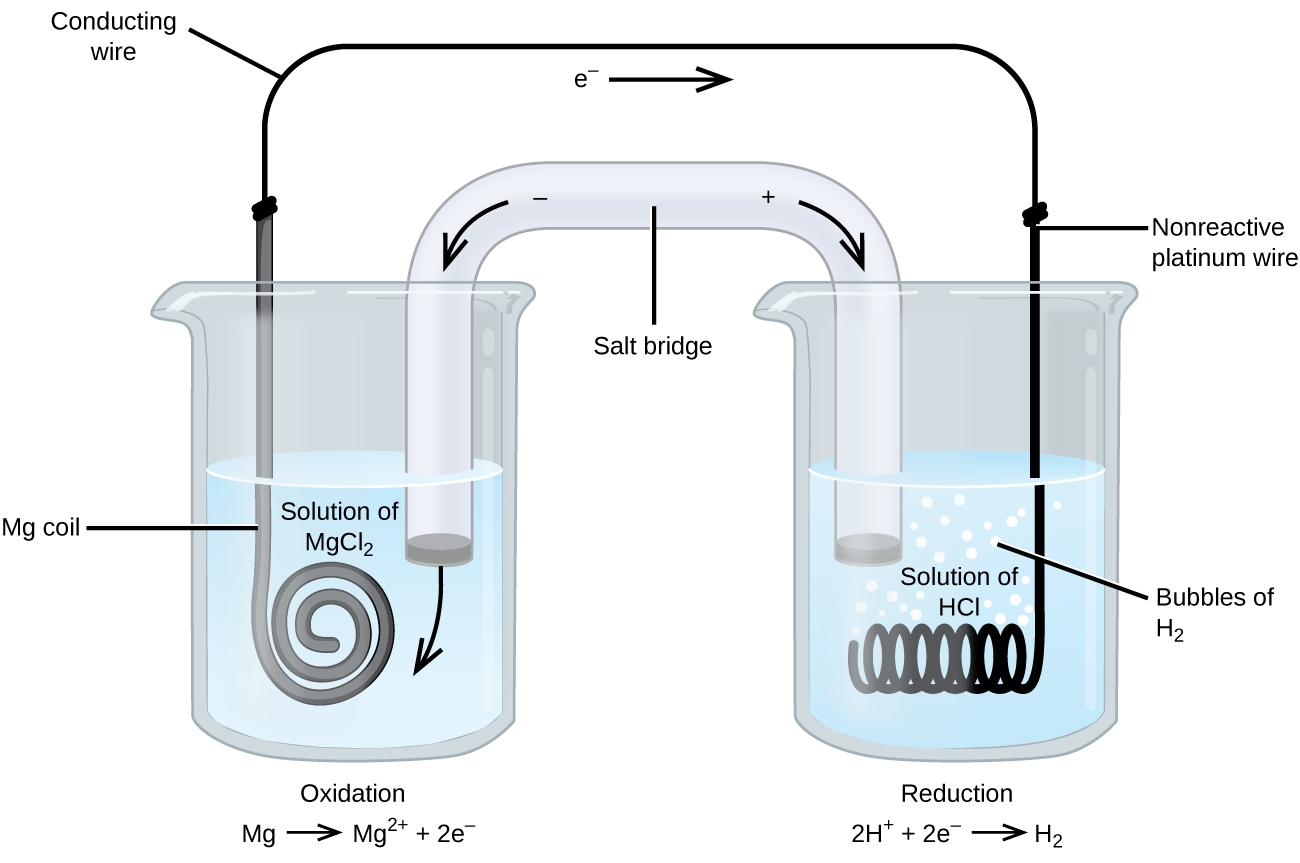
noen oksidasjonsreduksjonsreaksjoner involverer arter som er dårlige ledere av elektrisitet, og så brukes en elektrode som ikke deltar i reaksjonene. Ofte er elektroden platina, gull eller grafitt, som alle er inerte for mange kjemiske reaksjoner. Et slikt system er vist I Figur \(\PageIndex{3}\). Magnesium gjennomgår oksidasjon ved anoden til venstre i figuren, og hydrogenioner gjennomgår reduksjon ved katoden til høyre. Reaksjonen kan oppsummeres som
cellen brukte en inert platinatråd for katoden, så cellenotasjonen er
magnesiumelektroden er en aktiv elektrode fordi den deltar i oksidasjonsreduksjonsreaksjonen. Inerte elektroder, som platinelektroden I Figur \(\PageIndex{3}\), deltar ikke i oksidasjonsreduksjonsreaksjonen og er tilstede slik at strømmen kan strømme gjennom cellen. Platina eller gull gjør generelt gode inerte elektroder fordi de er kjemisk ureaktive.
Eksempel \(\PageIndex{1}\): Bruk Cellenotasjon
Vurder en galvanisk celle bestående av
\
Skriv halvreaksjonene for oksidasjon og reduksjon og skriv reaksjonen ved hjelp av cellenotasjon. Hvilken reaksjon oppstår ved anoden? Katoden?Ved inspeksjon oksyderes Cr når tre elektroner går tapt for Å danne Cr3+, Og Cu2 + reduseres ettersom det får to elektroner for å danne Cu. Balansering av ladningen gir
\
Cellenotasjon bruker den enkleste formen av hver av ligningene, og starter med reaksjonen ved anoden. Ingen konsentrasjoner ble spesifisert slik:
\
Oksidasjon skjer ved anoden og reduksjon ved katoden.
Eksempel \(\PageIndex{2}\): Bruk Cellenotasjon
Vurder en galvanisk celle bestående av
Skriv oksidasjons-og reduksjonshalvereaksjoner og skriv reaksjonen ved hjelp av cellenotasjon. Hvilken reaksjon oppstår ved anoden? Katoden?Ved inspeksjon gjennomgår Fe2 + oksidasjon når en elektron går tapt For Å danne Fe3+, Og MnO4-reduseres ettersom den får fem elektroner til Å danne Mn2+. Balansering av ladningen gir
\
Cellenotasjon bruker den enkleste formen av hver av ligningene, og starter med reaksjonen ved anoden. Det er nødvendig å bruke en inert elektrode, for eksempel platina, fordi det ikke er noe metall tilstede for å lede elektronene fra anoden til katoden. Ingen konsentrasjoner ble spesifisert slik:
\
Oksidasjon skjer ved anoden og reduksjon ved katoden.
Øvelse \(\PageIndex{1}\)
Bruk cellenotasjon for å beskrive den galvaniske cellen hvor kobber (II) ioner reduseres til kobbermetall og sinkmetall oksyderes til sinkioner.
Svar
fra informasjonen gitt i problemet:
\
Ved hjelp av cellenotasjon:
\
Sammendrag
Elektrokjemiske celler består vanligvis av to halvceller. Halvcellene separerer oksidasjonshalvreaksjonen fra reduksjonshalvreaksjonen og gjør det mulig for strøm å strømme gjennom en ekstern ledning. En halvcelle, vanligvis avbildet på venstre side i en figur, inneholder anoden. Oksidasjon skjer ved anoden. Anoden er koblet til katoden i den andre halvcellen, ofte vist på høyre side i en figur. Reduksjon skjer ved katoden. Å legge til en saltbro fullfører kretsen slik at strømmen kan strømme. Anioner i saltbroen strømmer mot anoden og kationer i saltbroen strømmer mot katoden. Bevegelsen av disse ionene fullfører kretsen og holder hver halvcelle elektrisk nøytral. Elektrokjemiske celler kan beskrives ved hjelp av celle notasjon. I denne notasjonen vises informasjon om reaksjonen ved anoden til venstre og informasjon om reaksjonen ved katoden til høyre. Saltbroen er representert av en dobbel linje,‖. De faste, flytende eller vandige fasene i en halvcelle separeres med en enkelt linje,│. Fasen og konsentrasjonen av de ulike artene er inkludert etter artsnavnet. Elektroder som deltar i oksidasjonsreduksjonsreaksjonen kalles aktive elektroder. Elektroder som ikke deltar i oksidasjonsreduksjonsreaksjonen, men er der for å tillate strøm å strømme, er inerte elektroder. Inerte elektroder er ofte laget av platina eller gull, som er uendret av mange kjemiske reaksjoner.
Ordliste
aktiv elektrodeelektrode som deltar i oksidasjonsreduksjonsreaksjonen av en elektrokjemisk celle; massen av en aktiv elektrode endres under oksidasjonsreduksjonsreaksjonen anodeelektrode i en elektrokjemisk celle hvor oksidasjon oppstår; informasjon om anoden registreres på venstre side av saltbroen i celle notasjon katodeelektrode i en elektrokjemisk celle ved hvilken reduksjon oppstår; informasjon om katoden registreres på høyre side av saltbroen i cellenotasjon cellenotasjon stenografi måte å representere reaksjonene i en elektrokjemisk cellecellepotensialforskjell i elektrisk potensial som oppstår når ulike metaller er koblet sammen.; drivkraften for strømmen av ladning (strøm) i oksidasjonsreduksjonsreaksjoner galvanisk celle elektrokjemisk celle som involverer en spontan oksidasjonsreduksjonsreaksjon; elektrokjemiske celler med positive cellepotensialer; også kalt en voltaisk celle inert elektrode elektrode som tillater strøm å strømme, men som ellers ikke deltar i oksidasjonsreduksjonsreaksjonen i en elektrokjemisk celle; massen av en inert elektrode endres ikke under oksidasjonsreduksjonsreaksjonen; inerte elektroder er ofte laget av platina eller gull fordi disse metallene er kjemisk ureaktive. voltaic celle et annet navn for en galvanisk celle
Bidragsytere og Attribusjoner
-
Paul Flowers (University Of North Carolina – Pembroke), Klaus Theopold (University Of Delaware) Og Richard Langley (Stephen F. Austin State University) med bidragsytere. Lærebokinnhold produsert Av OpenStax College er lisensiert under En Creative Commons Attribution License 4.0 lisens. Last ned gratis på http://cnx.org/contents/85abf193-2bd…[email protected]).