hybridiseringsteorien blir ofte sett på som et langt og forvirrende konsept, og det er en praktisk ferdighet å raskt kunne avgjøre om atomet er sp3, sp2 eller sp uten å måtte gå gjennom alle detaljer om hvordan hybridiseringen hadde skjedd.
Heldigvis er det en snarvei i å gjøre dette, og i dette innlegget vil jeg prøve å oppsummere dette i noen få forskjellige trinn som du må følge.
la oss si at du blir bedt om å bestemme hybridiseringstilstanden for de nummererte atomer i følgende molekyl:

det første du må gjøre er å bestemme antall grupper som er på hvert atom. Med grupper mener vi enten atomer eller ensomme par elektroner. Dette Er Også Kjent Som Sterisk Nummer (SN).

Nedenfor er noen eksempler på steriske tall 2-4 som i stor grad er det du trenger å vite i organisk kjemi:

Legg Merke til at flere bindinger ikke betyr noe, det er atomer + ensomme par for enhver bindingstype.
Når du vet hvordan du skal bestemme sterisknummeret (DET er FRA vsepr – teorien), må du bare bruke følgende korrelasjon:
hvis sterisknummeret er 3 – sp2
Hvis sterisknummeret er 3-sp2
hvis det steriske tallet ER 2-SP
så nå, la oss gå tilbake til molekylet vårt og bestemme hybridiseringstilstandene for alle atomer.
C1 – sn = 3 (tre atomer koblet), derfor er det sp2
C2 – sn = 3 (tre atomer koblet), derfor er det sp2
O4 – sn = 3 (1 atom + 2 ensomme par), derfor er det sp2
O5 – sn = 4 (2 atomer + 2 ensomme par), derfor er det sp3
C6 – SN = 4 (4 atomer), derfor er det sp3 det er sp3
C7 – sn = 4 (4 atomer), derfor er det sp3
N8 – sn = 4 (3 atomer + 1 lone par), derfor er det sp3
c9 – sn = 2 (2 atomer), derfor er det sp
C10 – sn = 2 (2 atomer), derfor er det sp

i tillegg til denne metoden, er det også svært nyttig å huske noen egenskaper knyttet til struktur og hybridisering. Generelt er et atom med alle enkeltbindinger en sp3 hybridisert. Det beste eksempelet er alkanene. Alle karbonatomer i en alkan er sp3 hybridisert med tetrahedral geometri.karbonene i alkener og andre atomer med dobbeltbinding er ofte sp2 hybridisert og har trigonal plan geometri.trippelbindingen er derimot karakteristisk for alkyner hvor karbonatomene er sp-hybridisert.Det er noen få vanlige unntak fra det vi har diskutert om å bestemme hybridiseringstilstanden, og de er for det meste relatert til metoden der vi ser på bindingstypen av atomet.
for eksempel i karbondioksidet (CO2) har karbonet to dobbeltbindinger, men det er sp-hybridisert.
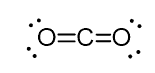
og årsaken til dette er at karbonets steriske nummer er to (det er bare to atomer oksygen forbundet med det) og for å holde to atomer ved 180o, som er den optimale geometrien, må karbonet bruke to identiske orbitaler. Dette er bare mulig i sp hybridisering. De to andre 2p-orbitalene brukes til å lage dobbeltbindingene på hver side av karbonet.
Et annet vanlig, og svært viktig eksempel er carbocations.

her har karbonet bare enkeltbindinger, og det kan se ut som det skal være sp3 hybridisert. Karbonet i denne typen karbokasjoner er imidlertid sp2 hybridisert. Igjen, av samme grunn, at dets steriske nummer er 3 (sp2 – tre identiske orbitaler).
et unntak fra Metoden For Sterisk Tall
et unntak med sterisk tall er for eksempel amidene. Nitrogenatomet her har sterisk nummer 4 og forventes å sp3. På grunn av resonansdelokalisering av det ensomme paret, interconverterer det fra sp3 til sp2, da det er den eneste måten å ha elektronene i en justert p-bane som kan overlappe og delta i resonansstabilisering med pi-bindingselektronene I c=O-dobbeltbindingen.

I de fleste tilfeller trenger du ikke å bekymre deg for unntakene hvis du går basert på Sterisk Nummer.