Mekanismer For Enzymatisk Katalyse
bindingen av et substrat til det aktive stedet av et enzym er en meget spesifikk interaksjon. Aktive steder er spalter eller spor på overflaten av et enzym, vanligvis sammensatt av aminosyrer fra forskjellige deler av polypeptidkjeden som bringes sammen i den tertiære strukturen av det brettede proteinet. Substrater binder seg til det aktive stedet ved ikke-kovalente interaksjoner, inkludert hydrogenbindinger, ioniske bindinger og hydrofobe interaksjoner. Når et substrat er bundet til det aktive stedet av et enzym, kan flere mekanismer akselerere sin konvertering til produktet av reaksjonen.Selv om det enkle eksemplet som ble diskutert i forrige avsnitt, bare involverte et enkelt substratmolekyl, involverer de fleste biokjemiske reaksjoner interaksjoner mellom to eller flere forskjellige substrater. For eksempel innebærer dannelsen av en peptidbinding sammenføyning av to aminosyrer. For slike reaksjoner akselererer bindingen av to eller flere substrater til det aktive stedet i riktig posisjon og orientering reaksjonen (Figur 2.23). Enzymet gir en mal hvorpå reaktantene bringes sammen og riktig orientert for å favorisere dannelsen av overgangsstaten der de samhandler.

Figur 2.23
Enzymatisk katalyse av en reaksjon mellom to substrater. Enzymet gir en mal hvorpå de to substrater er brakt sammen i riktig posisjon og orientering til å reagere med hverandre.
Enzymer akselererer reaksjoner også ved å endre konformasjonen av deres substrater for å nærme seg overgangsstaten. Den enkleste modellen for enzym-substratinteraksjon er lås-og-nøkkelmodellen, hvor substratet passer nøyaktig inn i det aktive stedet (Figur 2.24). I mange tilfeller modifiseres konfigurasjonene av både enzymet og substratet ved substratbinding—en prosess som kalles indusert passform. I slike tilfeller konformasjonen av substratet er endret slik at det mer ligner på overgangen tilstand. Spenningen som oppstår ved en slik forvrengning av substratet, kan ytterligere lette omdannelsen til overgangsstaten ved å svekke kritiske bindinger. Videre stabiliseres overgangsstaten ved sin tette binding til enzymet, og derved senker den nødvendige aktiveringsenergien.

Figur 2.24
Modeller av enzym-substrat interaksjon. (A) i lås-og-nøkkelmodellen passer substratet nøyaktig inn i enzymets aktive sted. (B) i induced-fit-modellen forvrenger substratbindingen konformasjonene av både substrat og enzym. Denne forvrengningen (mer…)
i tillegg til å bringe flere substrater sammen og forvrenge konformasjonen av substrater for å nærme seg overgangsstaten, deltar mange enzymer direkte i den katalytiske prosessen. I slike tilfeller kan spesifikke aminosyresidekjeder i det aktive stedet reagere med substratet og danne bindinger med reaksjonsmellemedier. De sure og basiske aminosyrene er ofte involvert i disse katalytiske mekanismene, som illustrert i den følgende diskusjonen av chymotrypsin som et eksempel på enzymatisk katalyse.Chymotrypsin er medlem av en familie av enzymer (serinproteaser) som fordøyer proteiner ved å katalysere hydrolysen av peptidbindinger. Reaksjonen kan skrives som følger:

de forskjellige medlemmene av serinproteasefamilien (inkludert chymotrypsin, trypsin, elastase og trombin) har forskjellige substratspesifikasjoner; de spalter fortrinnsvis peptidbindinger ved siden av forskjellige aminosyrer. For eksempel, mens chymotrypsin fordøyer bindinger ved siden av hydrofobe aminosyrer, som tryptofan og fenylalanin, fordøyer trypsin bindinger ved siden av grunnleggende aminosyrer, som lysin og arginin. Alle serinproteaser er imidlertid like i struktur og bruker samme mekanisme for katalyse. De aktive områdene av disse enzymene inneholder tre kritiske aminosyrer-serin, histidin og aspartat—som driver hydrolyse av peptidbindingen. Faktisk kalles disse enzymene serinproteaser på grunn av den sentrale rollen som serinresten.
Substrater binder seg til serinproteaser ved å sette aminosyren ved siden av spaltningsstedet i en lomme på enzymets aktive sted (Figur 2.25). Naturen til denne lommen bestemmer substratspesifikiteten til de forskjellige medlemmene av serinproteasefamilien. For eksempel inneholder bindingslommen av chymotrypsin hydrofobe aminosyrer som interagerer med de hydrofobe sidekjedene av sine foretrukne substrater. I kontrast inneholder bindingslommen av trypsin en negativt ladet sur aminosyre (aspartat), som er i stand til å danne en ionisk binding med lysin-eller argininrester av dets substrater.
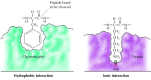
Figur 2.25
Substratbinding av serinproteaser. Aminosyren ved siden av peptidbindingen som skal spaltes, settes inn i en lomme på enzymets aktive sted. I chymotrypsin binder lommen hydrofobe aminosyrer; bindingslommen av trypsin inneholder (mer…)
Substratbinding posisjonerer peptidbindingen som skal spaltes ved siden av det aktive stedet serin (Figur 2.26). Protonen av denne serinen overføres deretter til det aktive stedet histidin. Konformasjonen av det aktive stedet favoriserer denne protonoverføringen fordi histidin interagerer med den negativt ladede aspartatresten. Serinen reagerer med substratet og danner en tetrahedral overgangstilstand. Peptidbindingen spaltes deretter, Og den C-terminale delen av substratet frigjøres fra enzymet. Det N-terminale peptidet forblir imidlertid bundet til serin. Denne situasjonen løses når et vannmolekyl (det andre substratet) går inn i det aktive stedet og reverserer de foregående reaksjonene. Protonen av vannmolekylet overføres til histidin, og dets hydroksylgruppe overføres til peptidet, og danner en andre tetraedralovergangstilstand. Protonet overføres deretter fra histidin tilbake til serin, og peptidet frigjøres fra enzymet, og fullfører reaksjonen.

Figur 2.26
Katalytisk mekanisme av chymotrypsin. Tre aminosyrer på det aktive stedet (Ser-195, His-57 og Asp-102) spiller kritiske roller i katalyse. dette eksemplet illustrerer flere egenskaper ved enzymatisk katalyse; spesifisiteten av enzym-substrat-interaksjoner, plasseringen av forskjellige substratmolekyler i det aktive stedet og involvering av aktive stedsrester i dannelsen og stabiliseringen av overgangsstaten. Selv om tusenvis av enzymer i celler katalyserer mange forskjellige typer kjemiske reaksjoner, gjelder de samme grunnleggende prinsippene for deres drift.