Delokalisering skjer når elektrisk ladning er spredt over mer enn ett atom. For eksempel kan bindingselektroner fordeles mellom flere atomer som er bundet sammen.

Eksempel 1:
et av de mest kjente eksemplene på et molekyl der bindingselektroner delokaliseres, er benzen, vist nedenfor:
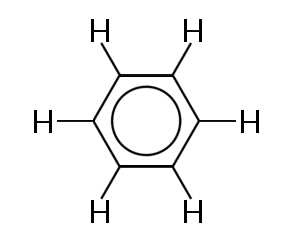
Benzen består av en ring av seks karbonatom. Karbonatomer er alle sp2 hybridisert med en uhybridisert p-orbital.
sp2 hybridorbitaler produserer normale kovalente bindinger, noen ganger kalt σ-bindinger: disse er de enkle C-C-bindingene og enkle C-H-bindingene.
dette etterlater hvert karbon med et elektron i en p-bane i en rett vinkel mot ringenes plan.
i diagrammet nedenfor, til venstre kan du se sp2 orbitaler som danner kovalente bindinger. Til høyre kan du se p-orbitaler, som hver inneholder et elektron.
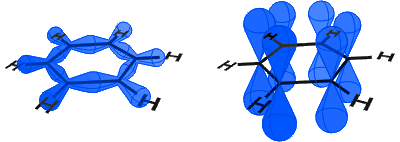
p-orbitalene kombinerer side på og elektronene i p-orbitalene er beskrevet som π-elektroner.
i diagrammet nedenfor har p-orbitalene kombinert, og π-elektronene er delokalisert. I gjennomsnitt er alle ringbindingene identiske.
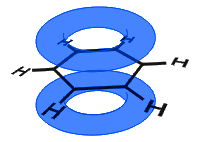
I Motsetning til i det neste eksemplet nedenfor, holdes de delokaliserte elektronene i benzen inne i molekylet og er ikke fri til å bevege seg gjennom bulkmaterialet.
Eksempel 2: Metaller har høy termisk og elektrisk ledningsevne fordi de ytterste elektronene i deres atomer er delokalisert. Disse elektronene er ikke forbundet med noen bestemt metallisk kjerne, og så er fri til å bevege seg gjennom metallet.
Bekreftelse: de blåfargede bildene av benzens orbitaler er høflighet Av Sansculotte. Disse bildene er lisensiert under Creative Commons Attribution-Share Alike 1.0 Generisk lisens.