en voltaisk celle, ofte kjent som en galvanisk celle, gir elektrisk energi. Kilden til denne energien er en spontan kjemisk reaksjon, nærmere bestemt en spontan redoksreaksjon.for eksempel er alle batterier laget av en eller flere voltaiske celler;batterier går flatt når de fleste eller alle deres reaktanter har blitt konvertert til produkter, og omdanner deres kjemiske potensielle energi til elektrisk energi.
Voltaiske Celler-Grunnprosessen
Kjemisk Potensiell Energi → Elektrisk energi
den voltaiske cellen er en av to grunnleggende typer elektrokjemiske celler.Den andre typen er elektrolytisk celle; i en elektrolytisk celle brukes elektrisk energi til å drive en ikke-spontan kjemisk reaksjon.For eksempel kan vann deles inn i hydrogen og oksygen i en elektrolytisk celle. Når et oppladbart batteri er oppladet, fungerer det også som en elektrolytisk celle.
Grunnleggende Voltaisk Celle Skjematisk

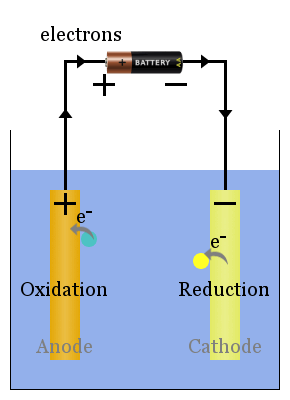
Spontane redoksreaksjoner ved elektrodene produserer en spenning.Riktig satt opp, kan denne spenningen drive elektroner gjennom elektriske enheter, slik som lyspære vist here.In dette diagrammet overfører arter elektroner til anoden fra hvor de strømmer gjennom lyspæren til katoden, hvor de gir reduksjon.
Grunnleggende Elektrolytisk Celle Skjematisk
Ikke-spontan redoksreaksjoner drives av en ekstern spenning.Den elektrolytiske cellens prosesser er motsatt av den voltaiske cellens. strømmen fra strømkilden skyver elektroner videre til katoden, hvor de forårsaker reduksjon av arter å finne sted.
Les mer her om katoder og anoder i voltaiske vs elektrolytiske celler.
Eksempel På En Voltaisk Celle
Edison-Batteriet
Edison-batteriet er en enkel, oppladbar celle oppfunnet Av Thomas Edison.It består av to metallelektroder, en laget av jern, den andre av nikkel.Under innledende lading dannes et belegg av nikkeloksid på nikkelelektroden.
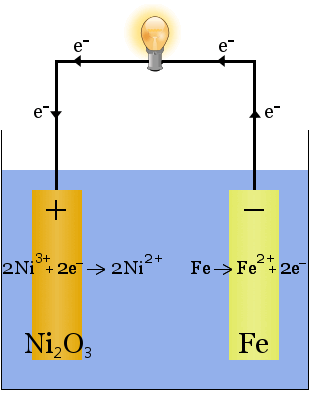
elektrolytten (den ioniske væsken mellom elektrodene) er 20-30 vektprosent kaliumhydroksyd i vann.Kaliumhydroksydets rolle i dette tilfellet er å øke ionisk ledningsevne for å fullføre den elektriske kretsen-kaliumhydroksyd forbrukes ikke i reaksjonen.
Når Den er utladet, Fungerer Edison-cellen som en voltaisk celle.Når den blir ladet, fungerer cellen som en elektrolytisk celle.
de kjemiske ligningene for reaksjonene ved elektrodene er:
under utladning, når cellen leverer elektrisk energi, går reaksjonene ovenfor til høyre →.
under lading, når cellen konverterer elektrisk energi til kjemisk potensiell energi, fortsetter reaksjonene ovenfor til venstre ←.
Edison-cellen, med begge elektroder som deler samme elektrolytt, er en av de enkleste voltaiske cellene i praktisk bruk; de fleste voltaiske celler er mer kompliserte.Dens store fordeler er dens bemerkelsesverdige robusthet mot feil som overladning og dens svært lange levetid, med nesten ubegrenset ladningsutladningssykling.
den største ulempen er at den i forhold til energiutgangen er veldig tung.
Ytterligere Eksempel
Litiumbatterier
Fremskritt innen batteriteknologi har drevet miniatyrisering av elektroniske enheter.Uten disse fremskrittene ville moderne enheter som mobiltelefoner og tabletter være større og mer besværlige.
i hjertet av disse fremskrittene har vært litiumion teknologi.Elementet litium er et metall med svært lav tetthet: ved 0,534 g/cm3 er litium halvparten så tett som vann; litium flyter på vann.Sammenlign dette med metallene I Edison-cellen, nikkelens tetthet er 8,908 g / cm3, og jern er 7,874 g / cm3: disse er mer enn 10x høyere enn litiumets tetthet.
Litiumets høye redokspotensial kombinert med dens lave tetthet gjør ionene perfekte for bruk som batterimateriale.et typisk litiumionbatteri er basert på porøse elektroder som tillater Li-ioner å bevege seg inn og ut av porene.For eksempel kan et oppladbart litiumionbatteri ha en grafittelektrode og en litiumdopet koboltoksidelektrode med en polyoksyetylenelektrolytt som inneholder saltet LiPF6.
når et slikt batteri driver en enhet, oksideres litiumatomer i lagstrukturen av grafittanode til å bli ioner.
ved katoden reduseres litiumioner innenfor koboltoksidstrukturen.
These reactions are reversed when the cell is being charged.
