et godt utgangspunkt for når du må finne elektronkonfigurasjonen til en ion er elektronkonfigurasjonen til det nøytrale atomet.
I ditt tilfelle må du finne elektronkonfigurasjonen av fluoranionen, # «F»^ ( – )#, så start med å skrive elektronkonfigurasjonen av et nøytralt fluoratom, # «F»#.
Fluor ligger i periode 2, gruppe 17 i det periodiske bordet og har et atomnummer # 9#. Dette forteller deg at det nøytrale fluoratomet har totalt # 9 # elektroner rundt kjernen.
dens elektronkonfigurasjon vil være
#»F:» 1s^2s^2p^5#
nå dannes #»F»^(-)# anion når #1# elektron legges til et nøytralt fluoratom.
Legg Merke til at 2p-subshell av det nøytrale atom inneholder # 5 # elektroner. Den maksimale kapasiteten er faktisk # 6 # elektroner, to elektroner for hver p-orbital.
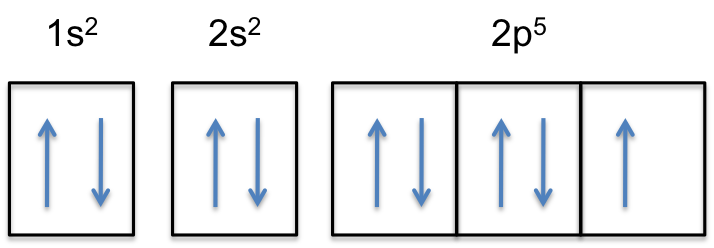
dette betyr at # color (red) («extra electron»)# vil bli lagt til en av de tre 2p-orbitaler, la oss si til #2p_y#.
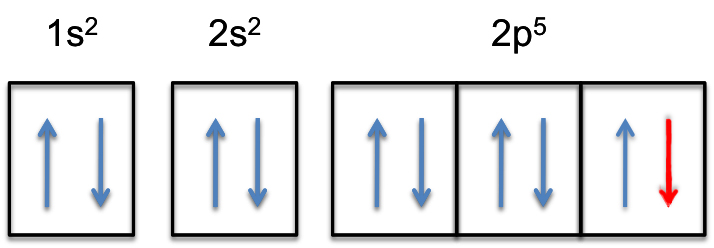
2p-subshell vil nå bli fullstendig fylt, dvs. det vil holde # 6 # elektroner.
elektronkonfigurasjonen av fluoranionen vil dermed være
#farge(grønn) (/bar(ul(farge(hvit)(a / a)farge(svart)(«F»^( -):farge(hvit) (a) 1s^2color(hvit) (a) 2s^2 farge(hvit) (a)2p^6)farge(hvit) (a/a)|)))#
Legg Merke til at fluoranionen har totalt #8# elektroner i sitt andre skall, det ytterste skallet. Dette forteller deg at anionen har en komplett oktett.
fordi fluor anion er isoelektronisk med neon, #»Ne»#, kan du skrive sin elektron konfigurasjon ved hjelp av edelgass stenografi notasjon som
#»F»^(-): #
Her
## – elektronkonfigurasjonen av neon