vel, vurder delokalisering av elektrontetthet. Det er når elektrontetthet spres så mye som mulig gjennom et molekyl, slik at minimum ladningsoppbyggingen er tilstede i en gitt orbital.
som er beskrevet:
- samlet av alle resonans bidragsytere I Lewis strukturer.
- samlet av alle de individuelle molekylære orbitale bidragene i molekylære orbitale diagrammer.
(det er subtile forskjeller mellom disse, men disse er omtrent analoge for enkelhet. Se her for flere detaljer.)
Lokalisering Av Elektrontetthet er mangelen på det.
Det er når vi fyller all elektrontetthet i noen få orbitaler, i stedet for å spre det ut, og det skjer nesten aldri i et ekte molekyl eller kvantesystem (selv om det ikke skjer resonans).
EKSEMPEL MED RESONANSSTRUKTURER
Vurder den isolerte (ikke-reagerende) allylkation, # » C » _3 » H » _5^(+)#.
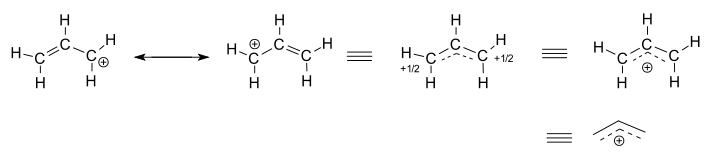
- de venstre to strukturer er resonansbidragsytere, som hver er lokaliserte representasjoner av den sanne delokaliserte strukturen.
- de tre høyre strukturer er hver representasjoner av resonanshybridstrukturen, eller den delokaliserte strukturen.
den delokaliserte strukturen er i utgangspunktet beskrevet av en samling bindingsmolekylære orbitaler.
EKSEMPEL med ET MOLEKYLÆRT ORBITALDIAGRAM
Vurder allylkasjonen igjen i ET MO-diagram som bare beskriver #bbpi# elektronene (dvs. elektronene som ville være i en #pi# – binding i en lokalisert dobbeltbinding!), men tillater deltakelse i reaksjoner:
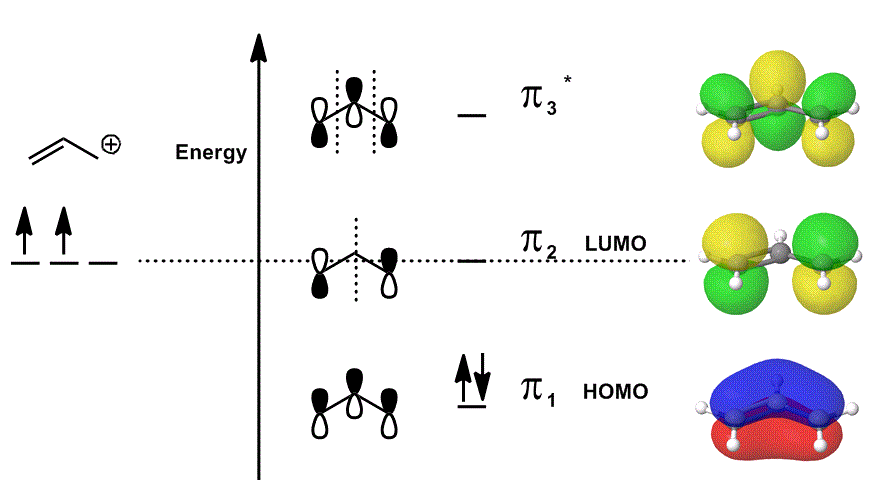
- hver av de orbitale bidragene i midten er avbildet lokalisert; atomorbitalene som ville overlappe er vist som seg selv (fase inkludert).
- hver av orbitalene helt til høyre (en per rad) er avbildet delokalisert; elektrondensiteten får lov til å spre seg slik at molekylorbitaler er avbildet med fullstendig vurdering av overlapper, noder og faser.
når du overlapper # pi_1#, # pi_2# og # pi_3^ » * » # og inkorporerer det vektede bidraget til disse tilstandene (vektet i henhold til koeffisientene # c_i#), får du den lineære kombinasjonen av molekylorbitaler:
#Psi_(«allyl»^(+)) = c_1overbrace(pi_1)^»bonding» + c_2overbrace(pi_2)^»nonbonding» + c_3overbrace(pi_3^»*»)^»antibonding»#
og #Psi_(«allyl»^(+))# beskriver deretter samlet fordeling av tilstander som kollektivt beskriver reaktiviteten til allylkation.
Med andre ord, #pi_1# (som donerer #pi# elektroner til binding), #pi_2# (som aksepterer elektroner til binding), og #pi_3^»*»# (i dette tilfellet vil det sjelden delta) alle gjør noe når allylkation deltar i en kjemisk reaksjon, fordi (hvis okkupert), eksisterer de samtidig.