hva er redokspotensialet til en celle?Redokspotensialer brukes til å karakterisere den frie energikostnaden og retningen av reaksjoner som involverer elektronoverføring, en av de mest allestedsnærværende og viktige biokjemiske reaksjoner. Slike reduksjonsoksydasjonsreaksjoner er preget av en fri energiendring som deler noen konseptuelle egenskaper med det som brukes til å beskrive pKa i syre-base-reaksjoner der protonoverføring er involvert i stedet for elektronoverføring. I denne vignetten, en av de mest abstrakte i boken, diskuterer vi hvordan redokspotensialet kan brukes som et mål på drivkraften for en gitt oksidasjonsreduksjonsreaksjon av interesse. Som kontrast, i motsetning til pH, er det ingen mening hvor man kan tildele et enkelt redokspotensial til en hel celle.
redokspotensialet, eller mer nøyaktig reduksjonspotensialet, av en forbindelse refererer til dens tendens til å erverve elektroner og dermed reduseres. Noen lesere kan huske mnemonic «OILRIG» som minner oss om at «oksidasjon er tap, reduksjon er gevinst», hvor tap og gevinst er av elektroner. Vurder en reaksjon som involverer en elektronoverføring: Aox + ne – ↔ ared hvor n elektroner tas opp av oksidert form (Aox) for å gi den reduserte formen (Ared) av forbindelse A. DEN potensielle forskjellen I REDOKS MELLOM elektrondonoren og akseptoren er knyttet til DEN tilknyttede FRIE energiendringen I REAKSJONEN VIA ΔG=nfδ der n er antall overførte elektroner og F er faradays konstant (96 485 j/mol/V eller ≈100 kJ/mol/V). Ved å inspisere tabulerte verdier av disse potensialene, er det mulig å utvikle en intuisjon for tendensen til elektronoverføring og dermed av reaksjonsretningen.

Figur 1: et «redokstårn» som viser redokspotensialet for vanlige metabolske halvreaksjoner. Metabolske prosesser kan ses som å flytte elektroner mellom molekyler, ofte fange noe av energien som frigjøres når elektronene beveger seg fra høy energi til lavere energitilstander som i glykolyse eller respirasjon. Elektroner donert av «halvreaksjonene» på toppen kan forbrukes i en halvreaksjon lavere på tårnet for å fullføre en termodynamisk gunstig reaksjon. For eksempel innebærer netto prosessen med glykolyse oksidasjon av glukose til pyruvat koblet til reduksjon AV NAD+ TIL NADH. Siden oksidasjonen av glukose ligger øverst i tårnet og reduksjonen AV NAD+ er under den, er denne elektronstrømmen termodynamisk gunstig. Sammenlignet MED ATP hydrolyse skala bar kan vi også se at denne elektronstrømmen er gunstig nok til å generere ATP. Aerob respirasjon innebærer mange mellomliggende elektronoverføringer gjennom elektrontransportkjeden. Flere av disse overgangene er vist, inkludert oksidasjonssuksinatet til fumarat som er mekanisk koblet til reduksjonen av ubiquinon til ubiquinol i de indre mitokrondriale membranene. Hver av disse mellomliggende elektronoverføringene må være termodynamisk gunstige for seg selv for at respirasjonen skal fortsette. Ved å sammenligne MED «ATP hydrolyseskala» kan vi se at de enkelte transformasjonene i elektrontransportkjeden ikke er energiske nok til å generere ATP alene. Likevel er de gunstige nok til å pumpe en proton over cellen eller mitokondriamembranen. Dette er det energiske grunnlaget for chemiosmosis: celler lagrer kvanta av energi for liten FOR ATP-syntese i protongradienten over en membran. Denne energien brukes senere til å generere ATP ved å konvertere h + – gradienten til fosfoanhydrid-bindinger på ATP gjennom ATP-syntasen.
SELV OM ATP ofte hevdes å være cellens energivaluta, er faktisk bærerne av reduserende kraft ikke mindre viktige for den energiske balansen i cellen. DET viktigste eksempelet på disse bærerne er molekylet NADH i dets reduserte eller oksiderte (NAD+) former. Vi kan bruke redokspotensialet til å koble disse to molekylære hovedpersonene, og estimere en øvre grense på antall ATP-molekyler som kan produseres ved oksidasjon AV NADH (produsert for eksempel I TCA-syklusen). NAD + / NADH-paret har et redokspotensial På E = -0.32 V og det oksyderes av oksygen for å gi vann (protoner som kommer fra media) Med et redokspotensial På E = +0.82 V. Begge er vist I Figur 1 som en del av et «redokstårn» av viktige biologiske halvreaksjoner som kan knyttes til å finne den totale redokspotensialendringen og dermed den frie energien. For den reaksjonen som er vurdert ovenfor av NADH oksidasjon av oksygen, maksimal forbundet gratis energi som kan hentes ut er dermed
ΔG = n x F x ΔE = 2 x 100 kJ/(molxV) x (0.82-(-0.32)) V = 230 kJ/mol≈ 90 kBT,
hvor n=2 og F≈100kJ/mol/V. ATP hydrolyse har en fri energi endring av ≈50kJ/mol under fysiologiske forhold, finner vi at 228 kJ/mol tilstrekkelig til å produsere maksimalt 228/50≈4.5 ATPs. I cellen fortsetter oksidasjon AV NADH gjennom flere trinn i respirasjon og resulterer i overføring av 10 protoner over membranen mot det elektrokjemiske potensialet (BNID 101773). Disse protonoverføringene tilsvarer enda en måte å fange biokjemisk energi på. Denne energien brukes deretter Av Atpasen til å produsere 2-3 ATPs. Vi finner dermed at omtrent halvparten av energien som ble frigjort ved overføring av elektroner FRA NADH til oksygen, er konservert I ATP. Å sikre at reaksjonen fortsetter på en retningsbestemt måte for å produsere ATP i stedet for å konsumere det krever at noe av energien er «bortkastet» da systemet må være ute av likevekt.
Hvorfor skal man diskutere redokspotensialer av halvreaksjoner og ikke frie energier av fulle reaksjoner? Enhetene selv skylder sin opprinnelse til evnen innen elektrokjemi å måle i laboratoriet spenningsforskjellen, dvs. potensialet målt i volt, over to kamre som inneholder forskjellige elektronbærere, og å stoppe nettreaksjonen med en spenning. Nytten av redokspotensialer for halvreaksjoner ligger i evnen til å sette sammen kombinasjoner av forskjellige donorer og akseptorer for å vurdere termodynamisk gjennomførbarhet og energiøkning av hver vurdert reaksjon. Hvis du har k mulige elektronoverføringsforbindelser, kan ~k2 mulige reaksjoner forutsies basert på bare k-redokspotensialene.Akkurat som vi snakker om pH i en løsning, ved første gjetning, kan vi forestille oss at det ville være mulig å snakke om et tilsynelatende analogt redokspotensial i cellen. Å kjenne konsentrasjonen av de reduserte og oksiderte former av et gitt reaksjonspar definerer deres basseng redokspotensial via forholdet
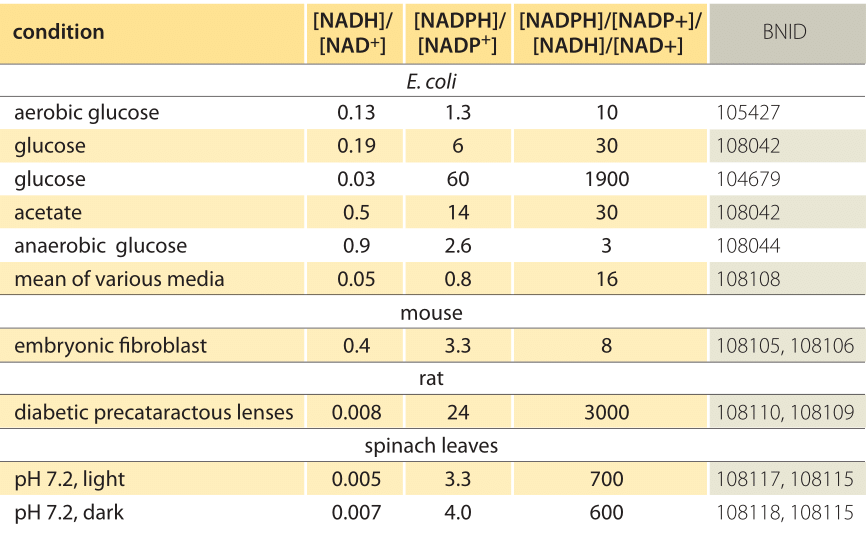
Tabell 1: konsentrasjonsforhold av de vanlige elektrondonorparene NAD/NADH og NADP/nadph. Som man kan se den første er relativt oksidert og den andre relativt redusert med et forhold mellom dem vanligvis mye større enn 1.
denne ligningen (en såkalt nernst-ligning) gir verdien av redokspotensialet under konsentrasjonsforhold som er typiske for cellen i motsetning til standardtilstandsbetingelsene (hvor per definisjon =). Som et eksempel, vurder donasjon av et elektron TIL NAD+ som resulterer i oksidert FORM NADH. I mitokondriamatrisen rapporteres et forhold på 10 ganger mer av den oksiderte formen (BNID 100779) som vist i Tabell 1. I dette tilfellet finner vi faktoren er ≈30 mV og dermed redoks potensielle endringer fra -0.32 V til -0.29 V. For å sikre at effektretningen vi fikk er fornuftig, merker vi at med en overflod av oksidert form er tendensen til å bli oksidert av oksygen noe lavere, sett av det faktum at redokspotensialet nå er nærmere enn før for oksygen / vannelektronutvekslingsparet (+0,82 V).
en celle er ikke i likevekt og det er svak kobling mellom forskjellige redokspar. Denne situasjonen fører til etablering av forskjellige redokspotensialer for sameksisterende redokspar i cellen. Hvis fluxene av produksjon og utnyttelse av de reduserte og oksiderte formene av et redokspar, Ared og Aox og en Annen Avlet Og Boks, er mye større enn deres interkonversjonsfluss, Ared+Boks<> Aox+Avlet, Kan A og B ha svært forskjellige redokspotensialer. Som et resultat er det syk definert å spørre om det totale redokspotensialet til cellen, da det vil være forskjellig for forskjellige komponenter i cellen. I kontrast er pH i cellen (eller i et rom i det) mye bedre definert siden vann tjener som det universelle medium som parrer de forskjellige syrebasereaksjonene og balanserer det som er kjent som det kjemiske potensialet til alle arter.
for et gitt redokspar i et gitt cellekammer foreskriver konsentrasjonsforholdet mellom de to formene redokspotensialet på en veldefinert måte. Forbindelser som utveksler elektroner raskt vil være i relativ likevekt og dermed dele et lignende redokspotensial. For å se hvordan disse ideene spiller ut, er det derfor mest nyttig å vurdere et redokspar som deltar i mange viktige cellulære reaksjoner, og som et resultat er det tett knyttet til redokstilstanden til mange forbindelser. Glutation i cytoplasma er en slik forbindelse som den deltar i reduksjon og oksidasjon av de svært utbredte tiolbindingene (de som inneholder svovel) i cysteinaminosyrer av mange proteiner. Glutation er et tripeptid (sammensatt av 3 aminosyrer), det sentrale en cystein som kan være i en redusert (GSH) eller oksidert form der den danner en dimer med en cystein fra et annet glutationmolekyl (betegnet GSSG). Halvreaksjonen for glutation er således 2 x gsh <> GSSG + 2E – + 2h+. Den andre halvreaksjonen er ofte en svovelbinding som «åpnes» i et mottakelig protein og dermed holdes i redusert form på grunn av glutationens konstante virkning. Glutation er også en dominerende aktør i nøytraliserende reaktive forbindelser som har en høy tendens til å snappe elektroner og dermed oksidere andre molekyler. Slike forbindelser er laget under oksidativt stress som for eksempel når kapasiteten til elektronoverføringsreaksjonene av respirasjon eller fotosyntese er nådd. Kollektivt kalt ROS (reaktive oksygenarter) de kan skape kaos i cellen og er involvert i mange aldringsprosesser. Glutationens dobbelte rolle i å holde proteiner foldet riktig og begrense ROS, så vel som dens relativt høye konsentrasjon og elektronoverføringsreaktivitet, gjør det til hovedproxyen for redokstilstanden til cellen. Konsentrasjonen av glutation i cellen er ≈10mM (BNID 104679, 104704, 111464), noe som gjør den til den nest mest omfattende metabolitten i cellen (etter glutamat), noe som sikrer at den spiller en dominerende rolle som elektrondonor i redokskontroll av proteinfunksjonen. I andre funksjoner av celler er det andre dominerende elektronpar. I biosyntetiske anabole reaksjoner NADP+ / NADPH paret og i sammenbrudd katabolske reaksjoner ER DET NAD+ / NADH.
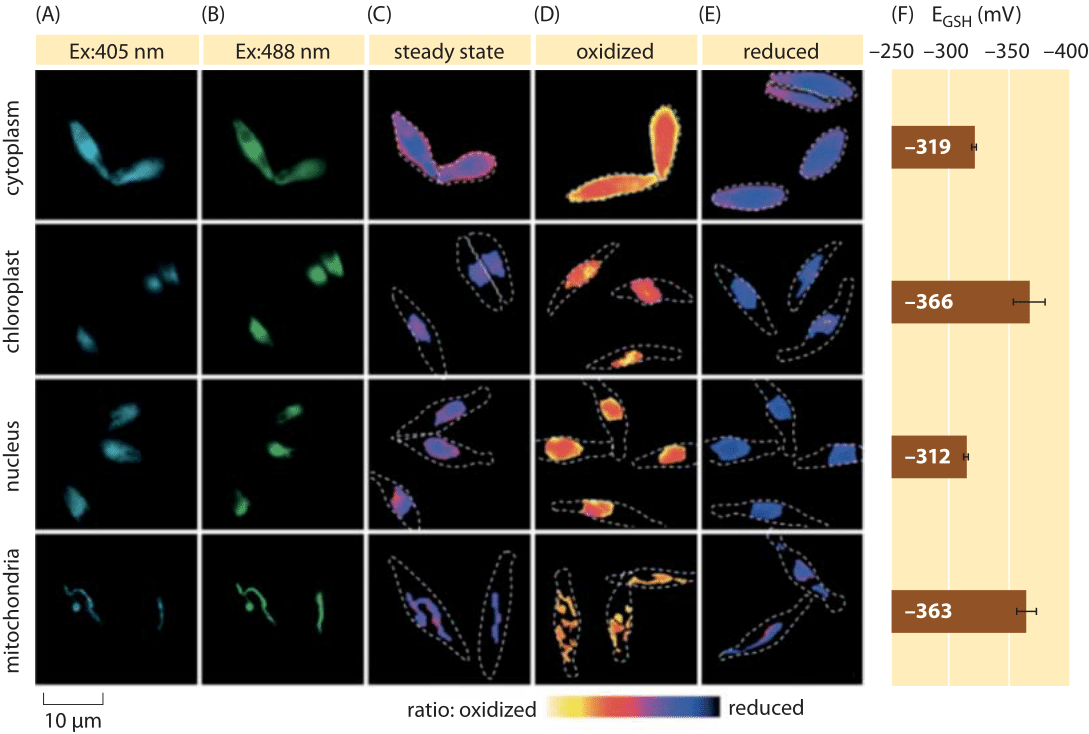
Figur 2: Avbildning av subcellulær redokspotensial av glutationbassenget i diatomalger in vivo. Fluorescensmikroskopi avbildning Av p. tricornutum celler uttrykker roGFP2 i ulike subcellulære lokaliseringer. Fluorescensbilder ved to eksitasjonsbølgelengder (A, B) ble delt for å oppnå ratiometriske verdier (C). For kalibrering blir ratiometriske bilder tatt under sterk oksidant (150 mM H2O2) (D) og reduktant (1 mM DTT) (E) forhold. Stiplede linjer representerer cellenes omriss, tegnet basert på de lyse feltbildene. (F) Steady-state redokspotensial av glutation pool, EGSH i mV, ble beregnet basert På nernst ligningen ved hjelp av oksidasjonsnivået under gitte pH-verdier for hver organelle. Tilpasset fra: S. Graff van Creveld et al., ISME J., 9:385, 2015.
Hvordan går man om å måle redokspotensialer i levende celler? Enda en annen mottaker av den fluorescerende proteinrevolusjonen var gjenstand for redokspotensialer. En reporter GFP ble konstruert for å være redoks følsom ved inkorporering av cystein aminosyrer som påvirker fluorescens basert på deres reduksjon av glutation bassenget. Figur 2 viser resultatet av å bruke en slik reporter for å se på glutation redokspotensialet i forskjellige rom i et diatom.
fra målinger av redokstilstanden til glutationbassenget i forskjellige cellulære organeller og under varierende forhold kan vi utlede forholdet mellom konsentrasjoner av redusert til oksiderte former. Verdiene varierer fra ca -170 mV I ER og i apoptotiske celler til ca -300 mV i de fleste andre organeller og i proliferasjonsceller (BNID 103543, 101823, 111456, 111465). Gitt at standard redokspotensialet til glutation er -240 mV (BNID 111453, 111463), hva er da forholdet redusert til oksidert glutation? Ved Å bruke nernst-ligningen (eller tilsvarende, Fra Boltzmann-fordelingen), tilsvarer en ti ganger endring i produkt/reaktant-forholdet en økning på ≈6 kJ / mol i fri energi (≈2 kBT). Gitt de 2 elektronene som overføres I gsh / GSSG-reaksjonen, er denne konsentrasjonsforholdsendringen vanligvis lik 30mV, men for glutation gjør støkiometrien av 2 GSH-molekyler som fusjonerer til et gssg kovalent bundet molekyl dette bare en tilnærming. 100 mV-endringen rapportert over forhold reflekterer et forhold mellom konsentrasjoner mellom omtrent like mengder av de reduserte og oksiderte formene (i apoptotiske celler) til over 1000 ganger mer konsentrasjon av den reduserte formen. Faktisk i de fleste cellulære forhold er den oksiderte formen bare en svært liten brøkdel av det totale bassenget, men fortsatt med fysiologiske implikasjoner.
et forvirrende aspekt ved redoksreaksjoner er at overføringen kan ta flere former. I ett tilfelle er det bare elektroner som i reaksjonene utført av cytokromer i elektronoverføringskjeder. I et annet vanlig tilfelle er det en kombinasjon av elektroner og protoner som i kofaktoren NAD+/NADH hvor to elektroner og En proton (H+) overføres. Til slutt er det reaksjonene der det samme antall elektroner og protoner overføres når man naturlig vil bli fristet til å diskutere overføring av hydrogen. Dette er for eksempel tilfellet for den totale reaksjonen av glukoseoksydasjon der oksygen reduseres til vann. To hydrogen har dermed blitt overført, så skal man diskutere overføring av elektroner, hydrogen eller protoner? Definisjonen av redokspotensialet (gitt ovenfor) fokuserer bare på elektronen «tilstand». Hva med protonene og hva skjer med disse når man møter en kjede av elektronoverføringsreaksjoner der noen mellomliggende forbindelser inneholder hydrogenprotonene og noen ikke? Forklaringen ligger i det omkringliggende vannet og deres pH. reaksjonen skjer ved en gitt pH, og de reagerende forbindelsene er i likevekt med denne pH og dermed gir av eller mottar et proton ingen effekt på energetikken. Det vandige mediet tjener som et basseng hvor protoner kan «parkeres» når overføringsreaksjonen bare er av elektroner (analogien lånt fra Den svært tilgjengelige innledende biokjemiboken «livets kjemi» Av Steven Rose). Disse parkerte protonene kan lånes tilbake i etterfølgende stadier som forekommer i sluttfasen av oksidativ respirasjon hvor cytokrom oksidase tar protoner fra mediet. Fordi man antar at vann er allestedsnærværende, trenger man ikke å redegjøre for protoner bortsett fra å kjenne den rådende pH som viser tendensen til å gi eller motta protoner. This is the reason why we discuss electron donors and acceptors rather than hydrogen donors and acceptors.




