den reversible utvidelsen av en ideell gass kan brukes som et eksempel på en isobarisk prosess. Av spesiell interesse er måten varme konverteres til arbeid når ekspansjon utføres ved forskjellige arbeidsgass / omgivende gasstrykk.
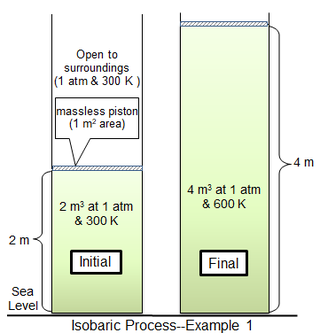
i det første prosesseksemplet omslutter et sylindrisk kammer 1 m2 i området 81,2438 mol av en ideell diatomisk gass med molekylmasse 29 g mol−1 ved 300 K. Den omliggende gassen er på 1 atm og 300 K, og skilt fra sylindergassen med et tynt stempel. For begrensende tilfelle av et masseløst stempel er sylindergassen også ved 1 atm trykk, med et innledende volum på 2 m3. Varme tilsettes sakte til gasstemperaturen er jevnt 600 K, hvorpå gassvolumet er 4 m3 og stempelet er 2 m over sin opprinnelige posisjon. Hvis stempelbevegelsen er tilstrekkelig langsom, vil gasstrykket på hvert øyeblikk ha praktisk talt samme verdi (psys = 1 atm) i hele.
for en termisk perfekt diatomisk gass er den molære spesifikke varmekapasiteten ved konstant trykk (cp) 7/2r eller 29.1006 j mol−1 deg−1. Den molare varmekapasiteten ved konstant volum (cv) er 5/2r eller 20.7862 j mol−1 deg−1. Forholdet γ {\displaystyle \ gamma }

av de to varmekapasitetene er 1,4.
varmen Q som kreves for å bringe gassen fra 300 til 600 K er
Q = Δ H = n c p Δ T = 81.2438 × 29.1006 × 300 = 709 , 274 J {\displaystyle q={\Delta \mathrm {H} }=n\,c_{p}\,\Delta \mathrm {T} =81,2438 \ ganger 29.1006\ganger 300=709,274{\text{ J}}}

.
økningen i intern energi er
Δ U = n c v Δ = 81.2438 × 20.7862 × 300 = 506 , 625 J {\displaystyle \Delta \ U=n\,c_{v}\,\Delta \mathrm {t} =81,2438\ganger 20,7862\ganger 300=506,625{\text{ J}}}

Derfor, W = Q − Δ U = 202 , 649 J = n R Δ T {\displaystyle W=Q-\Delta U=202,649{\text{ J}}=nn\Delta \mathrm {T} }

Også
W = p Δ ν = 1 atm × 2 m3 × 101325 Pa = 202 , 650 J {\displaystyle W={p\Delta \nu }=1~{\text{atm}}\ganger 2{\text{m3}}\ganger 101325{\text{Pa}}=202,650{\text{ J}}}

, som selvfølgelig er identisk med forskjellen MELLOM Δ og Δ.
her er arbeidet helt konsumert av ekspansjon mot omgivelsene. Av den totale varmen som påføres (709,3 kJ), er det utførte arbeidet (202,7 kJ) omtrent 28,6% av den tilførte varmen.

det andre prosesseksemplet ligner det første, bortsett fra at det masseløse stempelet erstattes av en som har en masse på 10.332.2 kg, som dobler trykket på sylindergassen til 2 atm. Sylindergassvolumet er da 1 m3 ved den første 300 K temperaturen. Varme tilsettes sakte til gasstemperaturen er jevnt 600 K, hvorpå gassvolumet er 2 m3 og stempelet er 1 m over sin opprinnelige posisjon. Hvis stempelbevegelsen er tilstrekkelig langsom, vil gasstrykket på hvert øyeblikk ha praktisk talt samme verdi (psys = 2 atm) i hele.
siden entalpi og intern energi er uavhengig av trykk,
Q = Δ H = 709 , 274 j {\displaystyle Q={\Delta \mathrm {H} }=709,274{\text{ J}}}

og δ u = 506 , 625 j {\Displaystyle \Delta U=506,625{\text{ J}}}

. W = p Δ V = 2 atm × 1 m3 × 101325 Pa = 202 , 650 j {\displaystyle w={p\Delta v}=2~{\text{atm}}\ganger 1~{\text{M3}}\ganger 101325{\text{Pa}}=202,650{\text{ J}}}

som i det første eksemplet konverteres Omtrent 28,6% av den tilførte varmen til arbeid. Men her brukes arbeidet på to forskjellige måter: dels ved å utvide omgivende atmosfære og dels ved å løfte 10.332, 2 kg en avstand på 1 m.
W l i f t = 10 332.2 kg × 9.80665 m / s2 × 1 m = 101, 324 j {\displaystyle w_ {\rm {løft}}=10\,332.2~{\tekst{kg}} \ ganger 9.80665~{\tekst{m / s2}} \ ganger 1 {\tekst{m}}=101,324 {\tekst{ J}}}

dermed løfter halvparten av arbeidet stempelmassen (tyngdekraft, eller «brukbart» arbeid), mens den andre halvparten utvider omgivelsene.
resultatene av disse to prosesseksemplene illustrerer forskjellen mellom varmefraksjonen som konverteres til brukbart arbeid (mgδ) vs. fraksjonen konverteres til trykk-volum arbeid gjort mot den omgivende atmosfæren. Det brukbare arbeidet nærmer seg null når arbeidstrykket nærmer seg omgivelsene, mens maksimalt brukbart arbeid oppnås når det ikke er noe omgivende gasstrykk. Forholdet mellom alt utført arbeid og varmetilførselen for ideell isobarisk gassutvidelse er
W Q = n R Δ T N C P Δ t = 2 5 {\displaystyle {\frac {W}{Q}}={\Frac {nR\Delta \mathrm {T} }{nc_{P}\Delta \mathrm {T} }}={\Frac {2}{5}}
