US Pharm. 2008; 33 (4)(Onkologi suppl): 20-30. 75% av postmenopausale kvinner med brystkreft har hormonreseptor-positiv (HR+) sykdom.1 Tamoksifen var standard for behandling av HR+ brystkreft hos postmenopausale kvinner frem til de selektive tredjegenerasjons aromatasehemmerne, som er anastrozol, letrozol og eksemestan, kom til Anvendelse.3,4 disse midlene har vist overlegen sykdomsfri overlevelse i kliniske studier sammenlignet med tamoxifen, men deres fordel ved bruk i mer enn fem år hos postmenopausale kvinner med HR+ brystkreft er ikke fastslått.3,4
det er anslått at tre fjerdedeler av postmenopausale kvinner med brystkreft har hormonreseptor-positiv (HR+) sykdom.1 Tamoxifen-en selektiv østrogen-reseptor modulator med østrogen effekter på bein, endometrievev, og lipider og anti!= østrogene effekter på brystvev – var standard terapi for HR + brystkreft hos postmenopausale kvinner til introduksjonen av selektive tredje generasjons aromatasehemmere (AIs).2-4 disse midlene-anastrozol, letrozol og eksemestan-har vist overlegen sykdomsfri overlevelse (dfs) sammenlignet med tamoksifen i kliniske studier.3,4 Bivirkninger forbundet med bruk av tamoxifen-endometriecancer, tromboemboliske komplikasjoner og tamoxifenresistens-har oppmuntret til utvikling av terapier med en annen virkningsmekanisme, som AIs.2
Se TABELL 1 for et sammendrag av viktig informasjon om Tredje generasjons Ai-Er.
Bakgrunn
Den Skotske kirurgen George Beatson beskrev det hormonelle bidraget av østrogener til karsinogenese i forhold til brystkreft i 1896.5 Beatson anerkjente at fjerning av eggstokkene (oophorektomi) var gunstig hos kvinner med brystkreft.inoperabel brystkreft.5 denne kirurgisk induserte tilstanden av østrogenmangel bidro til inhibering av tumorvekst i brystkreftceller hos kvinner med HR+ sykdom.5
Aminoglutetimid, opprinnelig formulert som et antikonvulsivt middel, var det første uspesifikke AI som først ble fremmet på slutten av 1970-tallet som et andrelinjemiddel etter tamoxifen for postmenopausale kvinner med avansert HR+ brystkreft.6 Toksiske bivirkninger som adrenal undertrykkelse og nødvendigheten av steroidbehandling førte til tilbaketrekking av aminoglutetimid fra markedet.6 hos postmenopausale kvinner med TIDLIG OG sent stadium HR+ brystkreft, viser Tredje generasjons AIs en bedre toksisitetsprofil, mer selektivitet, høyere potens og forbedret klinisk effekt sammenlignet med de eldre legemidlene. 6
Klassifisering4,7
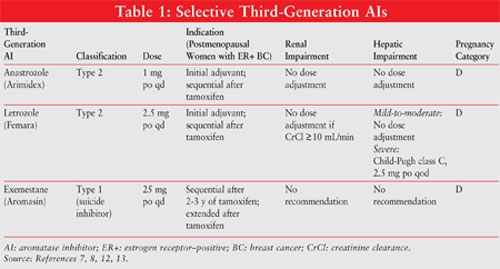
AIs er klassifisert som type 1 steroide (ikke-konkurrerende, irreversible) eller type 2 ikke-steroide (konkurrerende, reversible) hemmere. Eksemestan, en type 1-hemmer, binder irreversibelt til stedet på aromatasemolekylet og er kjent som en selvmordshemmer. Type 2-hemmere anastrozol og letrozol bindes reversibelt til aromatase. SE FIGUR 1 for de kjemiske strukturene til De forskjellige AIs-ene.
virkningsmekanisme
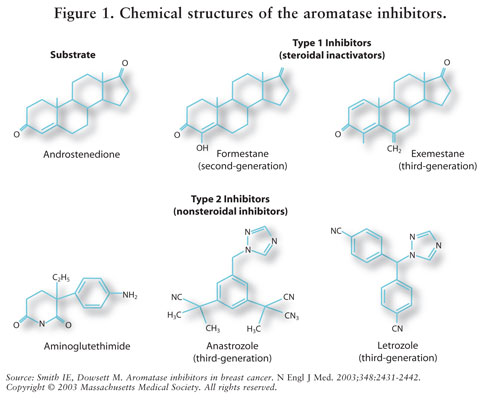
østrogensyntese medieres av enzymet aromatase.7 Aromatase konverterer androstenedion og testosteron til østron og østradiol.5,7 AIs reduserer østrogen hos postmenopausale kvinner, og hemmer dermed kreftfremkallende effekt på brystvev.7 fordi eggstokkene hos premenopausale kvinner fortsatt fungerer, Er AIs ikke indisert for denne populasjonen utenfor kliniske studier; hos disse kvinnene vil AIs stimulere hypothalamus og hypofysen til å øke produksjonen av gonadotropiner.4 Se FIGUR 2.
Toksisiteter6,8
Bivirkninger av AIs inkluderer kardiovaskulær dysfunksjon som hypertensjon, vasodilatasjon, ødem, og brystsmerter. Videre studier er nødvendig for å evaluere Full effekt Av AIs på hjertefunksjonen. Pasienter kan oppleve redusert benmineraltetthet( BMD), økt risiko for frakturer, vasomotoriske symptomer, vaginal tørrhet, muskel-og skjelettsmerter, hodepine, søvnløshet, depresjon, økt hoste, dyspnø, gastrointestinalt ubehag, vektøkning og muligens forhøyede lipidnivåer. Bentap er en dominerende bivirkning; bisfosfonater som zoledronsyre har blitt brukt til å motvirke det. Pasienter på AIs bør få vitamin D og kalsiumtilskudd. Langvarige bivirkninger og effekter på kognitiv funksjon fra AI-terapi er ennå ikke bestemt.9 AIs er kontraindisert hos gravide kvinner. Anastrozol hemmer CYP1A2, CYP2C9 OG CYP3A4.10,11 Letrozol metaboliseres AV CYP2A6 OG CYP2C19, og eksemestan metaboliserer CYP3A4.8,10-13 Induktorer AV CYP3A4 som rifampicin, fenytoin, karbamazepin og johannesurt kan føre til en reduksjon i eksemestan-nivåer når det gis samtidig. 8,12,13 Tamoksifen forårsaker en 38% reduksjon i letrozol og en 27% reduksjon i anastrozol ved samtidig administrering.2,7,8,14
Indikasjoner og Dosering
Anastrozol 10,11: Anastrozol 1 mg en gang daglig er indisert for tidlig brystkreft som innledende adjuvant behandling hos postmenopausale kvinner med hormonfølsom sykdom og som førstelinje FOR HR + eller HR-ukjent metastatisk eller lokalavansert sykdom. Det er også godkjent for bruk etter tamoxifen terapi hos kvinner med progressiv sykdom. Dosejustering er ikke nødvendig ved nedsatt nyrefunksjon eller lett til moderat nedsatt leverfunksjon.
Letrozole11,12: Letrozol 2. 5 mg en gang daglig er indisert for postmenopausale kvinner med HR + tidlig stadium brystkreft som innledende behandling eller som utvidet adjuvant behandling etter tamoxifen. Det er også indisert FOR HR+ eller HR-ukjent metastatisk sykdom. Dosejustering anbefales ved alvorlig nedsatt leverfunksjon.
Eksemestan11,14: Eksemestan 25 mg po en gang daglig er indisert som adjuvant behandling to til tre år etter tamoxifen for postmenopausale kvinner med HR + tidlig brystkreft, i totalt fem påfølgende år med hormonbehandling. Det kan også brukes for sykdom som har kommet etter tamoxifen terapi. Det bør tas etter et måltid. Dosejustering er unødvendig ved nedsatt lever-eller nyrefunksjon
Kliniske Studier
Tamoksifen – relaterte toksisiteter som endometriekreft førte til initiering av store kliniske studier som undersøkte bruk av tredje generasjons AIs hos postmenopausale kvinner med HR + brystkreft. Ulike forsøksdesign ble brukt til å vurdere ytelsen til disse midlene sammenlignet med tamoxifen.6 Overlegne resultater med hensyn til klinisk effekt og toksisitetsprofiler etablerte AIs som en ny standard for adjuvant behandling hos postmenopausale kvinner med HR+ brystkreft.6
ATAC15: ATAC (Arimidex, Tamoxifen Alene Eller I Kombinasjon), en multisenter, randomisert, dobbeltblind studie, sammenlignet tre behandlingsarmer: tamoxifen 20 mg + anastrozol placebo, anastrozol 1 mg + tamoxifen placebo, og en kombinasjon av tamoxifen 20 mg + anastrozol 1 mg. Det primære målet var å evaluere sikkerhet og effekt av tamoksifen versus anastrozol og kombinasjonen av anastrozol og tamoksifen over fem år. Totalt 9366 pasienter-3125 i anastrozolarmen, 3116 i tamoksifenarmen og 3125 i kombinasjonsarmen-ble behandlet i median 33 måneder.
etter tre år viste anastrozol DFS på 89,4% versus 87,4% for tamoxifen (hazard ratio 0,83, 95% KI , P =.013). Anastrozol reduserte frekvensen av kontralateral brystkreft (CLBC) sammenlignet med tamoksifen (odds ratio 0,42, 95% KI, P =.007). Kombinasjonsarmen ble lukket fordi ingen klinisk nytte utover tamoxifen ble funnet. Anastrozol var assosiert med bivirkninger som endometriekreft (P =.02), vaginal blødning, utslipp (P <.0001), cerebrovaskulære hendelser (P =.0006), venøse tromboemboliske hendelser (P =.0006), og hetetokter (P <.0001); tamoxifen var assosiert med færre frakturer og mindre leddsmerter (P <.0001). Etter 68 måneder økte anastrozol DFS (HR 0,87, 95% KI, P =.01) og tid til tilbakefall (HR 0,79, 95% KI, P =.0005) og reduserte fjernmetastaser (HR 0,86, 95% KI, P =.04) OG CLBC (42% reduksjon, P =.01).16 ETTER et median oppfølgingsintervall på 100 måneder viste PASIENTER med hr+ på anastrozol forbedringer I DFS (HR 0,85; P =.003), FOREKOMST AV CLBC (HR 0,60, P =.004), tid til tilbakefall (HR 0,76, P =.0001), og tid til fjern tilbakefall (HR 0,84, P =.022) sammenlignet med pasienter på tamoxifen. Den absolutte forskjellen i tilbakefall økte fra 2.8% etter fem år til 4,8% etter ni år. Frakturraten for anastrozol var høyere under behandlingen, men forskjellen ble betydelig redusert etter oppfølgingsperioden på 100 måneder. Den forlengede behandlingsperioden hadde en risiko for brudd på 1,15 med anastrozol versus 1,02 med tamoksifen. Risikoen for endometriekreft ble redusert av og på anastrozolbehandling sammenlignet med tamoksifen, med en årlig rate på henholdsvis 0,043 versus 0,14 og 0,014 versus 0,12. En forskjell i total overlevelse (OS) er ikke identifisert.
MA.1712,17: MA.17 var en randomisert, placebokontrollert, dobbeltblind studie som vurderte effekten av fem års letrozolbehandling hos postmenopausale kvinner med brystkreft som allerede hadde fullført fem års adjuvant tamoksifenbehandling. Pasientene fikk letrozol 2,5 mg eller placebo daglig i fem år. Det primære endepunktet var DFS; sekundære endepunkter var livskvalitet, utvidet sikkerhetsprofil og OS. Av de 5187 pasientene fikk 2593 letrozol og 2594 placebo; median oppfølging var 2,4 år.
i den foreløpige analysen var det 207 lokale eller metastatiske tilbakefall av brystkreft eller innledende maligniteter AV CLBC, 75 i letrozolgruppen og 132 i placebogruppen. Anslått fireårig DFS-rates for de to gruppene var henholdsvis 93% og 87% (P ?.001 for evaluering AV DFS). I letrozolarmen hadde DFS EN TIME på 0,61 (95% KI, P ?.001). Letrozol viste 43% reduksjon i forekomst av brystkreft (HR 0,57, 95% KI, P =.00008).4 Med unntak av node-positive pasienter (P =.04) NÅDDE IKKE OS statistisk signifikans (HR 0,82, P =.30).4 Pasienter i letrozolarmen opplevde lavgradige vasomotoriske symptomer, myalgi og leddgikt. Osteoporose var mer vanlig (men ikke signifikant) i letrozolarmen versus placebo (5,8% vs. 4,5%; P =.07), og bruddraten var sammenlignbar mellom armene. Studien ble avsluttet etter en median på 2,4 år på grunn av en reduksjon i brystkreft hendelser i letrozol armen. Utvidet adjuvant behandling med letrozol etter fem års tamoxifen forbedret DFS.
BIG 1-987,9,18: Breast International Group (BIG) 1-98 studie, en dobbeltblind, multisenter, randomisert studie, inkluderte 8028 postmenopausale kvinner med HR + tidlig stadium brystkreft. Studien omfattet fire behandlingsarmer som evaluerte fem år med tamoxifen monoterapi, fem år med letrozol monoterapi, tamoxifen i to år, deretter en bytte til letrozol i tre år, eller letrozol i to år og deretter en bytte til tamoxifen i tre år. Det primære målet var DFS; sekundære mål var tid til fjern metastase, sikkerhet og OS. DFS økte hos pasienter som fikk letrozol sammenlignet med de som fikk tamoxifen (HR 0,81, 95% KI, relativ reduksjon 19%, P =.003), med en absolutt forskjell på 1,5% på tre år. Tamoxifen økte forekomsten av tromboemboliske hendelser sammenlignet med letrozol (ELLER 0,38, P <.0001). Benfrakturer ble økt i letrozolarmen (OR 1,44, P =.006).
IES14,19: Ies (Intergroup Exemestane Study) var en randomisert, dobbeltblind, Multisenter, Fase III studie hvis mål var å avgjøre om endring til eksemestan etter to til tre år med tamoxifen var mer effektiv enn å fortsette tamoxifen i fem år. Studien inkluderte 4742 postmenopausale kvinner randomisert til to behandlingsarmer; 2362 personer var planlagt å bytte til eksemestan 25 mg po qd etter to til tre år med tamoxifen 20 mg po qd for å fullføre fem års behandling, og de resterende 2380 var planlagt å motta tamoxifen 20 mg po qd i fem år. Dfs var det primære endepunktet; sekundære endepunkter var OS, utvidet toksisitetsprofil og frekvens AV CLBC.
Bivirkninger som oppstod over en median på 30,6 måneder, inkluderte FREKVENS AV CLBC, lokal eller metastatisk tilbakefall og død. Det var 449 hendelser-183 i exemestan-armen og 266 i tamoxifen-armen. Eksemestanarmen hadde en ujustert HR på 0,68 (95% KI ,P <.001 ved log-rank-testen), som viste en 32% reduksjon i risiko og var analog med en fordel I DFS på 4.75 (95% KI) etter tre år. Etter tre år hadde eksemestanarmen en DFS på 91,5% (95% KI ) sammenlignet med 86,8% (95% KI ) i tamoxifen-armen. DET var ingen signifikant forskjell I OS mellom de to gruppene, med 93 dødsfall i exemestan-armen og 106 dødsfall i tamoxifen-armen. Det var en signifikant forskjell i frekvensen AV CLBC (P =.04) – 20 personer i tamoxifen-armen og ni i exemestan-armen. Bruk av exemestan for å fullføre fem års behandling etter to til tre år med tamoxifen forbedret DFS sammenlignet med fem års tamoxifen.
Hindre Bentap FRA AI Therapy20
Postmenopausale kvinner er utsatt for å utvikle redusert BMD på grunn av reduserte nivåer av østrogen. AI terapi i postmenopausal brystkreft pasient forverrer denne tendensen. Denosumab, et fullt humant monoklonalt undersøkelsesantistoff, binder reseptoraktivator for nukleær faktor kB ligand (RANKL) og forhindrer RANKL-aktivitet. RANKL er viktig for osteoklastisk aktivitet, noe som betyr nedbrytning av bein. Denosumab og risedronat, et bisfosfonat, blir evaluert for deres evne til å motvirke bentapet forbundet med AI-terapi.
Denosumab Study20: en multisenter, randomisert Fase III studie evaluerte bruken av denosumab 60 mg administrert subkutant en gang hvert halvår hos postmenopausale kvinner som tok AIs for HR + ikke-metastatisk brystkreft. Målet var å vurdere endringen i BMD i korsryggen fra baseline til 12 måneder. Av de 252 pasientene ble 127 tildelt denosumab og 125 ble tildelt placebo. BEGGE armene fikk kalsium og vitamin d. BMD ble evaluert ved dual-energy røntgenabsorptiometri. Etter 12 og 24 måneders behandling med denosumab eller placebo var det en forskjell på henholdsvis 5,5% og 7,6% i BMD-økning i lumbalregionen til fordel for denosumab (P <.0001 for begge måneder). Denosumab viste en sammenlignbar toksisitetsprofil i forhold til placebo. Denosumabbehandling i mer enn 24 måneder er ennå ikke vurdert.
IBIS-Ii Beinunderstudie21: DEN Internasjonale Brystkreftintervensjonsstudien-II (IBIS-II) Benunderstudien ble avledet FRA IBIS-II, som evaluerte postmenopausale kvinner med økt sannsynlighet for å utvikle brystkreft som ble randomisert til anastrozol eller placebo i fem år. Substudien, med en nåværende inklusjon på 700 pasienter, evaluerer risedronat versus placebo for forebygging AV BMD-tap hos kvinner med lave t-skår ved baseline. EN undergruppe av pasienter fra IBIS-II-studien ble tildelt en av tre ulike behandlingsstrategier i understudien. Etter ett års behandling fikk 350 anastrozol og 350 placebopasienter fra IBIS-II substudiresultater. Stratum 1 besto av 227 pasienter på anastrozol med normale t-skår (T-skår ?1), stratum 2 omfattet 80 pasienter med osteopeni (ñ 2,5 ? T-score < 1) som fikk risedronat 35 mg en gang i uken eller placebo, og stratum 3 omfattet 43 pasienter med osteoporose (ñ4 <T-score <2,5) som fikk risedronat 35 mg en gang i uken.
for pasienter med osteopeni eller osteoporose ved baseline syntes risedronat å hemme bentap assosiert med anastrozol. I stratum II viste risedronat gunstige effekter på BMD-bevaring for total hofte, men ikke lumbale ryggrad (P =.005 og P =.15, henholdsvis vs. placebo). Ingen alvorlige bivirkninger eller legemiddelinteraksjoner var forbundet med risedronat.
Studie Av AIs Hos Premenopausale Kvinner (MYKE)21-26
omtrent 33% av kvinner under 50 år vil bli diagnostisert med invasiv brystkreft. 22 Suppression Of Ovarial Function Trial (SOFT, IBCSG 24-02, BIG 2-02) undersøker bruken AV AI-terapi hos premenopausale kvinner med HR + brystkreft. Forsøket, som har en målrettet pasientinnmelding på 3000, involverer premenopausale kvinner med HR + brystkreft som har fullført kjemoterapi eller som bare har fått kirurgi. Ovarieablation etableres ved administrering av triptorelin (et gonadotropinfrigjørende hormon) en gang månedlig i fem år, kirurgisk ooforektomi eller bekkenbestråling. Pasientene vil bli randomisert til en av tre armer, der den første armen får tamoxifen en gang daglig i fem år, den andre armen får tamoxifen i fem år i kombinasjon med ovarieablasjon, og den tredje armen får eksemestan i fem år i kombinasjon med ovarieablasjon. Pasienter vil få exemestane eller tamoxifen i fem år.
Chemoprevention Trials23 – 27
Tamoxifen er indisert for brystkreft chemoprevention.6 toksisitetsprofilen er en årsak til begrensning med hensyn til terapeutisk bruk.6 AIs kan redusere forekomsten AV HR + brystkreft hos høyrisikopasienter på grunn av en reduksjon i forekomsten AV CLBC sammenlignet med tamoksifen i kliniske studier som ATAC.6
AI chemoprevention studier inkluderer International Breast Cancer Study Group (IBCSG) trial 31-03 (IBCSG 31-03) OG National Cancer Institute Of Canadas KART.3 rettssaken. Hovedmålet med den internasjonale, randomiserte, placebokontrollerte MULTISENTERSTUDIEN IBCSG 31-03 er å evaluere bruken av anastrozol til forebygging av brystkreft hos postmenopausale kvinner. Det primære utfallsmålet er forekomsten av invasiv og ikke-invasiv brystkreft; det sekundære utfallsmålet er forekomsten av osteoporose og brudd.5 IBCSG 31-03-studien har en målinnmelding på 6000. kart.3 studie evaluerer eksemestan som et kjemopreventivt middel hos postmenopausale kvinner. Det primære målet for det placebokontrollerte KARTET.3 forsøk er å vurdere effektiviteten av eksemestan ved å redusere forekomsten av invasiv brystkreft.
Potensiell Fremtidig Bruk: Kasusrapporter
Letrozol ble brukt etter svikt av klomifen for å indusere fruktbarhet hos 22 kvinner med polycystisk ovariesyndrom. Letrozol induserte eggløsning i 75% av syklusene mot 44,4% av syklusene indusert av klomifen. Fire graviditeter skyldtes ovulasjonene indusert av letrozol, og ingen signifikante bivirkninger var forbundet med letrozol.28,29
en 57 år gammel overvektig kvinne med endometriose etter hysterektomi og bilateral salpingo-ooforektomi fikk anastrozol etter megestrolbehandling. Pasienten hadde ingen endometriale lesjoner etter ni måneder.28,30
en pasient med McCune-Albrights syndrom ble gitt anastrozol for tidlig pubertet; pasientens østradiol normaliserte seg etter 2,5 år med anastrozol og beinalderen avansert med seks måneder.28,31 Økt østrogen kan indusere gynekomasti og hypogonadotropisk hypogonadisme.28,31 Redusert østrogen MED AI resulterte i normal gonadotropin og testosteron hos menn med gynekomasti og hypogonadotropisk hypogonadisme. 28,31,32
Letrozol ble studert hos pasienter med residiverende eggstokkreft; de pasientene som fikk letrozol hadde stabilisering av sykdommen.28,33 Neoadjuvant letrozol ble gitt til 10 postmenopausale kvinner med livmorkreft; legemidlet viste konstruktive kliniske endringer og hadde ingen negativ kirurgisk innvirkning.28,34
når behandling med testolakton versus anastrozol ble sammenlignet hos infertile menn, var effekten av de to midlene lik.28,35 Pasienter med Klinefelters syndrom hadde mer effektiv behandling med testolakton enn med anastrozol.28,35
Konklusjoner
Tredje generasjons AIs har vist overlegen DFS hos postmenopausale kvinner med HR + brystkreft, men den kliniske fordelen av MER enn fem års AI-behandling hos disse pasientene er ikke fastslått.4 Den Nasjonale Kirurgiske Adjuvant Bryst – Og Tarmprosjektet (nsabp) B-33 (eksemestan) studien og en påfølgende randomisering AV MA.17 (letrozol) studien vil undersøke bruken av Disse AIs versus placebo i ytterligere fem år.4 AIs er et passende alternativ for HR + postmenopausale kvinner der tamoxifen er kontraindisert.4
de gunstige effektene av Tredje generasjons AIs inkluderer en mer tolerabel toksisitetsprofil og overlegen DFS sammenlignet med tamoxifen. Effektnivået mellom disse midlene og tamoxifen er sammenlignbart. Det er fortsatt usikkerhet knyttet til behandlingsvarighet, langtidstoksisitetsprofil og passende administrasjonssekvens for AIs.4 Nye studier er nødvendig for å produsere selektive aromatasemodulatorer som vil produsere mindre toksisitet enn AIs.25,36-37
1. Robertson JFR. Fulvestrant (FaslodexÆ) – hvordan lage et godt stoff bedre. Onkolog . 2007;12:774-784.
2. Osborne CK. Drug terapi: tamoxifen i behandling av brystkreft. N Engl J Med. 1998;339:1609-1618.
3. Nasjonalt Kreft Omfattende Nettverk. NCCN klinisk praksis retningslinjer i onkologi–v. 1. 2008. Brystkreft. www.nccn.org/professionals/physician_gls/f_guidelines.asp. Besøkt 11.oktober 2007.
4. Winer EP, Hudis C, Burstein HJ, et al. American Society Of Clinical Oncology technology assessment om bruk av aromatasehemmere som adjuvant behandling for postmenopausale kvinner med hormonreseptor-positiv brystkreft: statusrapport 2004. J Clin Oncol . 2005;23:619-629.
5. Dunn BK, Wickerham DL, Ford LG. Forebygging av hormonrelaterte kreftformer: brystkreft. J Clin Oncol. 2005;23:357-367.
6. Smith IE, Dowsett M. Aromatasehemmere i brystkreft. N Engl J Med. 2003;348:2431-2442.
7. Goss PE, Strasser K. Aromatasehemmere i behandling og forebygging av brystkreft. J Clin Oncol . 2001;19:881-894.
8. Lacy CF, Armstrong LL, Goldman MP, et al, eds. Drug Informasjon Handbook. 13.utg. Hudson, OH: Lexi-Comp; 2005: 117,598,871.
9. Ellis MJ, red. Aromatasehemmere for behandling av brystkreft. Manhasset, NY: Oncology Publishing Group, CMP Healthcare Media; 2005: 29-45.
10. Arimidex (anastrozol) pakningsvedlegg. Wilmington, DE: AstraZeneca Pharmaceuticals LP; Mai 2007.
11. Arora A, Potter JF. Aromatase inhibitors: current indications and future prospects for treatment of postmenopausal breast cancer. J Am Geriatr Soc. 2004;52:611-616.
12. Femara (letrozole) package insert. East Hanover, NJ: Novartis Pharmaceuticals Corp; December 2006.
13. Shaw G. In preventing breast cancer occurrence…anastrozole beats tamoxifen in ATAC. Clin Oncol News . 1/2008. www.clinicaloncology.com/index.asp?ses=ogst§ion_id=148&vis=dept&artikkel_id=9884. Besøkt 17.Mars 2008.
14. Aromasin (eksemestan) pakningsvedlegg. New York, New York: Pfizer Inc; Februar 2007.
15. Baum M, Budzar AU, Cuzick J, Et al, for ATAC Trialists ‘ Gruppe. Anastrozol alene eller i kombinasjon med tamoksifen versus tamoksifen alene for adjuvant behandling av postmenopausale kvinner med tidlig brystkreft: første resultater fra den randomiserte atac-studien. Lancet. 2002;359:2131-2139.
16. Howell A, Cuzick J, Baum M, et al, for ATAC Trialists ‘ Gruppe. Resultater fra atac (Arimidex, Tamoxifen, Alene eller I Kombinasjon) studien etter fullført 5 års adjuvant behandling for brystkreft. Lancet. 2005;365:60-62.
17. Goss PE, Ingle JN, Martino S, et al. En randomisert studie av letrozol i postmenopausale kvinner etter fem år med tamoxifen terapi for tidlig stadium brystkreft. N Engl J Med. 2003;349:1793-1802.
18. Thrlimann B, Keshaviah A, Coates AS, et al, for Breast International Group (BIG) 1-98 Samarbeidende Gruppe. En sammenligning av letrozol og tamoxifen hos postmenopausale kvinner med tidlig brystkreft. N Engl J Med. 2005;353:2747-2757.
19. Coombes RC, Hall E, Gibson LJ, et al, for Intergroup Exemestane Studien. En randomisert studie av eksemestan etter to til tre års tamoxifenbehandling hos postmenopausale kvinner med primær brystkreft. N Engl J Med. 2004; 350:
1081-1092.
20. Ellis G, Bone HG, Chlebowski R, et al. En fase 3-studie av effekten av denosumabbehandling på benmineraltetthet hos kvinner som får aromatasehemmere for ikke-metastatisk brystkreft. Papir presentert på: Den 30. Årlige San Antonio Breast Cancer Symposium; desember 13-16, 2007; San Antonio, TX. Abstrakt 47.
21. J. r., J. R., et al. Effekt av anastrozol på benmineraltetthet etter ett års behandling: resultater fra benunderstudie av INTERNATIONAL Breast Cancer Intervention Study (IBIS-II). Paper presentert på: Den 30. Årlige San Antonio Breast Cancer Symposium; desember 13-16, 2007; San Antonio, TX. Sammendrag 28.
22. Dellapasqua S, Colleoni M, Gelber RD, Goldhirsch A. adjuvant endokrin behandling for premenopausale kvinner med tidlig brystkreft. J Clin Oncol. 2005;23:1736-1750.
23. Nasjonalt Kreftinstitutt. Behandling av brystkreft (PDQ). www.cancer.gov/cancertopics/pdq/treatment/breast/healthprofessional. Besøkt 26.desember 2007.
24. Baylor College Of Medicine Kliniske Studier. Undertrykkelse Av Eggstokkfunksjonsforsøk (MYK). www.breastcenter.tmc.edu/clinic/trials/soft.htm. Besøkt 26.desember 2007.
25. Aebi S, Castiglione-Gertsch M. adjuvant endokrin terapi for de svært unge pasientene. Amme. 2003;12:509-515.
26. ClinicalTrials.gov. Undertrykkelse av ovariefunksjon pluss enten tamoxifen eller eksemestan sammenlignet med tamoxifen alene ved behandling av premenopausale kvinner med hormonresponsiv brystkreft. www.clinicaltrials.gov/. Tilgjengelig desember 26, 2007.
27. Kjetil J. Aromatasehemmere for forebygging av brystkreft. J Clin Oncol. 2005;23:1636-1643.
28. Karaer O, Elleruá S, Koyuncu FM. Aromatasehemmere: mulige fremtidige applikasjoner. Acta Obstet Gynecol Scand. 2004:83:699-706.
29. Mitwally MF, Casper RF. Bruk av en aromatasehemmer til induksjon av eggløsning hos pasienter med utilstrekkelig respons på klomifensitrat. Fertil Steril. 2001;75:305-309.
30. Bulun SE, Yang S, Fang Z, et al. Rolle aromatase i endometrial sykdom. J Steroid Biochem Mol Biol. 2001;79:19-25.
31. Feuillan P, Merke D, Leschek EW, Cutler GB. Bruk av aromatasehemmere i tidlig pubertet. Endocr Relatert Kreft. 1999;6:303-306.
32. Shozu M, Sebastian S, Takayama K, et al. Østrogen overskudd assosiert med nye gain-of-funksjon mutasjoner som påvirker aromatase genet. N Engl J Med. 2003;348:1855-1865.
33. Bowman A, Gabra H, Langdon SP, et al. CA 125-respons er assosiert med østrogenreseptoruttrykk i en fase II-studie av letrozol i eggstokkreft: identifikasjon av en endokrin sensitiv undergruppe. Clin Kreft Res. 2002; 8: 2233-2239.
34. Berstein L, Maximov S, Gershfeld E, et al. Neoadjuvant behandling av endometriecancer med aromatasehemmeren letrozol: endokrine og kliniske effekter. Eur J Obstet Gynecol Reprod Biol. 2002;105:161-165.
35. Raman JD, Schlegel PN. Aromatasehemmere for mannlig infertilitet. J Urol. 2002;167:624-629.
36. Simpson ER, Dowsett M. Aromatase og dets hemmere: betydning for brystkreft terapi. Siste Prog Horm Res. 2002; 57: 317-338.