curbe de încălzire
figura \(\PageIndex{3}\) prezintă o curbă de încălzire, un grafic al temperaturii față de timpul de încălzire, pentru un eșantion de 75 g de apă. Eșantionul este inițial gheață la 1 atm și -23 centimetric C; pe măsură ce se adaugă căldură, temperatura gheții crește liniar cu timpul. Panta liniei depinde atât de masa gheții, cât și de căldura specifică (Cs) a gheții, care este numărul de jouli necesari pentru a crește temperatura de 1 g de gheață cu 1 hectar C. Pe măsură ce temperatura gheții crește, moleculele de apă din cristalul de gheață absorb din ce în ce mai multă energie și vibrează mai puternic. La punctul de topire, au suficientă energie cinetică pentru a depăși forțele atractive și pentru a se deplasa unul față de celălalt. Pe măsură ce se adaugă mai multă căldură, temperatura sistemului nu crește în continuare, ci rămâne constantă la 0 centimetrul C până când toată gheața s-a topit. Odată ce toată gheața a fost transformată în apă lichidă, temperatura apei începe din nou să crească. Acum, însă, temperatura crește mai lent decât înainte, deoarece capacitatea specifică de căldură a apei este mai mare decât cea a gheții. Când temperatura apei ajunge la 100 C, apa începe să fiarbă. Aici, de asemenea, temperatura rămâne constantă la 100 centimetric C până când toată apa a fost transformată în abur. În acest moment, temperatura începe din nou să crească, dar într-un ritm mai rapid decât se vede în celelalte faze, deoarece capacitatea de căldură a aburului este mai mică decât cea a gheții sau a apei.
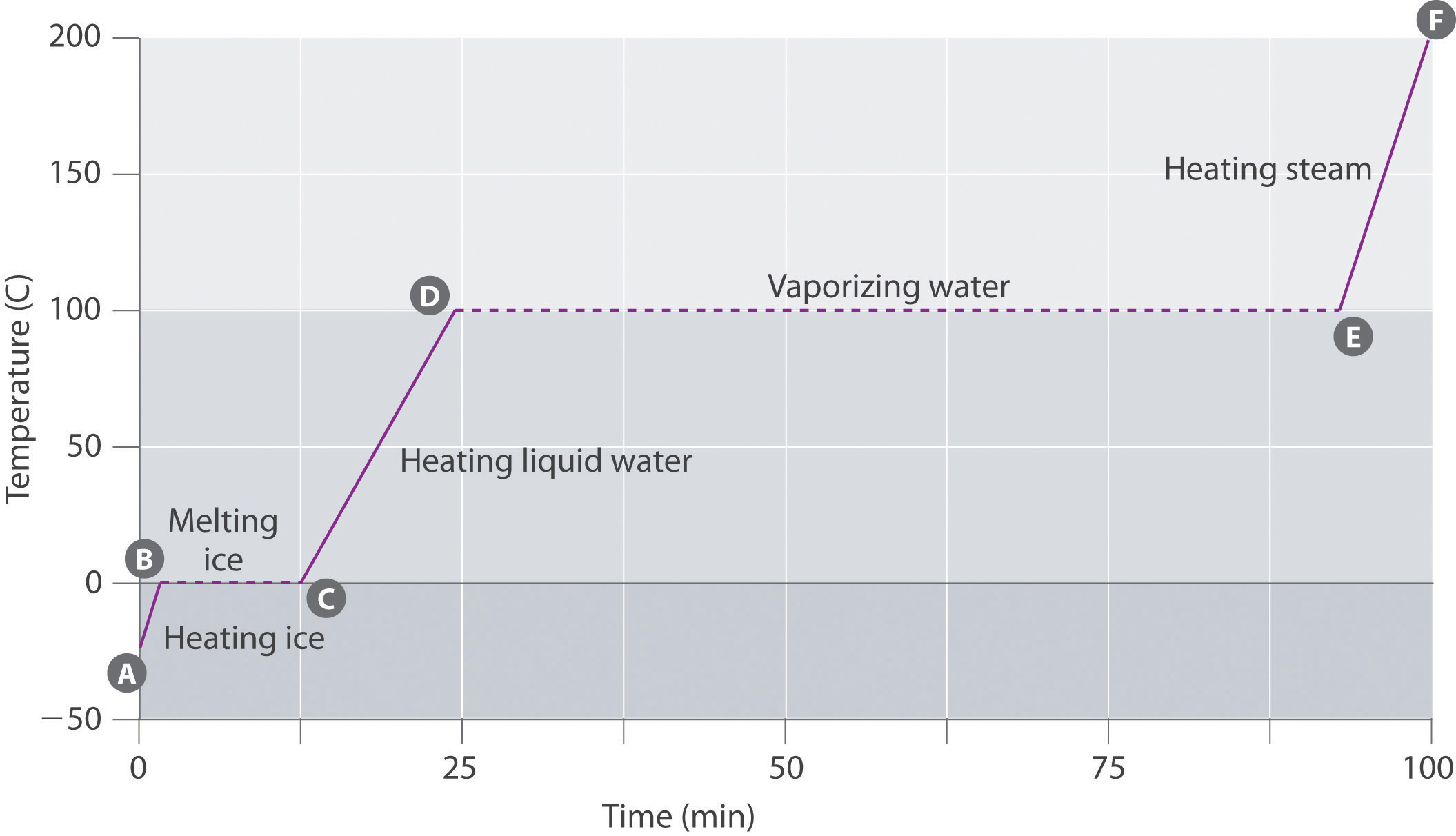
astfel, temperatura unui sistem nu se modifică în timpul unei schimbări de fază. În acest exemplu, atâta timp cât este prezentă chiar și o cantitate mică de gheață, temperatura sistemului rămâne la 0 centimetric C în timpul procesului de topire și atâta timp cât este prezentă chiar și o cantitate mică de apă lichidă, temperatura sistemului rămâne la 100 centimetric C în timpul procesului de fierbere. Rata la care se adaugă căldura nu afectează temperatura amestecului de gheață/apă sau apă / abur, deoarece căldura adăugată este utilizată exclusiv pentru a depăși forțele de atracție care țin împreună Faza mai condensată. Mulți bucătari cred că mâncarea se va găti mai repede dacă căldura este ridicată mai sus, astfel încât apa să fiarbă mai rapid. În schimb, vasul cu apă va fierbe până la uscare mai devreme, dar temperatura apei nu depinde de cât de puternic fierbe.
temperatura unei probe nu se modifică în timpul unei schimbări de fază.
dacă se adaugă căldură la o rată constantă, ca în figura \(\PageIndex{3}\), atunci lungimea liniilor orizontale, care reprezintă timpul în care temperatura nu se schimbă, este direct proporțională cu magnitudinea entalpiilor asociate schimbărilor de fază. În figura \(\PageIndex{3}\), linia orizontală la 100 XTC C este mult mai lungă decât linia la 0 XTC C, deoarece entalpia de vaporizare a apei este de câteva ori mai mare decât entalpia de fuziune.
un lichid supraîncălzit este o probă a unui lichid la temperatura și presiunea la care ar trebui să fie un gaz. Lichidele supraîncălzite nu sunt stabile; lichidul va fierbe în cele din urmă, uneori violent. Fenomenul supraîncălzirii provoacă „bumping” atunci când un lichid este încălzit în laborator. Când o eprubetă care conține apă este încălzită peste un arzător Bunsen, de exemplu, o porțiune din lichid poate deveni ușor prea fierbinte. Când lichidul supraîncălzit se transformă într-un gaz, acesta poate împinge sau „ciocni” restul lichidului din eprubetă. Plasarea unei tije de agitare sau a unei mici bucăți de ceramică (un „cip de fierbere”) în eprubetă permite formarea de bule de vapori pe suprafața obiectului, astfel încât lichidul să fiarbă în loc să se supraîncălzească. Supraîncălzirea este motivul pentru care un lichid încălzit într-o ceașcă netedă într-un cuptor cu microunde poate să nu fiarbă până când ceașca nu este mișcată, când mișcarea Cupei permite formarea bulelor.