reacțiile Redox se referă la transferul electronilor de la o substanță la alta, deci este util să avem un sistem pentru a urmări ce câștigă și ce pierde electroni și câți electroni sunt implicați. Sistemul de evidență a reacțiilor redox se numește numere de oxidare. S-ar putea să vă amintiți, de asemenea, ceva numit electronegativitate din clasele de chimie anterioare.
electronegativitate
capacitatea unui atom legat de a atrage electroni împărțiți spre sine.
când doi atomi de elemente diferite sunt legați împreună printr-o legătură covalentă (electroni care împart), electronii nu sunt în general împărțiți în mod egal între cei doi atomi din cauza diferențelor în electronegativitățile lor. Gândiți-vă la acest lucru ca la un remorcher de război pentru electroni. Uneori, ambii atomi trag cu putere egală pe electronii împărțiți; alteori există în mod clar un jucător mai puternic care va trage electronii mai aproape de sine.
luați în considerare legătura dintre un atom de hidrogen (cu un electron de valență) și un atom de oxigen (cu cei șase electroni de valență):
|
|
+
|
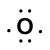 |
=
|
 |
Because oxygen has a higher electronegativity than hydrogen, the shared electrons are closer to the oxygen atom than to atomul de hidrogen. Acesta nu este transferul total de electroni care ar crea un ion, dar se formează sarcini parțiale. Capătul de hidrogen al legăturii este parțial pozitiv (+1) deoarece a pierdut parțial un electron, iar capătul de oxigen al H-O este parțial negativ (-1) deoarece a câștigat parțial un electron din hidrogen:
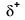 |
|
 |
|
Our molecule is incomplete, however, because there is a lone electron around oxygen. Let’s add one more hydrogen to complete our water molecule:
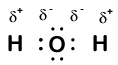
vedem că fiecare dintre cei doi hidrogeni a „pierdut” un electron la oxigen. Oxigenul a „câștigat” doi electroni—unul din fiecare hidrogen. Din nou, aceștia nu sunt ioni adevărați, dar este util să ne gândim la ei în același mod.
sarcinile date atomilor dintr-o moleculă în acest fel se numesc numere de oxidare. Putem folosi numerele de oxidare pentru a urmări unde se află electronii într-o moleculă și cum se mișcă în timpul unei reacții. În exemplul nostru de apă, hidrogenului i se atribuie un număr de oxidare de +1, deoarece fiecare hidrogen individual a „pierdut” un electron. Oxigenul are un număr de oxidare de + 2, deoarece un singur atom de oxigen a „câștigat” un total de doi electroni, unul din fiecare hidrogen.
Iată o altă moleculă care implică hidrogen și oxigen—peroxidul de hidrogen, H2O2:
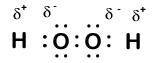
în peroxidul de hidrogen, fiecare hidrogen are încă un număr de oxidare de +1, deoarece fiecare hidrogen „renunță” la un singur electron oxigenului. Cu toate acestea, oxigenul are acum un număr de oxidare de -1, deoarece fiecare oxigen câștigă doar un electron din hidrogenul său vecin. Electronii dintre cei doi atomi de oxigen identici sunt împărțiți în mod egal, deci nu există o sarcină parțială rezultată din acea legătură.
număr de oxidare
un număr pozitiv sau negativ atribuit unui atom dintr-o moleculă sau ion care reflectă un câștig parțial sau o pierdere de electroni.
cunoașterea numărului de oxidare al fiecărui element individual dintr-o moleculă va fi un pas cheie în înțelegerea reacțiilor redox. Din fericire, nu va implica, de obicei, desen diagrame punct de electroni. În schimb, există o serie de reguli pe care le putem folosi pentru a determina numerele de oxidare. Iată principalele reguli:
| numărul de oxidare al unui element pur (de la sine, și nu un ion) este zero. |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
The oxidation number of a monatomic ion (by itself or as part of an ionic compound) is equal pentru sarcina sa. metalele alcaline—elemente din prima coloană a tabelului periodic—vor avea întotdeauna un număr de oxidare de +1; metalele alcalino-pământoase (coloana 2) sunt aproape întotdeauna +2. |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| The oxidation number of hydrogen is almost always +1 when it is in a compound. |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
numărul de oxidare al oxigenului este aproape întotdeauna -2 când este într-un compus. excepțiile:
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
suma numerelor de oxidare dintr-un compus este zero. pentru a determina numărul de oxidare al Mn în Mn2O7, trebuie să lucrăm înapoi:
-2 7 atomi = -14 total deoarece suma numerelor de oxidare trebuie să fie zero, numărul total de oxidare al Mn trebuie să fie +14 pentru a anula oxigenul -14, dar din moment ce există 2 mn atomi, fiecare atom individual va avea un număr de oxidare de + 7:
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
suma numerelor de oxidare dintr-un ion poliatomic este egală cu sarcina pe acel ion. din nou, lucrați înapoi pentru a determina numărul de oxidare al oricărui atom non-oxigen sau non-hidrogen. pentru a determina numărul de oxidare al Cr în Cr2O72 -:
-2 7 = -14
+12 + (-14) = -2
= +7
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
It is important de reținut că numărul de oxidare se referă întotdeauna la fiecare atom individual din compus, nu la totalul acelui element.
de exemplu, în H2O, „sarcina” pozitivă totală pentru ambii atomi de hidrogen va fi +2 (care se echilibrează cu -2 din oxigen), dar fiecare hidrogen are un număr de oxidare de +1.
contribuții & atribuții
această pagină a fost construită din conținut prin intermediul următorilor colaboratori și editată (local sau extensiv) de către echipa de dezvoltare a libretelor pentru a satisface stilul, prezentarea și calitatea platformei:Fundația CK-12 de Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson și Jean Dupon.