obiective de învățare
- utilizați notația celulară pentru a descrie celulele galvanice
- descrieți componentele de bază ale celulelor galvanice\
celulele galvanice, cunoscute și sub numele de celule voltaice, sunt celule electrochimice în care reacțiile spontane de reducere a oxidării produc energie electrică. În scrierea ecuațiilor, este adesea convenabil să se separe reacțiile de oxidare-reducere în jumătăți de reacții pentru a facilita echilibrarea ecuației generale și pentru a sublinia transformările chimice reale.
luați în considerare ce se întâmplă atunci când o bucată curată de metal de cupru este plasată într-o soluție de azotat de argint (figura \(\PageIndex{1}\)). De îndată ce se adaugă metalul de cupru, metalul de argint începe să se formeze și ionii de cupru trec în soluție. Culoarea albastră a soluției din extrema dreaptă indică prezența ionilor de cupru. Reacția poate fi împărțită în cele două jumătăți de reacție. Semi-reacțiile separă oxidarea de reducere, astfel încât fiecare poate fi luată în considerare individual.
ecuația pentru jumătatea reacției de reducere a trebuit să fie dublată, astfel încât numărul de electroni „câștigați” în jumătatea reacției de reducere a egalat numărul de electroni „pierduți” în jumătatea reacției de oxidare.

celulele galvanice sau voltaice implică reacții electrochimice spontane în care jumătățile de reacții sunt separate (figura \(\PageIndex{2}\)) astfel încât curentul să poată curge printr-un fir extern. Paharul din partea stângă a figurii se numește jumătate de celulă și conține o soluție de 1 M de azotat de cupru(II) cu o bucată de metal de cupru parțial scufundată în soluție. Metalul de cupru este un electrod. Cuprul este supus oxidării; prin urmare, electrodul de cupru este anodul. Anodul este conectat la un voltmetru cu un fir, iar celălalt terminal al voltmetrului este conectat la un electrod de argint printr-un fir. Argintul este în curs de reducere; prin urmare, electrodul de argint este catodul. Jumătatea celulei din partea dreaptă a figurii constă din electrodul de argint într-o soluție de azotat de argint de 1 M (AgNO3). În acest moment, nu curge curent—adică nu se produce nicio mișcare semnificativă a electronilor prin fir, deoarece circuitul este deschis. Circuitul este închis folosind o punte de sare, care transmite CURENTUL cu ioni în mișcare. Puntea de sare constă dintr-o soluție electrolitică concentrată, nereactivă, cum ar fi soluția de azotat de sodiu (NaNO3) utilizată în acest exemplu. Pe măsură ce electronii curg de la stânga la dreapta prin electrod și sârmă, ionii de nitrați (anioni) trec prin dopul poros din stânga în soluția de nitrat de cupru(II). Acest lucru menține paharul din stânga neutru electric prin neutralizarea sarcinii pe ionii de cupru (II) care sunt produși în soluție pe măsură ce metalul de cupru este oxidat. În același timp, ionii de nitrați se deplasează spre stânga, ionii de sodiu (cationii) se deplasează spre dreapta, prin dopul poros și în soluția de azotat de argint din dreapta. Acești cationi adăugați „înlocuiesc” ionii de argint care sunt îndepărtați din soluție, deoarece au fost reduși la metal argintiu, menținând paharul pe dreapta neutru din punct de vedere electric. Fără podul de sare, compartimentele nu ar rămâne neutre din punct de vedere electric și nu ar curge curent semnificativ. Cu toate acestea, dacă cele două compartimente sunt în contact direct, nu este necesară o punte de sare. În momentul în care circuitul este finalizat, voltmetrul citește +0,46 V, acesta se numește potențialul celulei. Potențialul celular este creat atunci când cele două metale diferite sunt conectate și este o măsură a energiei pe unitate de încărcare disponibilă din reacția de reducere a oxidării. Voltul este unitatea si derivată pentru potențialul electric
\
În această ecuație, a este curentul în amperi și C sarcina în coulombi. Rețineți că volții trebuie înmulțiți cu sarcina în coulombi (C) pentru a obține energia în jouli (J).
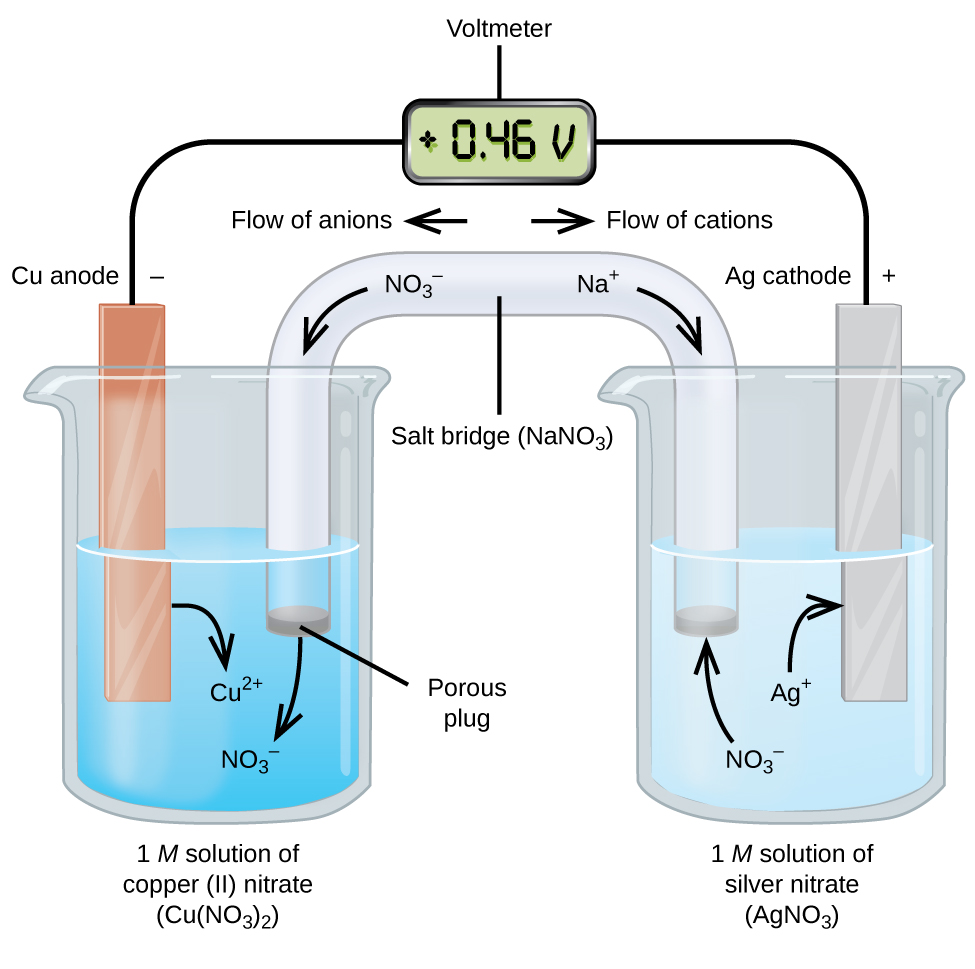
când celula electrochimică este construită în acest mod, un potențial pozitiv al celulei indică o reacție spontană și că electronii curg de la stânga la dreapta. Se întâmplă multe în figura \(\PageIndex{2}\), deci este util să rezumăm lucrurile pentru acest sistem:
- electronii curg de la anod la catod: de la stânga la dreapta în celula galvanică standard din figură.
- electrodul din jumătatea celulei stângi este anodul, deoarece oxidarea are loc aici. Numele se referă la fluxul de anioni în podul de sare spre el.
- electrodul din jumătatea celulei drepte este catodul, deoarece reducerea are loc aici. Numele se referă la fluxul de cationi din podul de sare spre el.
- oxidarea are loc la anod (jumătatea stângă a celulei din figură).
- reducerea are loc la catod (jumătatea dreaptă a celulei din figură).
- potențialul celular, + 0,46 V, în acest caz, rezultă din diferențele inerente în natura materialelor utilizate pentru a face cele două jumătăți de celule.
- puntea de sare trebuie să fie prezentă pentru a închide (completa) circuitul și trebuie să apară atât o oxidare, cât și o reducere pentru ca curentul să curgă.
există multe celule galvanice posibile, deci o notație prescurtată este de obicei folosită pentru a le descrie. Notația celulară (uneori numită diagramă celulară) oferă informații despre diferitele specii implicate în reacție. Această notație funcționează și pentru alte tipuri de celule. O linie verticala, de la un capăt la altul și o linie dublă, de la un capăt la altul, de la un capăt la altul, de la un capăt la altul, de la un capăt la altul. Informațiile despre anod sunt scrise în stânga, urmate de soluția anodică, apoi puntea de sare (când este prezentă), apoi soluția catodică și, în final, informații despre catod la dreapta. Notația celulară pentru celula galvanică din Figura \(\PageIndex{2}\) este apoi
\
rețineți că ionii spectatorilor nu sunt incluși și că a fost utilizată cea mai simplă formă a fiecărei jumătăți de reacție. Când sunt cunoscute, concentrațiile inițiale ale diferiților ioni sunt de obicei incluse.
una dintre cele mai simple celule este celula Daniell. Este posibil să construiți această baterie plasând un electrod de cupru în partea de jos a unui borcan și acoperind metalul cu o soluție de sulfat de cupru. O soluție de sulfat de zinc este plutită deasupra soluției de sulfat de cupru; apoi un electrod de zinc este plasat în soluția de sulfat de zinc. Conectarea electrodului de cupru la electrodul de zinc permite curgerea unui curent electric. Acesta este un exemplu de celulă fără punte de sare, iar ionii pot curge prin interfața dintre cele două soluții.
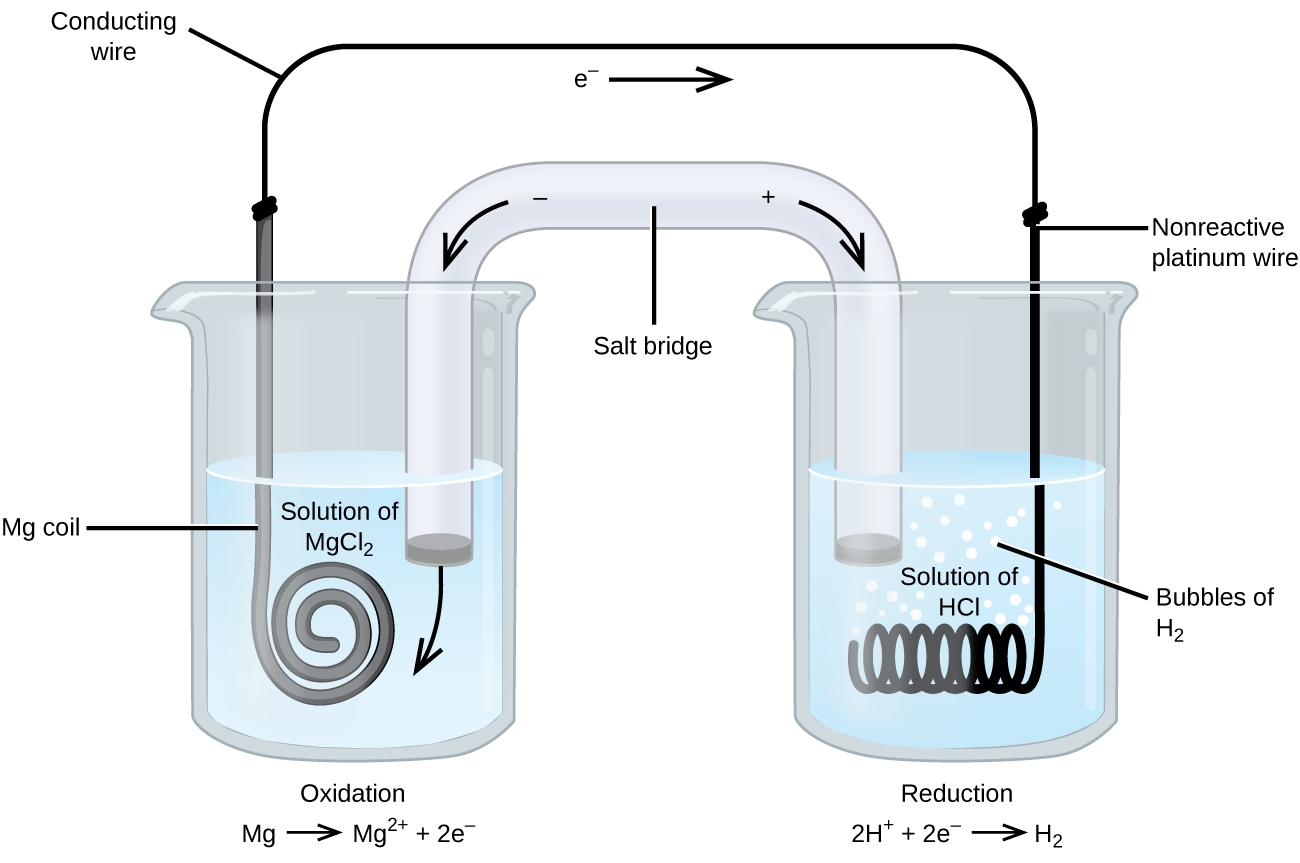
unele reacții de oxidare-reducere implică specii care sunt conductori slabi ai electricității și astfel se folosește un electrod care nu participă la reacții. Frecvent, electrodul este platină, aur sau grafit, toate fiind inerte la multe reacții chimice. Un astfel de sistem este prezentat în figura \(\PageIndex{3}\). Magneziul suferă oxidare la anodul din stânga în figură, iar ionii de hidrogen suferă reducere la catodul din dreapta. Reacția poate fi rezumată ca
celula a folosit un fir inert de platină pentru catod, deci notația celulei este
electrodul de magneziu este un electrod activ deoarece participă la reacția de reducere a oxidării. Electrozii inerți, cum ar fi electrodul de platină din Figura \(\PageIndex{3}\), nu participă la reacția de oxidare-reducere și sunt prezenți astfel încât curentul să poată curge prin celulă. Platina sau aurul fac, în general, electrozi inerți buni, deoarece sunt nereactivi din punct de vedere chimic.
Example \(\PageIndex{1}\): folosind notația celulară
luați în considerare o celulă galvanică formată din
\
scrieți jumătățile de reacție de oxidare și reducere și scrieți reacția folosind notația celulară. Ce reacție are loc la anod? Catodul?
soluție
prin inspecție, Cr este oxidat atunci când trei electroni se pierd pentru a forma Cr3+, iar Cu2+ este redus pe măsură ce câștigă doi electroni pentru a forma Cu. Echilibrarea sarcinii dă
\
notația celulară folosește cea mai simplă formă a fiecăreia dintre ecuații și începe cu reacția la anod. Nu au fost specificate concentrații astfel:
\
oxidarea are loc la anod și reducerea la catod.
Example \(\PageIndex{2}\): folosind notația celulară
luați în considerare o celulă galvanică formată din
scrieți jumătățile de reacție de oxidare și reducere și scrieți reacția folosind notația celulară. Ce reacție are loc la anod? Catodul?
soluție
prin inspecție, Fe2+ suferă oxidare atunci când un electron este pierdut pentru a forma Fe3+, iar MnO4− este redus pe măsură ce câștigă cinci electroni pentru a forma Mn2+. Echilibrarea sarcinii dă
\
notația celulară folosește cea mai simplă formă a fiecăreia dintre ecuații și începe cu reacția la anod. Este necesar să se utilizeze un electrod inert, cum ar fi platina, deoarece nu există metal prezent pentru a conduce electronii de la anod la catod. Nu au fost specificate concentrații astfel:
\
oxidarea are loc la anod și reducerea la catod.
Exercise \(\PageIndex{1}\)
utilizați notația celulară pentru a descrie celula galvanică în care ionii de cupru(II) sunt reduși la metalul de cupru și metalul de zinc este oxidat la ionii de zinc.
răspuns
Din informațiile date în problemă:
\
folosind notația celulară:
\
rezumat
celulele electrochimice constau de obicei din două jumătăți de celule. Jumătățile de celule separă jumătatea reacției de oxidare de jumătatea reacției de reducere și fac posibilă curgerea curentului printr-un fir extern. O jumătate de celulă, descrisă în mod normal pe partea stângă într-o figură, conține anodul. Oxidarea are loc la anod. Anodul este conectat la catod în cealaltă jumătate de celulă, adesea prezentat în partea dreaptă într-o figură. Reducerea are loc la catod. Adăugarea unei punți de sare completează circuitul permițând curgerea curentului. Anionii din podul de sare curg spre anod și cationii din podul de sare curg spre catod. Mișcarea acestor ioni completează circuitul și menține fiecare jumătate de celulă neutră din punct de vedere electric. Celulele electrochimice pot fi descrise folosind notația celulară. În această notație, în stânga apar informații despre reacția la anod și informații despre reacția la catod în dreapta. Podul de sare este reprezentat printr-o linie dublă, de la nr. Fazele solide, lichide sau apoase dintr-o semicelulă sunt separate printr-o singură linie, de la un capăt la altul. Faza și concentrația diferitelor specii sunt incluse după denumirea speciei. Electrozii care participă la reacția de oxidare-reducere se numesc electrozi activi. Electrozii care nu participă la reacția de oxidare-reducere, dar sunt acolo pentru a permite curgerea curentului sunt electrozi inerți. Electrozii inerți sunt adesea fabricați din platină sau aur, care sunt neschimbate de multe reacții chimice.
Glosar
electrod activ electrod care participă la reacția de oxidare-reducere a unei celule electrochimice; masa unui electrod activ se schimbă în timpul reacției de oxidare-reducere electrod anod într-o celulă electrochimică la care are loc oxidarea; informațiile despre anod sunt înregistrate în partea stângă a podului de sare în notația celulară electrod catodic într-o celulă electrochimică la care are loc reducerea; informațiile despre catod sunt înregistrate în partea dreaptă a podului de sare în notația celulară notația celulară mod prescurtat de a reprezenta reacțiile într-o diferență de potențial a celulei celulare electrochimice în potențialul electric care apare atunci când; forța motrice pentru fluxul de sarcină (Curent) în reacțiile de oxidare-reducere celulă galvanică celulă electrochimică care implică o reacție spontană de reducere a oxidării; celule electrochimice cu potențiale celulare pozitive; numit și electrod inert cu celule voltaice care permite curgerea curentului, dar care nu participă altfel la reacția de reducere a oxidării într-o celulă electrochimică; masa unui electrod inert nu se modifică în timpul; electrozii inerți sunt adesea fabricați din platină sau aur, deoarece aceste metale sunt nereactive din punct de vedere chimic. celula voltaică un alt nume pentru o celulă galvanică
colaboratori și atribuții
-
Paul Flowers (Universitatea din Carolina de Nord – Pembroke), Klaus Theopold (Universitatea din Delaware) și Richard Langley (Universitatea de stat Stephen F. Austin) cu autori care contribuie. Conținutul manualului produs de OpenStax College este licențiat sub licența Creative Commons Attribution License 4.0. Descărcați gratuit la http://cnx.org/contents/85abf193-2bd…[email protected]).