U. S. Pharm. 2008; 33(4) (supliment Oncologic):20-30. rezumat: aproximativ 75% dintre femeile aflate în postmenopauză cu cancer de sân au o boală cu receptori hormonali pozitivi (HR+).1 tamoxifenul a fost standardul terapiei pentru cancerul de sân HR+ la femeile aflate în postmenopauză până la apariția inhibitorilor selectivi de aromatază de a treia generație, care sunt anastrozol, Letrozol și exemestan.3,4 acești agenți au demonstrat o supraviețuire superioară fără boală în studiile clinice comparativ cu tamoxifenul, dar beneficiul lor atunci când este utilizat mai mult de cinci ani la femeile aflate în postmenopauză cu cancer de sân HR+ nu a fost stabilit.3,4
s – a estimat că trei sferturi dintre femeile aflate în postmenopauză cu cancer de sân au o boală cu receptori hormonali pozitivi (HR+).1 Tamoxifen-un modulator selectiv al receptorilor de estrogen cu efecte estrogenice asupra osului, țesutului endometrial și lipidelor și anti!= efecte estrogenice asupra țesutului mamar-a fost terapia standard pentru cancerul de sân HR+ la femeile aflate în postmenopauză până la introducerea inhibitorilor selectivi de aromatază de generația a treia (AIs).2-4 acești agenți-anastrozol, Letrozol și exemestan-au demonstrat o supraviețuire superioară fără boală (DFS) comparativ cu tamoxifenul în studiile clinice.3,4 efectele Adverse asociate cu utilizarea tamoxifenului-cancerul endometrial,complicațiile tromboembolice și rezistența la tamoxifen-au încurajat dezvoltarea terapiilor cu un mecanism diferit de acțiune, cum ar fi AIs.2
a se vedea tabelul 1 pentru un rezumat al informațiilor importante despre AIs de generația a treia.
context
chirurgul scoțian George Beatson a descris contribuția hormonală a estrogenilor la carcinogeneză în raport cu cancerul de sân în 1896.5 Beatson a recunoscut că îndepărtarea ovarelor (ovarectomie) a fost benefică la femeile cu cancer cancer de sân inoperabil.5 această stare indusă chirurgical de deprivare a estrogenului a contribuit la inhibarea creșterii tumorale în celulele cancerului de sân la femeile cu boală HR+.5
Aminoglutetimida, formulată inițial ca agent anticonvulsivant, a fost prima ia nespecifică promovată inițial la sfârșitul anilor 1970 ca agent de linia a doua după tamoxifen pentru femeile aflate în postmenopauză cu cancer de sân HR+ avansat.6 efectele secundare toxice, cum ar fi supresia suprarenală și necesitatea terapiei cu steroizi, au dus la retragerea aminoglutetimidei de pe piață.6 la femeile aflate în postmenopauză cu cancer de sân HR+ în stadiu incipient și târziu, AIs de generația a treia demonstrează un profil de toxicitate mai bun, o selectivitate mai mare, o potență mai mare și o eficacitate clinică îmbunătățită în comparație cu agenții mai în vârstă. 6
Clasificare4,7
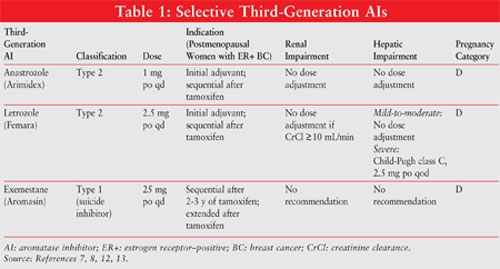
ai sunt clasificate ca inhibitori steroidieni de tip 1 (necompetitivi, ireversibili) sau nesteroidieni de tip 2 (competitivi, reversibili). Exemestanul, un inhibitor de tip 1, se leagă ireversibil de locul moleculei de aromatază și este cunoscut sub numele de inhibitor de suicid. Inhibitorii de tip 2 anastrozol și Letrozol se leagă reversibil de aromatază. A se vedea figura 1 pentru structurile chimice ale diferitelor AIs.
mecanism de acțiune
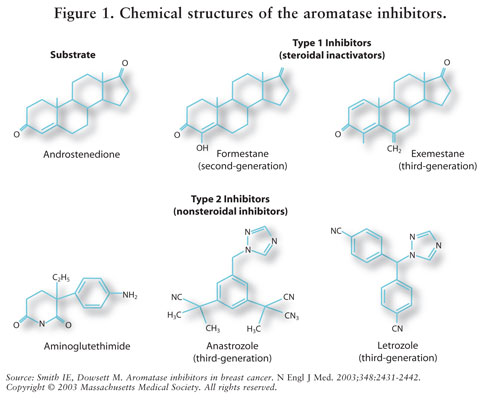
sinteza estrogenului este mediată de enzima aromatază.7 aromataza transformă androstendiona și testosteronul în estronă și estradiol.5,7 AIs reduc estrogenul la femeile aflate în postmenopauză, inhibând astfel efectul său cancerigen asupra țesutului mamar.7 deoarece ovarele femeilor aflate în premenopauză încă funcționează, AIs nu sunt indicate pentru această populație în afara studiilor clinice; la aceste femei, AIs ar stimula hipotalamusul și hipofiza să crească producția de gonadotropine.4 A se vedea figura 2.
Toxicități6,8
efectele Adverse ale AIs includ disfuncții cardiovasculare, cum ar fi hipertensiunea, vasodilatația, edemul, și dureri în piept. Sunt necesare studii suplimentare pentru a evalua efectul complet al AIs asupra funcției cardiace. Pacienții pot prezenta scăderea densității minerale osoase( DMO), risc crescut de fractură, simptome vasomotorii, uscăciune vaginală, dureri musculo-scheletice, cefalee, insomnie, depresie, tuse crescută, dispnee, disconfort gastro-intestinal, creștere în greutate și, eventual, niveluri ridicate de lipide. Pierderea osoasă este un efect secundar predominant; bifosfonații, cum ar fi acidul zoledronic, au fost utilizați pentru a-l contracara. Pacienții cu AIs trebuie să primească suplimente de vitamina D și calciu. Efectele adverse prelungite și efectele asupra funcției cognitive din terapia cu AI nu au fost încă determinate.9 AIs sunt contraindicate la femeile gravide.
interacțiuni medicamentoase
Anastrozolul inhibă CYP1A2, CYP2C9 și CYP3A4.10,11 letrozolul este metabolizat de CYP2A6 și CYP2C19, iar exemestanul metabolizează inductorii CYP3A4.8,10-13 ai CYP3A4, cum ar fi rifampicina, fenitoina, carbamazepina și sunătoarea pot determina o scădere a nivelurilor de exemestan atunci când sunt administrate concomitent. 8,12,13 Tamoxifenul determină o scădere cu 38% a letrozolului și o scădere cu 27% a anastrozolului atunci când este administrat concomitent.2,7,8,14
indicații și dozare
Anastrozol 10,11: Anastrozol 1 mg o dată pe zi este indicat pentru cancerul de sân precoce ca terapie adjuvantă inițială la femeile aflate în postmenopauză cu boală sensibilă hormonal și ca primă linie pentru HR+ sau HR-boală metastatică necunoscută sau avansată local. De asemenea, este aprobat pentru utilizare după terapia cu tamoxifen la femeile cu boală progresivă. Nu este necesară ajustarea dozei pentru insuficiența renală sau insuficiența hepatică ușoară până la moderată.
Letrozol11,12: Letrozol 2.5 mg o dată pe zi este indicat pentru femeile aflate în postmenopauză cu cancer de sân în stadiu incipient HR+ ca terapie inițială sau ca terapie adjuvantă extinsă după tamoxifen. De asemenea, este indicat pentru HR+ sau HR-boală metastatică necunoscută. Se recomandă ajustarea dozei pentru insuficiența hepatică severă.
Exemestan11,14: Exemestan 25 mg po o dată pe zi este indicat ca terapie adjuvantă la doi până la trei ani după tamoxifen pentru femeile aflate în postmenopauză cu cancer mamar precoce HR+, pentru un total de cinci ani consecutivi de terapie hormonală. De asemenea, poate fi utilizat pentru boala care a progresat după terapia cu tamoxifen. Ar trebui să fie luate după o masă. Ajustarea dozei nu este necesară pentru insuficiența hepatică sau renală
studiile clinice
toxicitatea legată de Tamoxifen, cum ar fi cancerul endometrial, au determinat inițierea studiilor clinice la scară largă care investighează utilizarea AIs de generația a treia la femeile aflate în postmenopauză cu cancer de sân HR+. Diferite modele de studiu au fost utilizate pentru a evalua performanța acestor agenți în comparație cu tamoxifen.6 rezultate superioare în ceea ce privește eficacitatea clinică și profilurile de toxicitate au stabilit AIs ca un nou standard de terapie adjuvantă la femeile aflate în postmenopauză cu cancer de sân HR+.6
ATAC15: ATAC (Arimidex, Tamoxifen singur sau în combinație), un studiu multicentric, randomizat, dublu-orb, a comparat trei brațe de tratament: tamoxifen 20 mg + anastrozol placebo, anastrozol 1 mg + tamoxifen placebo și o combinație de tamoxifen 20 mg + anastrozol 1 mg. Obiectivul principal a fost evaluarea siguranței și eficacității tamoxifenului față de anastrozol și a combinației de anastrozol și tamoxifen pe parcursul a cinci ani. Un total de 9.366 de pacienți-3.125 în brațul cu anastrozol, 3.116 în brațul cu tamoxifen și 3.125 în brațul cu Asociere-au fost tratați pentru o perioadă mediană de 33 de luni.
după trei ani, Anastrozolul a demonstrat DFS de 89,4% față de 87,4% pentru tamoxifen (risc relativ 0,83, IÎ 95%, P =.013). Anastrozolul a scăzut rata cancerului de sân contralateral (CLBC) comparativ cu tamoxifenul (raportul de șanse 0,42, IÎ 95%, P =.007). Brațul asociat a fost închis deoarece nu s-a găsit niciun beneficiu clinic dincolo de tamoxifen. Anastrozolul a fost asociat cu efecte adverse, cum ar fi cancerul endometrial (P =.02), sângerare vaginală, descărcare (P <.0001), evenimente cerebrovasculare (P =.0006), evenimente tromboembolice venoase (P =.0006) și bufeuri (P <.0001); tamoxifenul a fost asociat cu mai puține fracturi și mai puține dureri articulare (P <.0001). După 68 de luni, Anastrozolul a crescut SFD (RR 0,87, IÎ 95%, P =.01) și timpul până la recurență (RR 0, 79 , IÎ 95%, P =.0005) și scăderea metastazelor la distanță (RR 0, 86 , IÎ 95%, P =.04) și CLBC (42% scădere, P =.01).16 după un interval median de urmărire de 100 de luni, pacienții cu RR+ tratați cu anastrozol au demonstrat îmbunătățiri ale SFD (RR 0,85; P =.003), apariția CLBC (RR 0,60, P =.004), timp până la recurență (HR 0,76, P =.0001) și timpul până la recurența la distanță (HR 0,84, P=.022) comparativ cu pacienții tratați cu tamoxifen. Diferența absolută a ratelor de recurență s-a îmbunătățit de la 2.8% după cinci ani până la 4,8% după nouă ani. Ratele fracturilor de anastrozol au fost mai mari în timpul tratamentului, dar diferența a scăzut substanțial după perioada de urmărire de 100 de luni. Perioada de terapie prelungită a avut un risc de fractură de 1, 15 cu anastrozol față de 1, 02 cu tamoxifen. Riscul de cancer endometrial a fost redus la și în afara terapiei cu anastrozol comparativ cu tamoxifen, cu o rată anuală de 0, 043 față de 0, 14 și, respectiv, 0, 014 față de 0, 12. Nu a fost identificată o diferență în supraviețuirea globală (SG).
MA.1712,17: MA.17 a fost un studiu randomizat, controlat cu placebo, dublu-orb, care a evaluat eficacitatea a cinci ani de terapie cu letrozol la femeile aflate în postmenopauză cu cancer de sân care au finalizat deja cinci ani de terapie adjuvantă cu tamoxifen. Pacienții au primit Letrozol 2,5 mg sau placebo zilnic timp de cinci ani. Obiectivul principal a fost DFS; obiectivele secundare au fost calitatea vieții, profilul de siguranță extins și SG. Din cei 5187 de pacienți, 2593 au primit Letrozol și 2594 au primit placebo; perioada mediană de urmărire a fost de 2,4 ani.
în analiza preliminară au existat 207 recurențe locale sau metastatice ale cancerului de sân sau malignități inițiale ale CLBC, 75 în grupul Letrozol și 132 în grupul placebo. Ratele preconizate de patru ani ale DFS pentru cele două grupuri au fost de 93% și, respectiv, 87% (P ?.001 pentru evaluarea DFS). În brațul cu letrozol, DFS a avut o RR de 0 , 61 (IÎ 95%, P ?.001). Letrozolul a demonstrat o scădere cu 43% a incidenței cancerului de sân (RR 0, 57 , IÎ 95%, P =.00008).4 cu excepția pacienților cu noduri pozitive (P =.04), OS nu a atins semnificația statistică (HR 0,82, P=.30).4 pacienți din brațul cu letrozol au prezentat simptome vasomotorii de grad scăzut, mialgie și artrită. Osteoporoza a fost mai frecventă (deși nu semnificativ) în brațul cu letrozol comparativ cu placebo (5,8% față de 4,5%; P =.07), iar ratele fracturilor au fost comparabile între brațe. Studiul a fost închis după o medie de 2,4 ani din cauza scăderii evenimentelor de cancer mamar în brațul Letrozol. Terapia adjuvantă extinsă cu letrozol după terminarea a cinci ani de tamoxifen a îmbunătățit DFS.
BIG 1-987,9,18: studiul Breast international Group (BIG) 1-98, un studiu dublu-orb, multicentric, randomizat, a înrolat 8.028 de femei aflate în postmenopauză cu cancer de sân în stadiu incipient HR+. Studiul a cuprins patru brațe de tratament care au evaluat cinci ani de monoterapie cu tamoxifen, cinci ani de monoterapie cu letrozol, tamoxifen timp de doi ani, apoi o trecere la Letrozol timp de trei ani sau Letrozol timp de doi ani, apoi o trecere la tamoxifen timp de trei ani. Obiectivul principal a fost DFS; obiectivele secundare au fost timpul până la metastaze îndepărtate, siguranță și OS. SFD a crescut la pacienții cărora li s-a administrat Letrozol comparativ cu cei cărora li s-a administrat tamoxifen (RR 0,81, IÎ 95%, reducere relativă 19%, P =.003), cu o diferență absolută de 1,5% la trei ani. Tamoxifenul a crescut apariția evenimentelor tromboembolice comparativ cu letrozolul (OR 0, 38, P <.0001). Fracturile osoase au fost crescute în brațul Letrozol (sau 1, 44, P =.006).
IES14, 19: IES (studiul intergrup Exemestan) a fost un studiu randomizat, dublu-orb, multicentric, de fază III, al cărui obiectiv a fost de a determina dacă trecerea la exemestan după doi până la trei ani de tamoxifen a fost mai eficientă decât continuarea tamoxifenului timp de cinci ani. Studiul a înrolat 4.742 de femei în postmenopauză randomizate în două brațe de tratament; 2.362 de subiecți au fost programați să treacă la exemestan 25 mg po qd după doi până la trei ani de tamoxifen 20 mg po qd pentru a finaliza cinci ani de terapie, iar restul de 2.380 au fost programați să primească tamoxifen 20 mg po qd timp de cinci ani. Criteriul final principal a fost DFS; criteriile finale secundare au fost SG, profilul extins de toxicitate și frecvența CLBC.
evenimentele Adverse, care au apărut pe o perioadă mediană de 30, 6 luni, au inclus frecvența CLBC, recurența locală sau metastatică și decesul. Au fost 449 de evenimente-183 în brațul exemestan și 266 în brațul tamoxifen. Brațul exemestan a avut o RR neajustată de 0,68 (IÎ 95%, P <.001 prin testul log-rank), care a demonstrat o scădere cu 32% a riscului și a fost analog cu un avantaj în DFS de 4.75 (IÎ 95%) la trei ani. După trei ani, brațul exemestan a avut un DFS de 91,5% (IÎ 95%) comparativ cu 86,8% (IÎ 95%) în brațul tamoxifen. Nu a existat nicio diferență semnificativă în OS între cele două grupuri, cu 93 de decese în brațul exemestan și 106 decese în brațul tamoxifen. A existat o diferență semnificativă în frecvența CLBC (P =.04) — 20 subiecți în brațul tamoxifen și nouă în brațul exemestan. Utilizarea exemestanului pentru a finaliza cei cinci ani de tratament după doi până la trei ani de tamoxifen a îmbunătățit DFS comparativ cu cinci ani de tamoxifen.
prevenirea pierderii osoase din terapia cu AI20
femeile aflate în postmenopauză sunt predispuse la dezvoltarea DMO scăzută din cauza nivelurilor reduse de estrogen. Terapia cu AI la pacientul cu cancer de sân în postmenopauză exacerbează această tendință. Denosumab, un anticorp investigațional monoclonal complet uman, leagă activatorul receptorilor pentru factorul nuclear kB ligand (RANKL) și previne activitatea RANKL. RANKL este vital pentru activitatea osteoclastică, ceea ce înseamnă defalcarea osului. Denosumab și risedronat, un bifosfonat, sunt evaluate pentru capacitatea lor de a contracara pierderea osoasă asociată cu terapia cu AI.
studiul Denosumab20: un studiu multicentric, randomizat, de fază III, a evaluat utilizarea denosumab 60 mg administrat subcutanat o dată la șase luni la femeile aflate în postmenopauză care iau AIs pentru HR+ cancer de sân nemetastatic. Obiectivul a fost de a evalua modificarea DMO a coloanei lombare de la momentul inițial la 12 luni. Dintre cei 252 de pacienți, 127 au fost repartizați la denosumab și 125 au fost repartizați la placebo. Ambele brațe au primit calciu și vitamina D. BMD a fost evaluată prin absorbție cu raze X cu energie dublă. După 12 și 24 de luni de tratament cu denosumab sau placebo, a existat o diferență de 5,5% și, respectiv, 7,6% în creșterea DMO în regiunea lombară a coloanei vertebrale în favoarea denosumabului (P <.0001 Pentru ambele luni). Denosumab a demonstrat un profil de toxicitate comparabil față de placebo. Tratamentul cu Denosumab pentru mai mult de 24 de luni nu a fost încă evaluat.
Sub-studiul oaselor IBIS-II 21: Studiul internațional de intervenție asupra cancerului de sân-II (IBIS-II) a fost derivat din IBIS-II, care a evaluat femeile aflate în postmenopauză cu o probabilitate crescută de a dezvolta cancer de sân care au fost randomizate la anastrozol sau placebo timp de cinci ani. Substudiul, cu un număr actual de 700 de pacienți, evaluează risedronat comparativ cu placebo pentru prevenirea pierderii DMO la femeile cu scoruri t scăzute la momentul inițial. Un subgrup de pacienți din studiul IBIS-II au fost repartizați la una din cele trei strategii de tratament diferite din sub-studiu. După un an de tratament, 350 de pacienți cu anastrozol și 350 de pacienți placebo din IBIS-II au primit rezultate substudiale. Stratul 1 a cuprins 227 de pacienți pe anastrozol cu scoruri t normale (scor T ?1), stratum 2 a cuprins 80 de pacienți cu osteopenie (inqut2.5 ? T-score <1) cărora li s-a administrat risedronat 35 mg o dată pe săptămână sau placebo, iar stratum 3 a cuprins 43 de pacienți cu osteoporoză (inkt4 <scor T <2, 5) cărora li s-a administrat risedronat 35 mg o dată pe săptămână.
pentru pacienții cu osteopenie sau osteoporoză la momentul inițial, risedronatul pare să inhibe pierderea osoasă asociată cu Anastrozolul. În stratul II, risedronatul a demonstrat efecte favorabile asupra conservării DMO pentru șoldul total, dar nu și pentru coloana lombară (P =.005 și P =.15, respectiv, comparativ cu placebo). Nu au fost asociate efecte adverse grave sau interacțiuni medicamentoase cu risedronat.
studiul AIs la femeile aflate în premenopauză (SOFT)21-26
aproximativ 33% dintre femeile cu vârsta sub 50 de ani vor fi diagnosticate cu cancer mamar invaziv. 22 studiul supresia funcției ovariene (SOFT, IBCSG 24-02, BIG 2-02) investighează utilizarea terapiei AI la femeile aflate în premenopauză cu cancer de sân HR+. Studiul, care are o înrolare țintită a pacienților de 3.000, implică femeile aflate în premenopauză cu cancer de sân HR + care au terminat chimioterapia sau care au primit doar o intervenție chirurgicală. Ablația ovariană se stabilește prin administrarea de triptorelin (un hormon care eliberează gonadotropină) o dată pe lună timp de cinci ani, ovarectomie chirurgicală sau iradiere pelviană. Pacienții vor fi randomizați într-unul din cele trei brațe, primul braț primind tamoxifen o dată pe zi timp de cinci ani, al doilea braț primind tamoxifen timp de cinci ani în combinație cu ablația ovariană, iar al treilea braț primind exemestan timp de cinci ani în combinație cu ablația ovariană. Pacienții vor primi exemestan sau tamoxifen timp de cinci ani.
teste de Chimioprevenție23-27
Tamoxifenul este indicat pentru chemoprevenția cancerului de sân.6 profilul său de toxicitate este o cauză de constrângere în ceea ce privește utilizarea terapeutică.6 AIs poate reduce incidența cancerului de sân HR+ la pacienții cu risc crescut din cauza scăderii incidenței CLBC comparativ cu tamoxifenul în studiile clinice, cum ar fi ATAC.6
studiile de chemoprevenție AI includ studiul International Breast Cancer Study Group (IBCSG) 31-03 (IBCSG 31-03) și Harta Institutului Național al Cancerului din Canada.3 proces. Obiectivul principal al studiului IBCSG 31-03 multicentric, internațional, randomizat, controlat cu placebo este de a evalua utilizarea anastrozolului pentru prevenirea cancerului de sân la femeile aflate în postmenopauză. Măsura principală a rezultatului său este incidența cancerului de sân invaziv și neinvaziv; măsura secundară a rezultatului este incidența osteoporozei și a fracturilor.5 Procesul IBCSG 31-03 are o înscriere țintă de 6.000. Harta.3 studiul evaluează exemestanul ca agent chemopreventiv la femeile aflate în postmenopauză. Obiectivul principal al MAP controlat cu placebo.3 Studiul este de a evalua eficacitatea exemestanului în scăderea incidenței cancerului de sân invaziv.
utilizări viitoare potențiale: rapoarte de caz
letrozolul a fost utilizat după eșecul clomifenului de a induce fertilitatea la 22 de femei cu sindromul ovarului polichistic. Letrozolul a indus ovulația în 75% din cicluri față de 44,4% din ciclurile induse de clomifen. Patru sarcini au rezultat din ovulațiile induse de Letrozol și nu au fost asociate efecte adverse semnificative cu letrozolul.28,29
o femeie obeză de 57 de ani cu endometrioză în urma histerectomiei și salpingo-ooforectomiei bilaterale a primit anastrozol după terapia cu megestrol. Pacientul nu a avut leziuni endometriale după nouă luni.28,30
un pacient cu sindromul McCune-Albright a primit anastrozol pentru pubertate prematură; estradiolul pacientului s-a normalizat după 2,5 ani de anastrozol și vârsta osoasă a avansat cu șase luni.28,31 creșterea estrogenului poate induce ginecomastia și hipogonadismul hipogonadotropic.28,31 scăderea estrogenului cu AI a dus la gonadotropină normală și testosteron la bărbații cu ginecomastie și hipogonadism hipogonadotropic. 28,31,32
letrozolul a fost studiat la pacienții cu cancer ovarian recidivant; acei pacienți care au primit Letrozol au avut stabilizarea bolii.28,33 Letrozol Neoadjuvant a fost administrat la 10 femei aflate în postmenopauză cu cancer endometrial; medicamentul a demonstrat modificări clinice constructive și nu a avut un impact chirurgical negativ.28,34
când tratamentul cu testolactonă versus anastrozol a fost comparat la bărbații infertili, eficacitatea celor doi agenți a fost similară.28,35 pacienți cu sindrom Klinefelter au avut un tratament mai eficient cu testolactonă decât cu anastrozol.28,35
concluzii
A treia generație a arătat DFS superioară la femeile aflate în postmenopauză cu cancer de sân HR+, dar beneficiul clinic al mai mult de cinci ani de terapie AI la acești pacienți nu a fost stabilit.4 Proiectul Național chirurgical adjuvant pentru sân și intestin (NSABP) B-33 (exemestan) și o randomizare ulterioară a MA.17 (Letrozol) studiu va examina utilizarea acestor AIs față de placebo pentru încă cinci ani.4 AIs sunt o alternativă adecvată pentru femeile aflate în postmenopauză HR+ la care Tamoxifenul este contraindicat.4
efectele benefice ale AIs de generația a treia includ un profil de toxicitate mai tolerabil și DFS superioare comparativ cu tamoxifenul. Nivelul de eficacitate dintre acești agenți și tamoxifen este comparabil. Persistă incertitudini cu privire la Durata selectă a tratamentului, profilul toxicității pe termen lung și secvența adecvată de administrare pentru AIs.4 sunt necesare studii noi pentru a produce modulatori selectivi de aromatază care vor produce mai puțină toxicitate decât AIs.25,36 – 37
1. Robertson JFR. Fulvestrant (Faslodex XV)-cum să faci un medicament bun mai bun. Oncolog . 2007;12:774-784.
2. Osborne CK. Terapia medicamentoasă: tamoxifen în tratamentul cancerului de sân. N Engl J Med. 1998;339:1609-1618.
3. Rețeaua Națională Cuprinzătoare A Cancerului. NCCN ghiduri de practică clinică în oncologie — v. 1. 2008. Cancerul de sân. www.nccn.org/professionals/physician_gls/f_guidelines.asp. accesat la 11 octombrie 2007.
4. Winer EP, Hudis C, Burstein HJ și colab. Societatea Americană de evaluare a tehnologiei oncologice clinice privind utilizarea inhibitorilor de aromatază ca terapie adjuvantă pentru femeile aflate în postmenopauză cu cancer de sân pozitiv la receptorul hormonal: raport de stare 2004. J Clin Oncol . 2005;23:619-629.
5. Dunn BK, Wickerham DL, Ford LG. Prevenirea cancerelor legate de hormoni: cancerul de sân. J Clin Oncol. 2005;23:357-367.
6. Smith IE, Dowsett M. inhibitori de aromatază în cancerul de sân. N Engl J Med. 2003;348:2431-2442.
7. Goss PE, Strasser K. Inhibitori de aromatază în tratamentul și prevenirea cancerului de sân. J Clin Oncol . 2001;19:881-894.
8. Lacy CF, Armstrong II, Goldman MP și colab., eds. Manual De Informații Despre Droguri. Ediția a 13-a. Hudson, Oh: Lexi-Comp; 2005: 117,598,871.
9. Elena MJ, ed. Inhibitori de aromatază pentru tratamentul cancerului de sân. Manhasset, NY:Oncology Publishing Group, CMP Healthcare Media; 2005: 29-45.
10. Arimidex (anastrozol) prospect. Wilmington, de: AstraZeneca Pharmaceuticals LP; mai 2007.
11. Arora A, Potter JF. Aromatase inhibitors: current indications and future prospects for treatment of postmenopausal breast cancer. J Am Geriatr Soc. 2004;52:611-616.
12. Femara (letrozole) package insert. East Hanover, NJ: Novartis Pharmaceuticals Corp; December 2006.
13. Shaw G. In preventing breast cancer occurrence…anastrozole beats tamoxifen in ATAC. Clin Oncol News . 1/2008. www.clinicaloncology.com/index.asp?ses = ogst §ion_id=148&show=dept&article_id=9884. Accesat La 17 Martie 2008.
14. Aromasin (Exemestan) prospect. New York, New York: Pfizer Inc; Februarie 2007.
15. Baum M, Budzar AU, Cuzick J și colab., pentru grupul ATAC Trialists. Anastrozol în monoterapie sau în asociere cu tamoxifen versus tamoxifen în monoterapie pentru tratamentul adjuvant al femeilor aflate în postmenopauză cu cancer mamar precoce: primele rezultate ale studiului randomizat ATAC. Lancet. 2002;359:2131-2139.
16. Howell a, Cuzick J, Baum M și colab., pentru grupul ATAC Trialists. Rezultatele studiului ATAC (Arimidex, Tamoxifen, singur sau în combinație) după finalizarea tratamentului adjuvant de 5 ani pentru cancerul de sân. Lancet. 2005;365:60-62.
17. Goss PE, Ingle JN, Martino S și colab. Un studiu randomizat al letrozolului la femeile aflate în postmenopauză după cinci ani de terapie cu tamoxifen pentru cancerul de sân în stadiu incipient. N Engl J Med. 2003;349:1793-1802.
18. Thrlimann B, Keshaviah A, Coates AS și colab., pentru grupul de colaborare Breast International Group (BIG) 1-98. O comparație a letrozolului și a tamoxifenului la femeile aflate în postmenopauză cu cancer de sân timpuriu. N Engl J Med. 2005;353:2747-2757.
19. Coombes RC, Hall e, Gibson LJ și colab., pentru studiul intergrup Exemestan. Un studiu randomizat al exemestanului după doi până la trei ani de terapie cu tamoxifen la femeile aflate în postmenopauză cu cancer de sân primar. N Engl J Med. 2004; 350:
1081-1092.
20. Ellis G, Bone HG, Chlebowski R și colab. Un studiu de fază 3 al efectului terapiei cu denosumab asupra densității minerale osoase la femeile care primesc inhibitori de aromatază pentru cancerul de sân non-metastatic. Lucrare prezentată la: al 30-lea Simpozion anual San Antonio pentru cancerul de sân; 13-16 decembrie 2007; San Antonio, TX. Rezumat 47.
21. Singh S, Cuzick J, Edwards R, și colab. Efectul anastrozolului asupra densității minerale osoase după un an de tratament: rezultate din sub-studiul osos al studiului Internațional de intervenție asupra cancerului de sân (IBIS-II). Lucrare prezentată la: cel de-al 30-lea Simpozion anual San Antonio pentru cancerul de sân; 13-16 decembrie 2007; San Antonio, TX. Rezumat 28.
22. Dellapasqua s, Colleoni M, Gelber RD, Goldhirsch A. terapie endocrină adjuvantă pentru femeile aflate în premenopauză cu cancer de sân timpuriu. J Clin Oncol. 2005;23:1736-1750.
23. Institutul Național Al Cancerului. Tratamentul cancerului de sân (PDQ). www.cancer.gov/cancertopics/pdq/treatment/breast/healthprofessional. accesat la 26 decembrie 2007.
24. Colegiul de Medicină Baylor studii clinice. Suprimarea funcției ovariene studiu (moale). www.breastcenter.tmc.edu/clinic/trials/soft.htm. accesat la 26 decembrie 2007.
25. Aebi s, Castiglione-Gertsch M. terapie endocrină adjuvantă pentru pacienții foarte tineri. Piept. 2003;12:509-515.
26. ClinicalTrials.gov. suprimarea funcției ovariene plus fie tamoxifen, fie exemestan, comparativ cu tamoxifenul singur în tratarea femeilor aflate în premenopauză cu cancer de sân care răspunde la hormoni. www.clinicaltrials.gov/. accesat la 26 decembrie 2007.
27. Cuzick J. Inhibitori de aromatază pentru prevenirea cancerului de sân. J Clin Oncol. 2005;23:1636-1643.
28. Karaer O, Oru s, Koyuncu FM. Inhibitori de aromatază: posibile aplicații viitoare. Acta Obstet Gynecol Scand. 2004:83:699-706.
29. Mitwally MF, Casper RF. Utilizarea unui inhibitor de aromatază pentru inducerea ovulației la pacienții cu răspuns inadecvat la citratul de clomifen. Fertil Steril. 2001;75:305-309.
30. Bulun SE, Yang s, Fang Z, și colab. Rolul aromatazei în boala endometrială. J Steroizi Biochem Mol Biol. 2001;79:19-25.
31. Feuillan P, Merke D, Leschek EW, Cutler GB. Utilizarea inhibitorilor de aromatază în pubertatea precoce. Endocr Legate De Cancer. 1999;6:303-306.
32. Shozu M, Sebastian S, Takayama K și colab. Excesul de Estrogen asociat cu mutații noi de câștig de funcție care afectează gena aromatazei. N Engl J Med. 2003;348:1855-1865.
33. Bowman A, Gabra H, Langdon SP, și colab. Răspunsul CA 125 este asociat cu expresia receptorilor de estrogen într-un studiu de fază II al letrozolului în cancerul ovarian: identificarea unui subgrup sensibil la sistemul endocrin. Res.2002;8:2233-2239.
34. Berstein L, Maximov S, Gershfeld E, și colab. Terapia neoadjuvantă a cancerului endometrial cu inhibitorul de aromatază Letrozol: efecte endocrine și clinice. EUR J Obstet Gynecol Reprod Biol. 2002;105:161-165.
35. Raman JD, Schlegel PN. Inhibitori de aromatază pentru infertilitatea masculină. J Urol. 2002;167:624-629.
36. Simpson ER, Dowsett M. aromataza și inhibitorii săi: semnificație pentru terapia cancerului de sân. Recent Prog Horm Res. 2002; 57: 317-338.