teoria hibridizării este adesea văzută ca un concept lung și confuz și este o abilitate la îndemână pentru a putea determina rapid dacă atomul este sp3, sp2 sau sp fără a fi nevoie să parcurgeți toate detaliile despre modul în care s-a întâmplat hibridizarea.
Din fericire, există o scurtătură în a face acest lucru și în acest post, voi încerca să rezume acest lucru în câțiva pași distincte pe care trebuie să urmați.
Să presupunem că vi se cere să determinați starea de hibridizare pentru atomii numerotați din următoarea moleculă:

primul lucru pe care trebuie să-l faceți este să determinați numărul grupurilor care se află pe fiecare atom. Prin grupuri, ne referim fie la atomi, fie la perechi de electroni singuri. Acest lucru este, de asemenea, cunoscut sub numele de numărul Steric (Sn).

mai jos sunt câteva exemple de numere sterice 2-4, care este în mare parte ceea ce trebuie să știți în chimia organică:

observați că mai multe legături nu contează, este atomi + perechi singuratice pentru orice tip de legătură.
odată ce știți cum să determinați numărul steric (este din teoria VSEPR), trebuie pur și simplu să aplicați următoarea corelație:
dacă numărul steric este 4, este sp3
dacă numărul steric este 3 – sp2
dacă numărul steric este 2 – sp
deci, acum, să ne întoarcem la molecula noastră și să determinăm stările de hibridizare pentru toți atomii.
C1 – SN = 3 (trei atomi conectați), prin urmare este sp2
C2 – SN = 3 (trei atomi conectați), prin urmare este sp2
O4 – SN = 3 (1 atom + 2 perechi singuratice), prin urmare este sp2
O5 – Sn = 4 (2 atomi + 2 perechi singuratice), prin urmare este sp3
C6 – SN = 4 (4 este SP3
C7 – SN = 4 (4 atomi), prin urmare este SP3
N8 – SN = 4 (3 atomi + 1 pereche singuratică), prin urmare este SP3
C9 – SN = 2 (2 atomi), prin urmare este SP
C10 – SN = 2 (2 atomi), prin urmare este SP

În plus față de această metodă, este, de asemenea, foarte util să ne amintim unele trăsături legate de structura și hibridizare. În general, un atom cu toate legăturile unice este un SP3 hibridizat. Cel mai bun exemplu sunt alcanii. Toți atomii de carbon dintr-un alcan sunt hibridizați sp3 cu geometria tetraedrică.
carbonii din alchene și alți atomi cu legătură dublă sunt adesea hibridizați sp2 și au geometrie plană trigonală.legătura triplă, pe de altă parte, este caracteristică alchinelor în care atomii de carbon sunt hibridizați sp.
există câteva excepții comune de la ceea ce am discutat despre determinarea stării de hibridizare și sunt în mare parte legate de metoda în care ne uităm la tipul de legătură al atomului.
de exemplu, în dioxidul de carbon (CO2), carbonul are două legături duble, dar este SP-hibridizat.
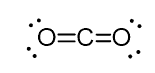
și motivul pentru aceasta este faptul că numărul steric al carbonului este de doi (există doar doi atomi de oxigen conectați la acesta) și pentru a menține doi atomi la 180o, care este geometria optimă, carbonul trebuie să utilizeze doi orbitali identici. Acest lucru este posibil numai în hibridizarea sp. Ceilalți doi orbitali 2p sunt utilizați pentru realizarea legăturilor duble pe fiecare parte a carbonului.
Un alt exemplu comun și foarte important este carbocațiile.

aici carbonul are doar legături simple și poate părea că ar trebui să fie hibridizat sp3. Cu toate acestea, carbonul din aceste tipuri de carbocații este hibridizat sp2. Din nou, din același motiv, că numărul său steric este 3 (sp2 – trei orbitali identici).
o excepție de la metoda numărului Steric
o excepție cu numărul steric este, de exemplu, amidele. Atomul de azot de aici are numărul steric 4 și se așteaptă la sp3. Cu toate acestea, datorită delocalizării rezonanței perechii singure, aceasta se interconvertește de la sp3 la sp2, deoarece este singura modalitate de a avea electronii într-un orbital p aliniat care se poate suprapune și participa la stabilizarea rezonanței cu electronii legăturii pi a legăturii duble C=O.

în majoritatea cazurilor, nu va trebui să vă faceți griji cu privire la excepții dacă mergeți pe baza numărului Steric.