mecanisme de cataliză enzimatică
legarea unui substrat de situsul activ al unei enzime este o interacțiune foarte specifică. Siturile Active sunt fisuri sau caneluri pe suprafața unei enzime, compuse de obicei din aminoacizi din diferite părți ale lanțului polipeptidic care sunt reunite în structura terțiară a proteinei pliate. Substraturile se leagă inițial de situsul activ prin interacțiuni necovalente, inclusiv legături de hidrogen, legături ionice și interacțiuni hidrofobe. Odată ce un substrat este legat de locul activ al unei enzime, mai multe mecanisme pot accelera conversia acestuia în produsul reacției.deși exemplul simplu discutat în secțiunea anterioară a implicat doar o singură moleculă de substrat, majoritatea reacțiilor biochimice implică interacțiuni între două sau mai multe substraturi diferite. De exemplu, formarea unei legături peptidice implică îmbinarea a doi aminoacizi. Pentru astfel de reacții, legarea a două sau mai multe substraturi de situsul activ în poziția și orientarea corespunzătoare accelerează reacția (figura 2.23). Enzima oferă un șablon pe care reactanții sunt reuniți și orientați corespunzător pentru a favoriza formarea stării de tranziție în care interacționează.

figura 2.23
cataliza enzimatică a unei reacții între două substraturi. Enzima oferă un șablon pe care cele două substraturi sunt reunite în poziția și orientarea corespunzătoare pentru a reacționa între ele.
enzimele accelerează reacțiile și prin modificarea conformației substraturilor lor pentru a se apropia de cea a stării de tranziție. Cel mai simplu model de interacțiune enzimă-substrat este modelul de blocare și cheie, în care substratul se încadrează exact în situsul activ (figura 2.24). Cu toate acestea, în multe cazuri, configurațiile atât ale enzimei, cât și ale substratului sunt modificate prin legarea substratului—un proces numit potrivire indusă. În astfel de cazuri, conformația substratului este modificată astfel încât să semene mai mult cu cea a stării de tranziție. Stresul produs de o astfel de distorsiune a substratului poate facilita și mai mult conversia acestuia în starea de tranziție prin slăbirea legăturilor critice. Mai mult, starea de tranziție este stabilizată prin legarea sa strânsă la enzimă, scăzând astfel energia necesară de activare.

figura 2.24
modele de interacțiune enzimă-substrat. (A) în modelul de blocare și cheie, substratul se încadrează exact în locul activ al enzimei. (B) în modelul indus-fit, legarea substratului distorsionează conformațiile atât ale substratului, cât și ale enzimei. Această distorsiune (mai mult…)
pe lângă reunirea mai multor substraturi și distorsionarea conformației substraturilor pentru a aborda starea de tranziție, multe enzime participă direct la procesul catalitic. În astfel de cazuri, lanțurile laterale specifice de aminoacizi din situsul activ pot reacționa cu substratul și pot forma legături cu intermediarii de reacție. Aminoacizii acizi și bazici sunt adesea implicați în aceste mecanisme catalitice, așa cum este ilustrat în următoarea discuție a chimotripsinei ca exemplu de cataliză enzimatică.chimotripsina este un membru al unei familii de enzime (serin proteaze) care digeră proteinele prin catalizarea hidrolizei legăturilor peptidice. Reacția poate fi scrisă după cum urmează:

diferiții membri ai familiei serin proteazelor (inclusiv chimotripsina, tripsina, elastaza și trombina) au specificități distincte ale substratului; ei clivează preferențial legăturile peptidice adiacente diferiților aminoacizi. De exemplu, în timp ce chimotripsina digeră legături adiacente aminoacizilor hidrofobi, cum ar fi triptofanul și fenilalanina, tripsina digeră legături lângă aminoacizii bazici, cum ar fi lizina și arginina. Cu toate acestea, toate serin proteazele sunt similare în structură și utilizează același mecanism de cataliză. Situsurile active ale acestor enzime conțin trei aminoacizi critici-serină, histidină și aspartat—care conduc hidroliza legăturii peptidice. Într-adevăr, aceste enzime sunt numite serin proteaze datorită rolului central al reziduului de serină.
substraturile se leagă de serin-proteazele prin inserarea aminoacidului adiacent locului de clivaj într-un buzunar la locul activ al enzimei (figura 2.25). Natura acestui buzunar determină specificitatea substratului diferiților membri ai familiei serin proteazelor. De exemplu, buzunarul de legare al chimotripsinei conține aminoacizi hidrofobi care interacționează cu lanțurile laterale hidrofobe ale substraturilor sale preferate. În schimb, buzunarul de legare al tripsinei conține un aminoacid acid încărcat negativ (aspartat), care este capabil să formeze o legătură ionică cu reziduurile de lizină sau arginină ale substraturilor sale.
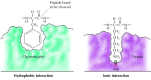
figura 2.25
legarea substratului de serin-proteaze. Aminoacidul adiacent legăturii peptidice care trebuie scindată este introdus într-un buzunar la locul activ al enzimei. În chimotripsină, buzunarul leagă aminoacizii hidrofobi; buzunarul de legare al tripsinei conține (mai mult…)
legarea substratului poziționează legătura peptidică care trebuie scindată adiacent serinei situsului activ (figura 2.26). Protonul acestei serine este apoi transferat la situsul activ histidină. Conformația situsului activ favorizează acest transfer de protoni, deoarece histidina interacționează cu reziduul de aspartat încărcat negativ. Serina reacționează cu substratul, formând o stare de tranziție tetraedrică. Legătura peptidică este apoi scindată, iar porțiunea C-terminală a substratului este eliberată din enzimă. Cu toate acestea, peptida N-terminală rămâne legată de serină. Această situație este rezolvată atunci când o moleculă de apă (al doilea substrat) intră în locul activ și inversează reacțiile precedente. Protonul moleculei de apă este transferat în histidină, iar gruparea sa hidroxil este transferată în peptidă, formând o a doua stare de tranziție tetraedrică. Protonul este apoi transferat de la histidină înapoi la serină, iar peptida este eliberată din enzimă, completând reacția.

figura 2.26
mecanismul catalitic al chimotripsinei. Trei aminoacizi la locul activ (Ser-195, His-57 și Asp-102) joacă roluri critice în cataliză.
acest exemplu ilustrează mai multe caracteristici ale catalizei enzimatice; specificitatea interacțiunilor enzimă-substrat, poziționarea diferitelor molecule de substrat în situsul activ și implicarea reziduurilor de situs activ în formarea și stabilizarea stării de tranziție. Deși mii de enzime din celule catalizează multe tipuri diferite de reacții chimice, aceleași principii de bază se aplică funcționării lor.