un bun punct de plecare pentru momentul în care trebuie să găsiți configurația electronică a unui ion este configurația electronică a atomului neutru.
în cazul tău, trebuie să găsești configurația electronică a anionului fluorurat, #”F”^(-)#, așa că începe prin a scrie configurația electronică a unui atom de fluor neutru, #”F”#.
fluorul este localizat în perioada 2, grupa 17 a tabelului periodic și are un număr atomic de #9#. Acest lucru vă spune că atomul de fluor neutru are un total de #9# electroni care înconjoară nucleul său.
configurația sa electronică va fi
#”F:” 1s^2 2s^2 2p^5#
acum, anionul #”F”^(-)# se formează atunci când #1# electron este adăugat la un atom de fluor neutru.
observați că sub-coaja 2P a atomului neutru conține # 5 # electroni. Capacitatea sa maximă este de fapt #6# electroni, doi electroni pentru fiecare p-orbital.
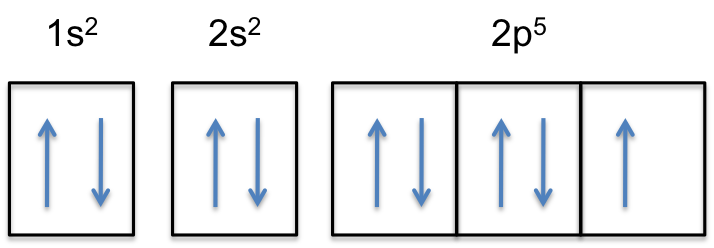
aceasta înseamnă că #color(roșu)(„electron suplimentar”)# va fi adăugat la unul dintre cei trei orbitali 2p, să spunem la #2p_y#.
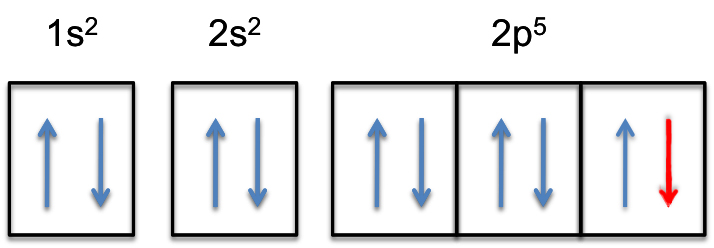
2P-subshell va fi acum complet umplut, adică va deține #6# electroni.
configurația electronică a anionului fluorurat va fi astfel
#culoare(verde) (/bar (ul(Culoare(Alb) (a/a)Culoare (Negru) („F”^( -):culoare(alb) (a) 1s^2color(alb) (a) 2s^2 culoare(alb) (a)2p^6)culoare(alb) (a/a)|)))#
observați că anionul fluorurat are un total de #8# electroni în a doua coajă, cea mai exterioară coajă. Acest lucru vă spune că anionul are un octet complet.
deoarece anionul fluorurat este izoelectronic cu neon, #”Ne”#, puteți scrie configurația sa electronică folosind notația stenografică a gazului nobil ca
#”F”^(-): #
aici
## – configurația electronică a neonului