Ei bine, ia în considerare delocalizarea densității electronilor. Aceasta este atunci când densitatea electronilor este răspândită cât mai mult posibil într-o moleculă, astfel încât acumularea minimă de sarcină să fie prezentă într-un orbital dat.
care este descris:
- colectiv de către toți colaboratorii de rezonanță din structurile Lewis.
- colectiv prin toate contribuțiile orbitale moleculare individuale în diagramele orbitale moleculare.
(există diferențe subtile între acestea, dar acestea sunt aproximativ analoge pentru simplitate. Vezi AICI pentru mai multe detalii.)
localizarea densității electronilor este lipsa acesteia.
este atunci când umplem toată densitatea electronilor în câțiva orbitali, în loc să o răspândim, și aproape niciodată nu se întâmplă într-o moleculă reală sau într-un sistem cuantic (chiar dacă nu există rezonanță).
exemplu cu structuri de rezonanță
luați în considerare cationul alilic izolat (care nu reacționează), #”C”_3″H”_5^(+)#.
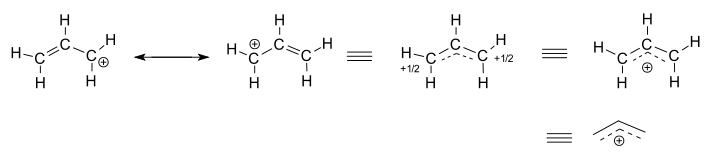
- cele două structuri din stânga sunt contribuitori de rezonanță, fiecare dintre acestea fiind reprezentări localizate ale adevăratei structuri delocalizate.
- cele trei structuri din dreapta sunt reprezentări ale structurii hibride de rezonanță sau ale structurii delocalizate.
structura delocalizată este descrisă practic de o colecție de orbitali moleculari de legătură.
exemplu cu o diagramă orbitală moleculară
luați în considerare cationul alil din nou într-o diagramă MO care descrie doar electronii #bbpi# (adică electronii care ar fi într-o legătură #pi# într-o legătură dublă localizată!), dar permite participarea la reacții:
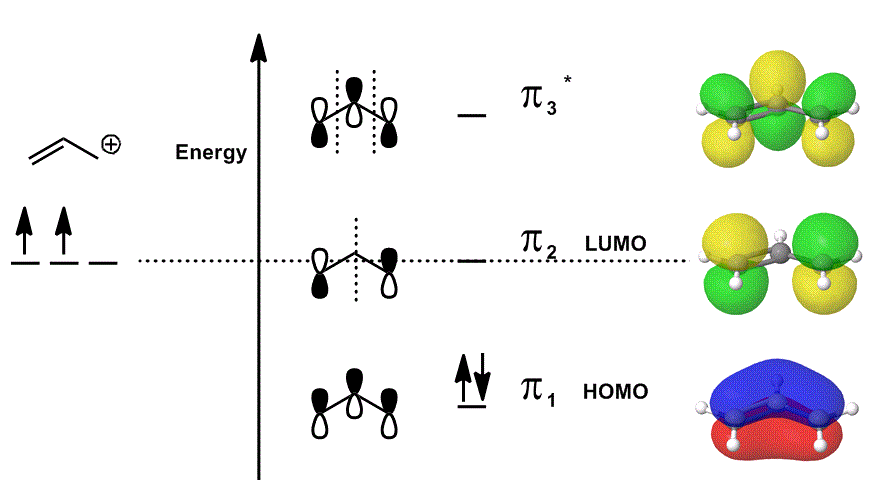
- fiecare dintre contribuțiile orbitale din mijloc sunt reprezentate localizate; orbitalii atomici care s-ar suprapune sunt arătați ca ei înșiși (faza inclusă).
- fiecare dintre orbitalii din extrema dreaptă (unul pe rând) sunt descriși delocalizați; densitatea electronilor este lăsată să se răspândească astfel încât orbitalii moleculari să fie descriși cu luarea în considerare completă a suprapunerilor, nodurilor și fazelor.
când suprapuneți # pi_1#, # pi_2 # și # pi_3^” * ” # și încorporați contribuția ponderată a acestor stări (ponderată în funcție de coeficienții # c_i#), obțineți combinația liniară de orbitali moleculari:
#Psi_(„alil”^(+)) = c_1overbrace(pi_1)^”lipire” + c_2overbrace(pi_2)^”nonbonding” + c_3overbrace(pi_3^”*”)^”antibonding”#
și #Psi_(„alil”^(+))# atunci descrie distribuția generală a stărilor care descriu colectiv reactivitatea cationului alil.
cu alte cuvinte, #pi_1# (care donează electronii #pi# pentru a se lega), #pi_2# (care acceptă electronii pentru a se lega) și #pi_3^”*”# (în acest caz, va participa rar) toate fac ceva atunci când cationul alil participă la o reacție chimică, deoarece (dacă sunt ocupate), ele există în același timp.