denumire generică: heparina sodică
forma de dozare: injecție
- Hep-Lock descriere
- Hep-Lock – Farmacologie Clinică
- indicații și utilizare pentru Hep-Lock
- contraindicații
- avertismente
- hipersensibilitate
- hemoragie
- trombocitopenie
- trombocitopenia indusă de heparină (HIT) și trombocitopenia și tromboza induse de heparină (HITT)
- debutul întârziat al HIT și HITT
- utilizare la nou-născuți și sugari
- Precauții
- General
- teste de laborator
- interacțiuni medicamentoase
- carcinogeneză, mutageneză, afectarea fertilității
- sarcina
- sarcina categoria C
- mamele care alăptează
- utilizare pediatrică
- utilizare geriatrică
- reacții Adverse
- hemoragie
- trombocitopenie, trombocitopenie indusă de heparină (HIT) și trombocitopenie și tromboză indusă de heparină (HITT) și debutul întârziat al HIT și HITT
- iritație locală
- hipersensibilitate
- supradozaj
- simptome
- tratamentul – neutralizarea efectului heparinei
- Hep-Lock dozare și Administrare
- menținerea permeabilității dispozitivelor intravenoase
- extragerea probelor de sânge
- cum se livrează Hep-Lock
- depozitare
Hep-Lock descriere
heparina este un grup eterogen de mucopolizaharide anionice cu lanț drept, numite glicozaminoglicani, având proprietăți anticoagulante. Deși pot fi prezente și altele, principalele zaharuri care apar în heparină sunt: (1) Acid 2-sulfat de l-l-iduronic, (2) acid 2-deoxi-2-sulfamino-6-sulfat de D-glucoză, (3) Acid D-glucuronic, (4) acid 2-acetamido-2-deoxi-D-glucoză și (5) acid L-iduronic. Aceste zaharuri sunt prezente în cantități descrescătoare, de obicei în ordinea (2)>>>>(5), și sunt unite prin legături glicozidice, formând polimeri de dimensiuni. Heparina este puternic acidă datorită conținutului său de sulfat legat covalent și grupări de acid carboxilic. În heparina sodică, protonii acizi ai unităților de sulfat sunt parțial înlocuiți cu ioni de sodiu.
Formula structurală a heparinei sodice (subunități reprezentative):
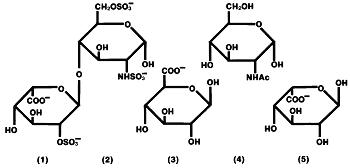
Hep-Lock U / P (Heparin Lock Flush Solution fără conservanți, USP) este o soluție sterilă numai pentru spălare intravenoasă. Nu trebuie utilizat pentru terapia anticoagulantă. Hep-Lock U / P este special formulat pentru utilizare în situații în care utilizarea conservanților nu este recomandabilă. Fiecare mL conține heparină sodică 10 sau 100 unități USP, derivate din intestine porcine și standardizate pentru utilizare ca anticoagulant, clorură de sodiu 8 mg, fosfat de sodiu monobazic monohidrat 2,3 mg și fosfat de sodiu dibazic anhidru 0,5 mg în apă pentru preparate injectabile. pH 5,0-7.5. Potența este determinată prin analiză biologică utilizând un standard de referință USP bazat pe unități de activitate a heparinei pe miligram.
Hep-Lock – Farmacologie Clinică
heparina inhibă reacțiile care duc la coagularea sângelui și formarea cheagurilor de fibrină atât in vitro, cât și in vivo. Heparina acționează în mai multe locuri din sistemul normal de coagulare. Cantități mici de heparină în combinație cu antitrombina III (cofactor de heparină) pot inhiba tromboza prin inactivarea factorului X activat și inhibarea conversiei protrombinei în trombină. Odată ce tromboza activă s-a dezvoltat, cantități mai mari de heparină pot inhiba coagularea ulterioară prin inactivarea trombinei și prevenirea conversiei fibrinogenului în fibrină. Heparina previne, de asemenea, formarea unui cheag de fibrină stabil prin inhibarea activării factorului de stabilizare a fibrinei.
timpul de sângerare nu este de obicei afectat de heparină. Timpul de coagulare este prelungit cu doze terapeutice complete de heparină; în majoritatea cazurilor, nu este afectat măsurabil de doze mici de heparină. Parcelele logliniare ale concentrațiilor plasmatice de heparină cu timpul, pentru o gamă largă de niveluri de doză, sunt liniare, ceea ce sugerează absența proceselor de ordin zero. Ficatul și sistemul reticulo-endotelial sunt locurile de biotransformare. Curba de eliminare bifazică, o fază alfa în scădere rapidă (T-10 min) și după vârsta de 40 de ani o fază beta mai lentă, indică absorbția în organe. Absența unei relații între timpul de înjumătățire anticoagulant și timpul de înjumătățire plasmatică prin concentrare poate reflecta factori precum legarea heparinei de proteine.
pacienții cu vârsta peste 60 de ani, după doze similare de heparină, pot avea concentrații plasmatice mai mari de heparină și timpi mai mari de tromboplastină parțială activată (APTT), comparativ cu pacienții cu vârsta sub 60 de ani.
heparina nu are activitate fibrinolitică; prin urmare, nu va Liza cheagurile existente.
indicații și utilizare pentru Hep-Lock
Hep-Lock U / P (Heparin Lock Flush Solution fără conservanți, USP) este destinat să mențină permeabilitatea unui dispozitiv de venipunctură interior conceput pentru injecție intermitentă sau terapie prin perfuzie sau prelevare de probe de sânge. Heparin Lock Flush Solution poate fi utilizat după plasarea inițială a dispozitivului în venă, după fiecare injecție a unui medicament sau după retragerea sângelui pentru testele de laborator. (Vezi dozare și administrare, menținerea permeabilității dispozitivelor intravenoase pentru instrucțiuni de utilizare.)
Hep-Lock U / P nu trebuie utilizat pentru terapia anticoagulantă.
contraindicații
heparina sodică nu trebuie utilizată la pacienții cu următoarele afecțiuni: trombocitopenie severă; o stare de sângerare activă incontrolabilă (vezi avertismente), cu excepția cazului în care aceasta se datorează coagulării intravasculare diseminate.
avertismente
heparina nu este destinată utilizării intramusculare.
hipersensibilitate
pacienții cu hipersensibilitate documentată la heparină trebuie să primească medicamentul numai în situații care pot pune viața în pericol. (Vezi reacții ADVERSE, hipersensibilitate.)
hemoragie
hemoragia poate apărea la aproape orice loc la pacienții care primesc heparină. O scădere inexplicabilă a hematocritului, scăderea tensiunii arteriale sau orice alt simptom inexplicabil ar trebui să conducă la o examinare serioasă a unui eveniment hemoragic.
heparina sodică trebuie utilizată cu precauție extremă în stările de boală în care există un pericol crescut de hemoragie. Unele dintre condițiile în care există un pericol crescut de hemoragie sunt:
cardiovasculare
endocardită bacteriană subacută, hipertensiune arterială severă.
chirurgicale
în timpul și imediat după (a) tap spinal sau anestezie spinală sau (b) intervenții chirurgicale majore, în special care implică creierul, măduva spinării sau ochiul.
afecțiuni hematologice
asociate cu tendințe crescute de sângerare, cum ar fi hemofilia, trombocitopenia și unele purpuri vasculare.
gastro-intestinale
leziuni Ulcerative și drenaj tubular continuu al stomacului sau intestinului subțire.
alte
menstruație, boală hepatică cu hemostază afectată.
trombocitopenie
trombocitopenia a fost raportată la pacienții cărora li s-a administrat heparină cu o incidență raportată de până la 30%. Numărul de trombocite trebuie obținut la momentul inițial și periodic în timpul administrării heparinei. Trombocitopenia ușoară (număr mai mare de 100000/mm3) poate rămâne stabilă sau inversă chiar dacă heparina este continuată. Cu toate acestea, trombocitopenia de orice grad trebuie monitorizată îndeaproape. Dacă numărul scade sub 100.000/mm3 sau dacă apare tromboză recurentă (vezi trombocitopenia indusă de heparină și trombocitopenia și tromboza indusă de heparină), medicamentul cu heparină trebuie întrerupt și, dacă este necesar, trebuie administrat un anticoagulant alternativ.
trombocitopenia indusă de heparină (HIT) și trombocitopenia și tromboza induse de heparină (HITT)
trombocitopenia indusă de heparină (HIT) este o reacție gravă mediată de anticorpi care rezultă din agregarea ireversibilă a trombocitelor. HIT poate progresa spre dezvoltarea trombozelor venoase și arteriale, o afecțiune denumită trombocitopenie și tromboză indusă de heparină (HITT). Evenimentele trombotice pot fi, de asemenea, prezentarea inițială pentru HITT. Aceste evenimente tromboembolice grave includ tromboză venoasă profundă, embolie pulmonară, tromboză venoasă cerebrală, ischemie la nivelul membrelor, accident vascular cerebral, infarct miocardic, tromboză mezenterică, tromboză arterială renală, necroză cutanată, gangrena extremităților care poate duce la amputare și, eventual, deces. Trombocitopenia de orice grad trebuie monitorizată îndeaproape. Dacă numărul de trombocite scade sub 100000/mm3 sau dacă apare tromboză recurentă, medicamentul cu heparină trebuie întrerupt imediat și trebuie luate în considerare anticoagulante alternative dacă pacienții necesită continuarea anticoagulării.
debutul întârziat al HIT și HITT
trombocitopenia indusă de heparină și trombocitopenia și tromboza induse de heparină pot apărea până la câteva săptămâni după întreruperea tratamentului cu heparină. Pacienții care prezintă trombocitopenie sau tromboză după întreruperea tratamentului cu heparină trebuie evaluați pentru HIT și HITT.
utilizare la nou-născuți și sugari
concentrația de 100 Unități / mL nu trebuie utilizată la nou-născuți sau la sugari care cântăresc mai puțin de 10 kg din cauza riscului de anticoagulare sistemică. Este necesară prudență atunci când se utilizează concentrația de 10 unități/mL la sugarii prematuri care cântăresc mai puțin de 1 kg și care primesc bufeuri frecvente, deoarece o doză terapeutică de heparină poate fi administrată sugarului într-o perioadă de 24 de ore.
Precauții
General
precauții trebuie exercitate atunci când medicamentele incompatibile cu heparina sunt administrate printr-un cateter intravenos care conține o soluție de heparină fără conservanți. (SeeDOSAGE și administrare, menținerea permeabilității dispozitivelor intravenoase.) Concentrația de fosfor în soluția de heparină este de 0,63 mg/mL.
trombocitopenie, trombocitopenie indusă de heparină (HIT) și trombocitopenie și tromboză indusă de heparină (HITT)
SeeWARNINGS
risc crescut la pacienții vârstnici, în special la femei
a fost raportată o incidență mai mare a sângerărilor la pacienții, în special la femei, cu vârsta peste 60 de ani.
teste de laborator
Numărul periodic de trombocite, hematocritele și testele pentru sângele ocult în scaun sunt recomandate pe tot parcursul terapiei cu heparină, indiferent de calea de administrare. (SeeDOSAGE și administrare.)
interacțiuni medicamentoase
inhibitori plachetari
medicamente precum acid acetilsalicilic, dextran, fenilbutazonă, ibuprofen, indometacin, dipiridamol, hidroxiclorochină și altele care interferează cu reacțiile de agregare plachetară (principala apărare hemostatică a pacienților heparinizați) pot induce sângerare și trebuie utilizate cu precauție la pacienții care primesc heparină sodică.
alte interacțiuni
digitalice, tetracicline, nicotină sau antihistaminice pot contracara parțial acțiunea anticoagulantă a heparinei sodice.
carcinogeneză, mutageneză, afectarea fertilității
nu s-au efectuat studii pe termen lung la animale pentru evaluarea potențialului carcinogen al heparinei sodice. De asemenea, nu s-au efectuat studii asupra funcției de reproducere la animale privind mutageneza sau afectarea fertilității.
sarcina
efecte teratogene
sarcina categoria C
nu s-au efectuat studii asupra funcției de reproducere la animale cu heparină sodică. De asemenea, nu se știe dacă heparina sodică poate provoca leziuni fetale atunci când este administrată unei femei însărcinate sau poate afecta capacitatea de reproducere. Heparina sodică trebuie administrată unei femei însărcinate numai dacă este clar necesară.
efecte Nonteratogene
heparina nu traversează bariera placentară.
mamele care alăptează
heparina nu este excretată în laptele uman.
utilizare pediatrică
siguranța și eficacitatea la copii și adolescenți nu au fost stabilite (vezi avertismente, utilizare la nou-născuți și sugari).
utilizare geriatrică
s-a raportat o incidență mai mare a sângerărilor la pacienții cu vârsta peste 60 de ani, în special la femei (vezi farmacologie clinică și precauții, General).
reacții Adverse
hemoragie
hemoragia este complicația principală care poate rezulta din utilizarea heparinei (seeWARNINGS, hemoragie). Un timp de coagulare prea prelungit sau sângerări minore în timpul terapiei pot fi de obicei controlate prin retragerea medicamentului (vezi supradozajul).
trombocitopenie, trombocitopenie indusă de heparină (HIT) și trombocitopenie și tromboză indusă de heparină (HITT) și debutul întârziat al HIT și HITT
SeeWARNINGS.
iritație locală
iritație locală și eritem au fost raportate la utilizarea soluției Heparin Lock Flush.
hipersensibilitate
au fost raportate reacții de hipersensibilitate generalizate, cu frisoane, febră și urticarie ca manifestări cele mai obișnuite și astm, rinită, lacrimare, cefalee, greață și vărsături și reacții anafilactoide, inclusiv șoc, care apar mai rar. Pot apărea mâncărimi și arsuri, în special pe partea plantară a picioarelor.s-a raportat apariția trombocitopeniei la pacienții cărora li s-a administrat heparină cu o incidență raportată de până la 30%. Deși adesea ușoară și fără semnificație clinică evidentă, o astfel de trombocitopenie poate fi însoțită de complicații tromboembolice severe, cum ar fi necroza pielii, gangrena extremităților care pot duce la amputare, infarct miocardic, embolie pulmonară, accident vascular cerebral și, eventual, deces. (Vezi avertismente și precauții.)
anumite episoade de membre dureroase, ischemice și cianozate au fost atribuite în trecut reacțiilor vasospastice alergice. Rămâne de determinat dacă acestea sunt de fapt identice cu complicațiile asociate trombocitopeniei.
supradozaj
simptome
sângerarea este semnul principal al supradozajului cu heparină. Sângerările nazale, sângele în urină sau scaunele de gudron pot fi observate ca primul semn de sângerare. Vânătăile ușoare sau formațiunile petechiale pot precede sângerarea sinceră.
tratamentul – neutralizarea efectului heparinei
când circumstanțele clinice (sângerare) necesită inversarea heparinizării, sulfatul de protamină (soluție 1%) prin perfuzie lentă va neutraliza heparina sodică. Nu trebuie administrate mai mult de 50 mg, foarte lent, în orice perioadă de 10 minute. Fiecare mg de sulfat de protamină neutralizează aproximativ 100 de unități de heparină USP. Cantitatea de protamină necesară scade în timp pe măsură ce heparina este metabolizată. Deși metabolismul heparinei este complex, se poate presupune, în scopul alegerii unei doze de protamină, că are un timp de înjumătățire de aproximativ 1/2 oră după injectarea intravenoasă.
administrarea sulfatului de protamină poate provoca reacții severe hipotensive și anafilactoide. Deoarece au fost raportate reacții fatale care seamănă adesea cu anafilaxia, medicamentul trebuie administrat numai atunci când tehnicile de resuscitare și tratamentul șocului anafilactoid sunt ușor disponibile.
pentru informații suplimentare consultați etichetarea injecției cu sulfat de protamină, produse USP.
Hep-Lock dozare și Administrare
produsele medicamentoase parenterale trebuie inspectate vizual pentru particule și decolorare înainte de administrare, ori de câte ori soluția și recipientul permit. Decolorarea ușoară nu modifică potența.
soluția de heparină fără conservanți în concentrație de 100 Unități / mL nu este recomandată pentru utilizare la nou-născuți și sugari (vezi avertismente, utilizare la nou-născuți și sugari).
menținerea permeabilității dispozitivelor intravenoase
pentru a preveni formarea cheagurilor într-un set de blocare a heparinei sau într-un cateter venos central după introducerea corectă a acestuia, soluția de spălare a heparinei, USP este injectată prin butucul de injecție într-o cantitate suficientă pentru a umple întregul dispozitiv. Această soluție trebuie înlocuită de fiecare dată când dispozitivul este utilizat. Aspirați înainte de a administra orice soluție prin dispozitiv pentru a confirma permeabilitatea și localizarea vârfului acului sau cateterului. Dacă medicamentul care trebuie administrat este incompatibil cu heparina, întregul dispozitiv trebuie spălat cu soluție salină normală înainte și după administrarea medicamentului; după a doua spălare salină, soluție de spălare cu heparină, USP poate fi reintrodus în dispozitiv. Instrucțiunile producătorului dispozitivului trebuie consultate pentru detalii privind utilizarea acestuia. De obicei, această soluție diluată de heparină va menține anticoagularea în dispozitiv timp de până la 4 ore.
notă: deoarece injecțiile repetate cu doze mici de heparină pot modifica testele pentru timpul parțial de tromboplastină activată (APTT), trebuie obținută o valoare inițială pentru APTT înainte de introducerea unui dispozitiv intravenos.
extragerea probelor de sânge
soluție de heparină fără conservanți, USP poate fi, de asemenea, utilizat după fiecare extragere de sânge pentru teste de laborator. Atunci când heparina ar interfera sau ar modifica rezultatele testelor de sânge, soluția de heparină trebuie eliminată din dispozitiv prin aspirarea și aruncarea acesteia înainte de a extrage proba de sânge.
cum se livrează Hep-Lock
Hep-Lock U/P (Heparin Lock Flush Solution fără conservanți, USP)
10 unități USP/mL
1 ml flacoane DOSETTE ambalate în 25s (NDC 0641-0272-25)
100 unități USP/mL
1 mL flacoane DOSETTE ambalate în 25s (NDC 0641-0272-25)
100 unități USP/mL
1 mL flacoane DOSETTE ambalate în 0641-0273-25)
depozitare
a se depozita la 20 octombrie -25 octombrie C (68 octombrie -77 octombrie f).
- Tahata T, Shigehito M, Kusuhara K, Ueda Y, și colab. Debutul întârziat al trombocitopeniei induse de heparină – un raport de caz – J JPN Assn Torca Surg.1992;40(3):110-111.
- Warkentin T, Kelton J. Trombocitopenie și tromboză induse de heparină cu debut întârziat. Analele Medicinii interne. 2001;135:502-506.
- orez l, Attisha W, Drexler a, Francis J. trombocitopenie indusă de heparină cu debut întârziat. Analele medicinei interne, 2002; 136:210-215.
- Dieck J., C. Rizo-Patron, și colab. (1990). „O nouă manifestare și alternativă de tratament pentru tromboza indusă de heparină.”Piept.1990;98:1524-26.
- Smythe M, Stephens J, Mattson. Trombocitopenie Indusă De Heparină Cu Debut Întârziat. Analele Medicinii de urgență, 2005;45(4):417-419.
- Divgi A. (retipărire), tumma S., Hari P., Friedman K., trombocitopenie indusă de heparină cu debut întârziat (HIT) care se prezintă după expunerea nedocumentată la medicament ca embolie pulmonară Post-Angiografie. Sânge. 2003; 102(11):127b.
ESI logo, Hep-Lock și Dosette sunt mărci comerciale înregistrate ale Baxter International, Inc. sau filialelor sale.
fabricat de
Baxter Healthcare Corporation
Deerfield, IL 60015 SUA
pentru anchetă produs 1 800 ANA de droguri (1-800-262-3784)
MLT-00090/6.0
| Hep-Lock U/P heparin sodium injection |
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
| Hep-Lock U/P heparin sodium injection |
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
Labeler – Baxter Healthcare Corporation
Medical Disclaimer