Curvas de calentamiento
La figura \ (\pageIndex{3}\) muestra una curva de calentamiento, una gráfica de temperatura versus tiempo de calentamiento, para una muestra de 75 g de agua. La muestra es inicialmente hielo a 1 atm y -23°C; a medida que se agrega calor, la temperatura del hielo aumenta linealmente con el tiempo. La pendiente de la línea depende tanto de la masa del hielo como del calor específico (Cs) del hielo, que es el número de julios necesarios para elevar la temperatura de 1 g de hielo en 1°C. A medida que aumenta la temperatura del hielo, las moléculas de agua en el cristal de hielo absorben más y más energía y vibran más vigorosamente. En el punto de fusión, tienen suficiente energía cinética para superar las fuerzas atractivas y moverse con respecto a los demás. A medida que se agrega más calor, la temperatura del sistema no aumenta más, sino que permanece constante a 0°C hasta que todo el hielo se derrita. Una vez que todo el hielo se ha convertido en agua líquida, la temperatura del agua comienza a aumentar de nuevo. Ahora, sin embargo, la temperatura aumenta más lentamente que antes porque la capacidad calorífica específica del agua es mayor que la del hielo. Cuando la temperatura del agua alcanza los 100°C, el agua comienza a hervir. Aquí, también, la temperatura se mantiene constante a 100°C hasta que toda el agua se haya convertido en vapor. En este punto, la temperatura comienza a subir de nuevo, pero a un ritmo más rápido que en las otras fases porque la capacidad calorífica del vapor es menor que la del hielo o el agua.
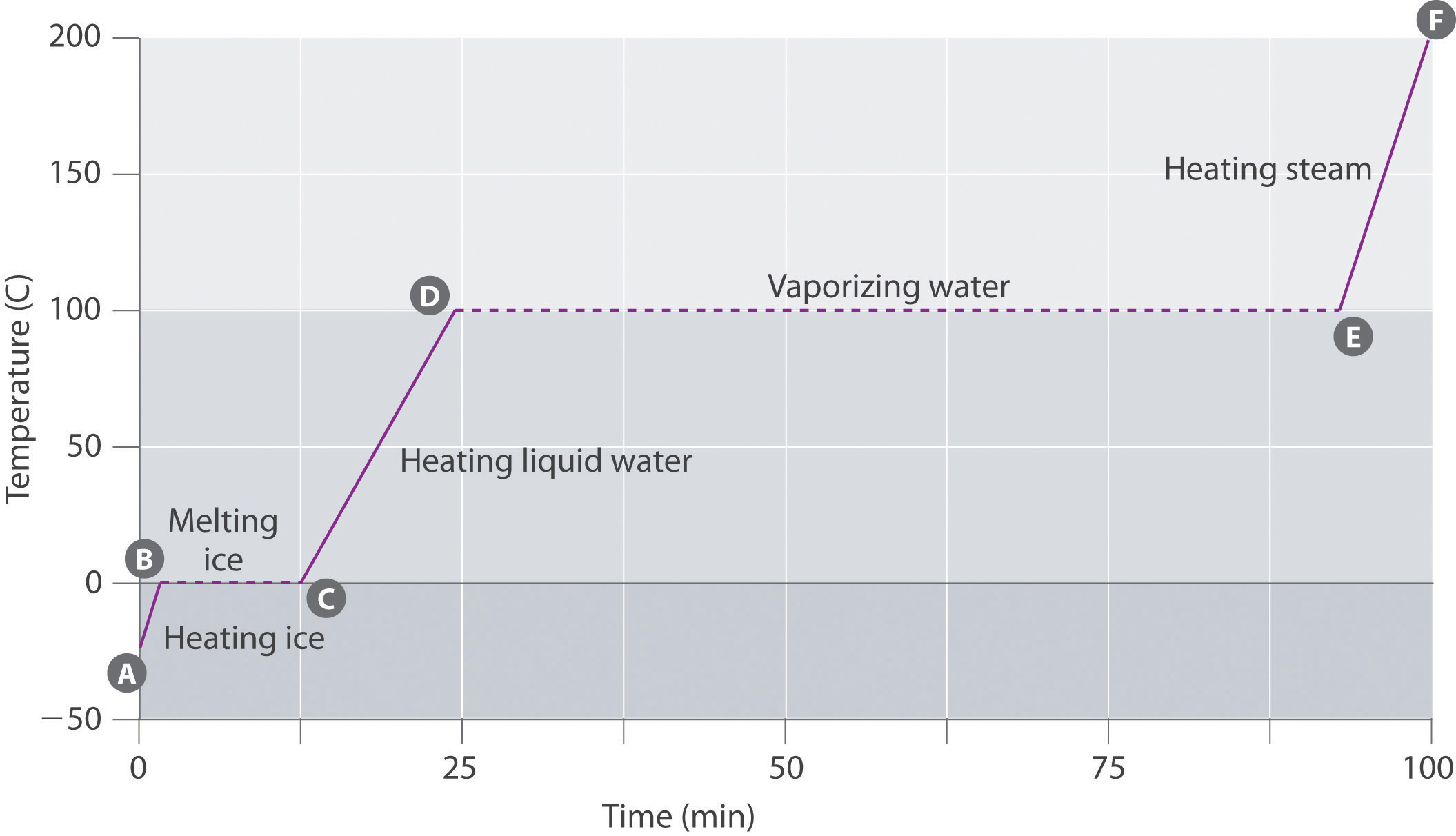
por Lo tanto la temperatura de un sistema no cambia durante un cambio de fase. En este ejemplo, mientras esté presente incluso una pequeña cantidad de hielo, la temperatura del sistema se mantendrá a 0°C durante el proceso de fusión, y mientras esté presente incluso una pequeña cantidad de agua líquida, la temperatura del sistema se mantendrá a 100°C durante el proceso de ebullición. La velocidad a la que se agrega calor no afecta a la temperatura de la mezcla de hielo/agua o agua/vapor porque el calor agregado se utiliza exclusivamente para superar las fuerzas atractivas que mantienen unida la fase más condensada. Muchos cocineros piensan que los alimentos se cocinarán más rápido si el calor sube más alto para que el agua hierva más rápidamente. En cambio, la olla de agua hervirá hasta secarse antes, pero la temperatura del agua no depende de cuán vigorosamente hierva.
La temperatura de una muestra no cambia durante un cambio de fase.
Si se agrega calor a una velocidad constante, como en la figura \(\pageIndex{3}\), entonces la longitud de las líneas horizontales, que representa el tiempo durante el cual la temperatura no cambia, es directamente proporcional a la magnitud de las entalpías asociadas con los cambios de fase. En la figura \(\pageIndex{3}\), la línea horizontal a 100 ° C es mucho más larga que la línea a 0°C porque la entalpía de vaporización de agua es varias veces mayor que la entalpía de fusión.
Un líquido sobrecalentado es una muestra de un líquido a la temperatura y presión a la que debe ser un gas. Los líquidos sobrecalentados no son estables; el líquido eventualmente hervirá, a veces violentamente. El fenómeno de sobrecalentamiento provoca «golpes» cuando se calienta un líquido en el laboratorio. Por ejemplo, cuando un tubo de ensayo que contiene agua se calienta sobre un quemador Bunsen, una porción del líquido puede calentarse demasiado fácilmente. Cuando el líquido sobrecalentado se convierte en gas, puede empujar o «golpear» el resto del líquido fuera del tubo de ensayo. Colocar una varilla de agitación o una pequeña pieza de cerámica (una «viruta hirviendo») en el tubo de ensayo permite que se formen burbujas de vapor en la superficie del objeto para que el líquido hierva en lugar de sobrecalentarse. El sobrecalentamiento es la razón por la que un líquido calentado en una taza lisa en un horno de microondas puede no hervir hasta que la taza se mueva, cuando el movimiento de la taza permite que se formen burbujas.