Punto de ebullición
A medida que se calienta un líquido, aumenta la energía cinética media de sus partículas. La velocidad de evaporación aumenta a medida que más y más moléculas son capaces de escapar de la superficie del líquido a la fase de vapor. Finalmente, se alcanza un punto en el que las moléculas de todo el líquido tienen suficiente energía cinética para vaporizarse. En este punto, el líquido comienza a hervir. El punto de ebullición es la temperatura a la que la presión de vapor de un líquido es igual a la presión externa. La siguiente figura ilustra la ebullición del líquido.
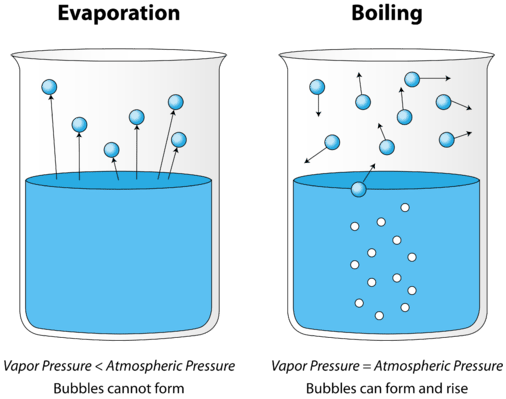
En la imagen de la izquierda, el líquido está por debajo de su punto de ebullición, pero parte del líquido se evapora. A la derecha, se ha aumentado la temperatura hasta que comienzan a formarse burbujas en el cuerpo del líquido. Cuando la presión de vapor dentro de la burbuja es igual a la presión atmosférica externa, las burbujas suben a la superficie del líquido y estallan. La temperatura a la que se produce este proceso es el punto de ebullición del líquido.
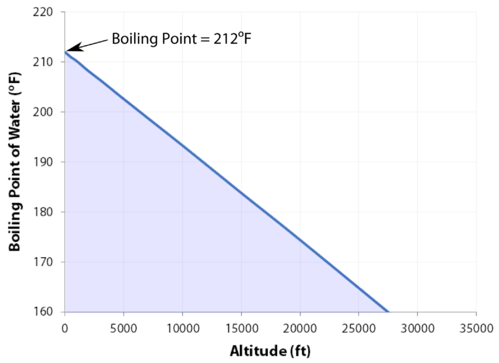
El punto de ebullición normal es la temperatura a la que la presión de vapor del líquido es igual a la presión estándar. Debido a que la presión atmosférica puede cambiar según la ubicación, el punto de ebullición de un líquido cambia con la presión externa. El punto de ebullición normal es una constante porque se define en relación con la presión atmosférica estándar de \(760\: \ text{mm} \:\ ce{Hg}\) (o \ (1\:\ text{atm}\) o \ (101.3\:\text{kPa}\)).