Las reacciones Redox tienen que ver con la transferencia de electrones de una sustancia a otra, por lo que es útil tener un sistema para realizar un seguimiento de lo que gana y lo que pierde electrones, y cuántos electrones están involucrados. El sistema de registro de reacciones redox se llama Números de oxidación. También puede recordar algo llamado electronegatividad de clases de química anteriores.
Electronegatividad
La capacidad de un átomo unido para atraer electrones compartidos hacia sí mismo.
Cuando dos átomos de diferentes elementos están unidos entre sí por un enlace covalente (electrones compartidos), los electrones generalmente no se comparten por igual entre los dos átomos debido a las diferencias en sus electronegatividades. Piensa en esto como un tira y afloja de electrones. A veces, ambos átomos tiran con la misma fuerza de los electrones compartidos; otras veces, claramente hay un jugador más fuerte que atraerá los electrones más cerca de sí mismo.
Considere el enlace entre un átomo de hidrógeno (con un electrón de valencia) y un átomo de oxígeno (con sus seis electrones de valencia):
|
|
+
|
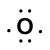 |
=
|
 |
Because oxygen has a higher electronegativity than hydrogen, the shared electrons are closer to the oxygen atom than to el átomo de hidrógeno. Esta no es la transferencia total de electrones que crearía un ion, sino que se forman cargas parciales. El extremo de hidrógeno del enlace es parcialmente positivo (+1) porque ha perdido parcialmente un electrón, y el extremo de oxígeno del H–O es parcialmente negativo (-1) porque ha ganado parcialmente un electrón del hidrógeno:
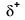 |
|
 |
|
Our molecule is incomplete, however, because there is a lone electron around oxygen. Let’s add one more hydrogen to complete our water molecule:
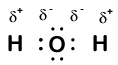
Vemos que cada uno de los dos hidrógenos ha «perdido» un electrón en oxígeno. El oxígeno ha «ganado» dos electrones, uno de cada hidrógeno. Una vez más, estos no son iones verdaderos, pero es útil pensar en ellos de la misma manera.
Las cargas dadas a los átomos en una molécula de esta manera se llaman números de oxidación. Podemos usar números de oxidación para hacer un seguimiento de dónde están los electrones en una molécula y cómo se mueven durante una reacción. En nuestro ejemplo de agua, al hidrógeno se le asigna un número de oxidación de +1 porque cada hidrógeno individual ha «perdido» un electrón. El oxígeno tiene un número de oxidación de + 2 porque el átomo de oxígeno individual ha «ganado» un total de dos electrones, uno de cada hidrógeno.
Aquí hay otra molécula que involucra hidrógeno y oxígeno-peróxido de hidrógeno, H2O2:
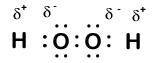
En el peróxido de hidrógeno, cada hidrógeno todavía tiene un número de oxidación de + 1 porque cada hidrógeno » da » un solo electrón al oxígeno. El oxígeno, sin embargo, ahora tiene un número de oxidación de -1 porque cada oxígeno gana solo un electrón de su hidrógeno vecino. Los electrones entre los dos átomos de oxígeno idénticos se comparten por igual, por lo que no hay carga parcial resultante de ese enlace.
Número de oxidación
Un número positivo o negativo asignado a un átomo en una molécula o ion que refleja una ganancia o pérdida parcial de electrones.
Conocer el número de oxidación de cada elemento individual de una molécula será un paso clave en nuestra comprensión de las reacciones redox. Afortunadamente, no suele implicar dibujar diagramas de puntos de electrones. En cambio, hay una serie de reglas que podemos usar para determinar los números de oxidación. Aquí están las reglas principales:
| El número de oxidación de un elemento puro (por sí misma, y no un ion) es cero. |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
The oxidation number of a monatomic ion (by itself or as part of an ionic compound) is equal a su cargo. Los metales alcalinos-elementos en la primera columna de la tabla periódica – siempre tendrán un número de oxidación de +1; los metales alcalinotérreos (columna 2) son casi siempre +2. |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| The oxidation number of hydrogen is almost always +1 when it is in a compound. |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
El número de oxidación del oxígeno es casi siempre de -2 cuando está en un compuesto. Las excepciones:
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
La suma de los números de oxidación en un compuesto es igual a cero. Para determinar el número de oxidación de Mn en Mn2O7, debemos trabajar hacia atrás:
-2 × 7 átomos = -14 total Dado que la suma de los números de oxidación debe ser cero, el número de oxidación total de Mn debe ser +14 para cancelar el -14 de oxígeno, pero como hay 2 átomos de Mn, cada átomo individual tendrá un número de oxidación de + 7:
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
La suma de los números de oxidación en un ion poliatómico es igual a la carga en ese ion. De nuevo, trabaje hacia atrás para determinar el número de oxidación de cualquier átomo sin oxígeno o sin hidrógeno. Para determinar el número de oxidación del Cr en Cr2O72- :
-2 × 7 = -14
+12 + (-14) = -2
= +7
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
It is es importante tener en cuenta que el número de oxidación siempre se refiere a cada átomo individual en el compuesto, no al total de ese elemento.
Por ejemplo, en H2O, la «carga» positiva total para ambos átomos de hidrógeno será +2 (que se equilibra con el -2 del oxígeno), pero cada hidrógeno tiene un número de oxidación de +1.
Contribuciones& Atribuciones
Esta página se construyó a partir del contenido a través de los siguientes colaboradores y fue editada (tópica o extensamente) por el equipo de desarrollo de LibreTexts para cumplir con el estilo, la presentación y la calidad de la plataforma:
-
Fundación CK-12 por Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson y Jean Dupon.