Objetivos de aprendizaje
- Utilice la notación celular para describir células galvánicas
- Describir los componentes básicos de las células galvánicas\
Las células galvánicas, también conocidas como células voltaicas, son células electroquímicas en las que las reacciones espontáneas de oxidación-reducción producen energía eléctrica. Al escribir las ecuaciones, a menudo es conveniente separar las reacciones de oxidación-reducción en semi-reacciones para facilitar el equilibrio de la ecuación general y enfatizar las transformaciones químicas reales.
Considere lo que sucede cuando se coloca una pieza limpia de metal de cobre en una solución de nitrato de plata (Figura \(\pageIndex{1}\)). Tan pronto como se agrega el metal de cobre, el metal plateado comienza a formarse y los iones de cobre pasan a la solución. El color azul de la solución en el extremo derecho indica la presencia de iones de cobre. La reacción puede dividirse en dos semirreacciones. Las semi-reacciones separan la oxidación de la reducción, por lo que cada una puede considerarse individualmente.
La ecuación para la media reacción de reducción tuvo que duplicarse para que el número de electrones «ganados» en la media reacción de reducción equivaliera al número de electrones «perdidos» en la media reacción de oxidación.

Las células galvánicas o voltaicas implican reacciones electroquímicas espontáneas en las que las semirreacciones están separadas (Figura \(\pageIndex{2}\)) para que la corriente pueda fluir a través de un cable externo. El vaso de precipitados en el lado izquierdo de la figura se llama media celda y contiene una solución de 1 M de nitrato de cobre(II) con un trozo de metal de cobre parcialmente sumergido en la solución. El metal de cobre es un electrodo. El cobre está sufriendo oxidación; por lo tanto, el electrodo de cobre es el ánodo. El ánodo está conectado a un voltímetro con un cable y el otro terminal del voltímetro está conectado a un electrodo de plata por un cable. La plata se está reduciendo; por lo tanto, el electrodo de plata es el cátodo. La media celda en el lado derecho de la figura consiste en el electrodo de plata en una solución de 1 M de nitrato de plata (AgNO3). En este punto, no fluye corriente, es decir, no se produce un movimiento significativo de electrones a través del cable porque el circuito está abierto. El circuito se cierra mediante un puente salino, que transmite la corriente con iones en movimiento. El puente salino consiste en una solución electrolítica concentrada, no reactiva, como la solución de nitrato de sodio (NaNO3) utilizada en este ejemplo. A medida que los electrones fluyen de izquierda a derecha a través del electrodo y el alambre, los iones de nitrato (aniones) pasan a través del tapón poroso de la izquierda hacia la solución de nitrato de cobre(II). Esto mantiene el vaso de precipitados a la izquierda eléctricamente neutro neutralizando la carga de los iones de cobre(II) que se producen en la solución a medida que se oxida el metal de cobre. Al mismo tiempo, los iones de nitrato se mueven hacia la izquierda, los iones de sodio (cationes) se mueven hacia la derecha, a través del tapón poroso, y hacia la solución de nitrato de plata a la derecha. Estos cationes añadidos «reemplazan» los iones de plata que se eliminan de la solución a medida que se reducen a metal plateado, manteniendo el vaso de precipitados a la derecha eléctricamente neutro. Sin el puente de sal, los compartimentos no permanecerían eléctricamente neutros y no fluiría corriente significativa. Sin embargo, si los dos compartimentos están en contacto directo, no es necesario un puente salino. En el instante en que se completa el circuito, el voltímetro lee +0,46 V, esto se llama potencial de celda. El potencial celular se crea cuando los dos metales diferentes están conectados, y es una medida de la energía por unidad de carga disponible de la reacción de oxidación-reducción. El voltio es la unidad SI derivada para el potencial eléctrico
\
En esta ecuación, A es la corriente en amperios y C la carga en culombios. Tenga en cuenta que los voltios deben multiplicarse por la carga en culombios (C) para obtener la energía en julios (J).
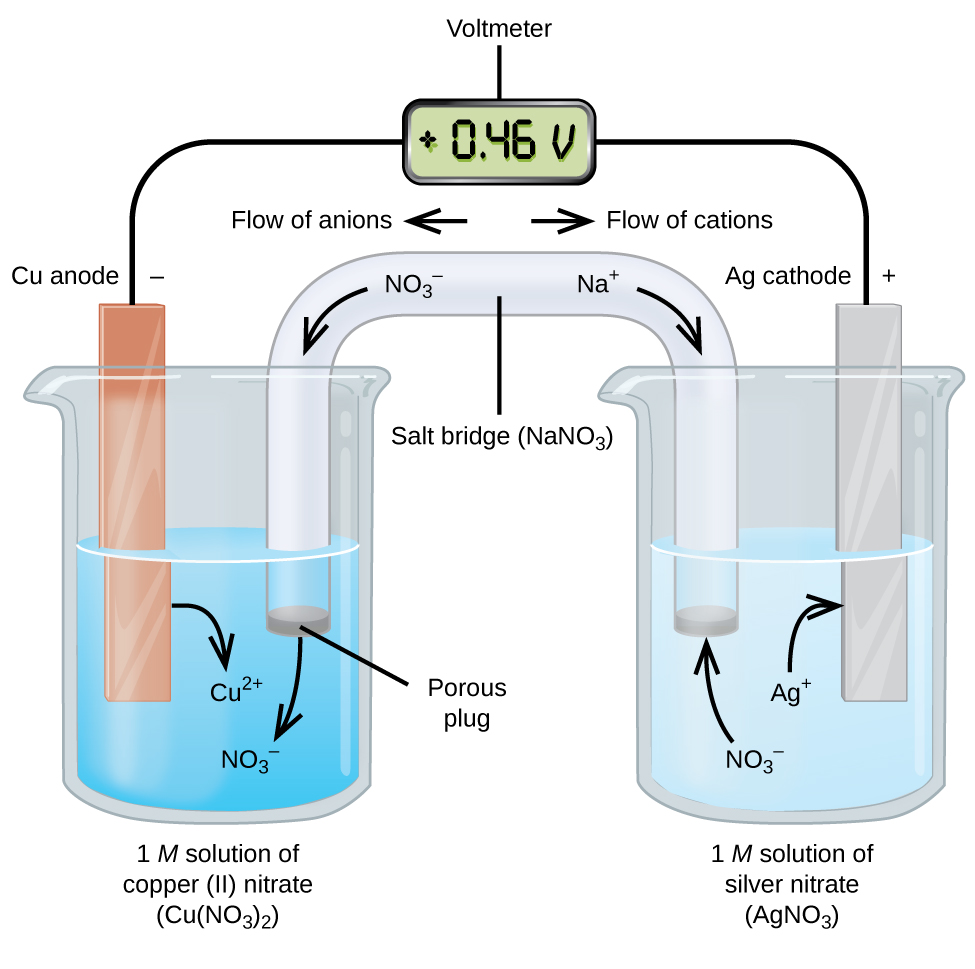
Cuando la célula electroquímica se construye de esta manera, un potencial celular positivo indica una reacción espontánea y que los electrones fluyen de izquierda a derecha. Hay muchas cosas en la figura \(\pageIndex{2}\), por lo que es útil resumir las cosas para este sistema:
- Los electrones fluyen del ánodo al cátodo: de izquierda a derecha en la celda galvánica estándar de la figura.
- El electrodo en la media celda izquierda es el ánodo porque la oxidación ocurre aquí. El nombre se refiere al flujo de aniones en el puente salino hacia él.
- El electrodo en la media celda derecha es el cátodo porque la reducción se produce aquí. El nombre se refiere al flujo de cationes en el puente de sal hacia él.
- La oxidación se produce en el ánodo (la media celda izquierda en la figura).
- La reducción se produce en el cátodo (la media celda derecha de la figura).
- El potencial celular, +0,46 V, en este caso, es el resultado de las diferencias inherentes en la naturaleza de los materiales utilizados para hacer las dos semiceldas.
- El puente de sal debe estar presente para cerrar (completar) el circuito y tanto una oxidación como una reducción deben ocurrir para que la corriente fluya.
Hay muchas celdas galvánicas posibles, por lo que generalmente se usa una notación taquigráfica para describirlas. La notación de celdas (a veces llamada diagrama de celdas) proporciona información sobre las diversas especies involucradas en la reacción. Esta notación también funciona para otros tipos de celdas. Una línea vertical,│, denota un límite de fase y una línea doble,‖, el puente de sal. La información sobre el ánodo se escribe a la izquierda, seguida de la solución de ánodo, luego el puente salino (cuando esté presente), luego la solución de cátodo y, finalmente, la información sobre el cátodo a la derecha. La notación de celda para la celda galvánica en la Figura \(\pageIndex{2}\) es entonces
\
Tenga en cuenta que los iones espectador no están incluidos y que se utilizó la forma más simple de cada media reacción. Cuando se conocen, se suelen incluir las concentraciones iniciales de los diversos iones.
Una de las células más simples es la célula de Daniell. Es posible construir esta batería colocando un electrodo de cobre en la parte inferior de un frasco y cubriendo el metal con una solución de sulfato de cobre. Se coloca una solución de sulfato de zinc encima de la solución de sulfato de cobre; luego se coloca un electrodo de zinc en la solución de sulfato de zinc. La conexión del electrodo de cobre al electrodo de zinc permite que fluya una corriente eléctrica. Este es un ejemplo de una célula sin un puente salino, y los iones pueden fluir a través de la interfaz entre las dos soluciones.
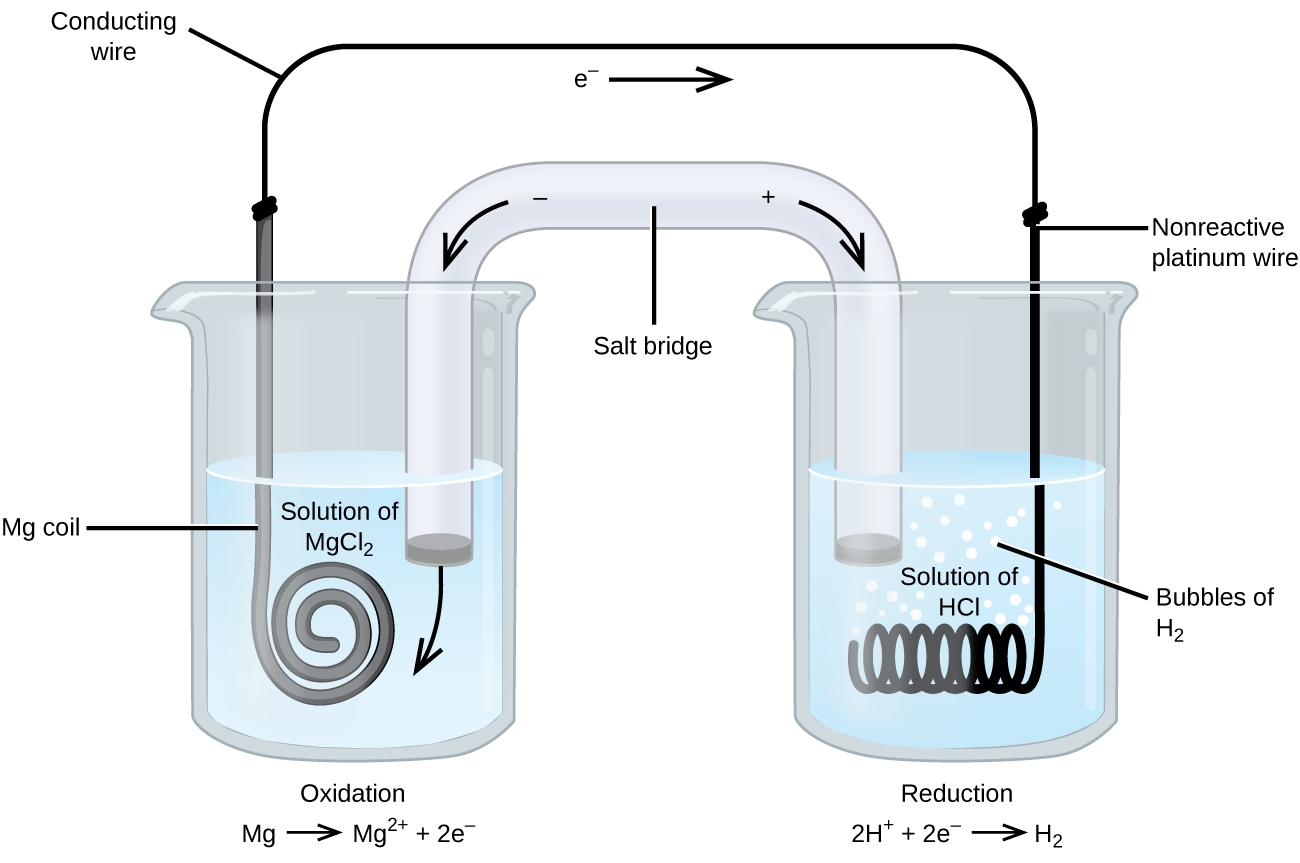
Algunas reacciones de oxidación-reducción involucran especies que son conductores pobres de electricidad, por lo que se utiliza un electrodo que no participa en las reacciones. Con frecuencia, el electrodo es de platino, oro o grafito, todos los cuales son inertes a muchas reacciones químicas. Uno de estos sistemas se muestra en la figura \(\pageIndex{3}\). El magnesio se oxida en el ánodo de la izquierda en la figura y los iones de hidrógeno se reducen en el cátodo de la derecha. La reacción se puede resumir como
La célula utilizó un cable de platino inerte para el cátodo, por lo que la notación de la célula es
El electrodo de magnesio es un electrodo activo porque participa en la reacción de oxidación-reducción. Los electrodos inertes, como el electrodo de platino en la Figura \(\pageIndex{3}\), no participan en la reacción de oxidación-reducción y están presentes para que la corriente pueda fluir a través de la célula. El platino o el oro generalmente hacen buenos electrodos inertes porque no son químicamente reactivos.
Ejemplo \(\pageIndex{1}\): Usando Notación de celda
Considere una celda galvánica que consiste en
\
Escribir las semi-reacciones de oxidación y reducción y escribir la reacción usando notación de celda. ¿Qué reacción ocurre en el ánodo? El cátodo?
Solución
Mediante inspección, el Cr se oxida cuando se pierden tres electrones para formar Cr3+, y el Cu2+ se reduce a medida que gana dos electrones para formar Cu. Equilibrar la carga da
\
La notación de celda utiliza la forma más simple de cada una de las ecuaciones, y comienza con la reacción en el ánodo. No se especificaron concentraciones, por lo que:
\
La oxidación se produce en el ánodo y la reducción en el cátodo.
Ejemplo \(\pageIndex{2}\): Usando Notación de celda
Considere una celda galvánica que consiste en
Escriba las semi-reacciones de oxidación y reducción y escriba la reacción usando notación de celda. ¿Qué reacción ocurre en el ánodo? El cátodo?Solución
Por inspección, el Fe2+ sufre oxidación cuando se pierde un electrón para formar Fe3+, y el MnO4-se reduce a medida que gana cinco electrones para formar Mn2+. Equilibrar la carga da
\
La notación de celda utiliza la forma más simple de cada una de las ecuaciones, y comienza con la reacción en el ánodo. Es necesario utilizar un electrodo inerte, como el platino, porque no hay metal presente para conducir los electrones del ánodo al cátodo. No se especificaron concentraciones, por lo que:
\
La oxidación se produce en el ánodo y la reducción en el cátodo.
Ejercicio \(\pageIndex{1}\)
Use la notación de celdas para describir la celda galvánica donde los iones de cobre(II) se reducen a cobre metal y el metal de zinc se oxida a iones de zinc.
Respuesta
De la información dada en el problema:
\
Usando notación de celda:
\
Resumen
Las celdas electroquímicas típicamente consisten en dos semicelulas. Las semiceldas separan la media reacción de oxidación de la media reacción de reducción y hacen posible que la corriente fluya a través de un cable externo. Una media celda, normalmente representada en el lado izquierdo en una figura, contiene el ánodo. La oxidación se produce en el ánodo. El ánodo está conectado al cátodo en la otra media celda, a menudo se muestra en el lado derecho en una figura. La reducción se produce en el cátodo. La adición de un puente de sal completa el circuito permitiendo que la corriente fluya. Los aniones en el puente salino fluyen hacia el ánodo y los cationes en el puente salino fluyen hacia el cátodo. El movimiento de estos iones completa el circuito y mantiene cada media celda eléctricamente neutra. Las celdas electroquímicas se pueden describir usando notación de celdas. En esta notación, la información sobre la reacción en el ánodo aparece a la izquierda y la información sobre la reacción en el cátodo a la derecha. El puente de sal está representado por una línea doble,‖. Las fases sólidas, líquidas o acuosas dentro de una media celda están separadas por una sola línea, │. La fase y la concentración de las diversas especies se incluyen después del nombre de la especie. Los electrodos que participan en la reacción de oxidación-reducción se denominan electrodos activos. Los electrodos que no participan en la reacción de oxidación-reducción, pero que están ahí para permitir que fluya la corriente, son electrodos inertes. Los electrodos inertes a menudo están hechos de platino u oro, que no se modifican por muchas reacciones químicas.
Glosario
electrodo activo electrodo que participa en la reacción de oxidación-reducción de una celda electroquímica; la masa de un electrodo activo cambia durante la reacción de oxidación-reducción electrodo de ánodo en una celda electroquímica en la que se produce la oxidación; la información sobre el ánodo se registra en el lado izquierdo del puente de sal en notación de celda electrodo de cátodo en una celda electroquímica en la que se produce la reducción; la información sobre el cátodo se registra en el lado derecho del puente de sal en notación de celda forma abreviada de notación de celda para representar las reacciones en una celda electroquímica diferencia de potencial de celda en el potencial eléctrico que surge cuando se conectan metales diferentes; la fuerza impulsora para el flujo de carga (corriente) en reacciones de oxidación-reducción celda galvánica celda electroquímica que involucra una reacción espontánea de oxidación-reducción; celdas electroquímicas con potenciales celulares positivos; también llamada electrodo inerte de celda voltaica electrodo que permite que la corriente fluya, pero que de otro modo no participa en la reacción de oxidación-reducción en una celda electroquímica; la masa de un electrodo inerte no cambia durante la reacción de oxidación-reducción; los electrodos inertes a menudo están hechos de platino u oro porque estos metales no son químicamente reactivos. célula voltaica otro nombre para una célula galvánica
Colaboradores y atribuciones
-
Paul Flowers (Universidad de Carolina del Norte-Pembroke), Klaus Theopold (Universidad de Delaware) y Richard Langley (Universidad Estatal Stephen F. Austin) con autores colaboradores. El contenido de libros de texto producido por OpenStax College está licenciado bajo una licencia Creative Commons Attribution License 4.0. Descarga gratuita en http://cnx.org/contents/85abf193-2bd…[email protected]).