Siguiente: 3.4 Refrigerador y Calor Arriba: 3. La Primera Ley Anterior: 3.2 Representación Generalizada del Índice de Contenidos
Un ciclo de Carnot se muestra en la Figura 3.4. Tiene cuatro procesos. Hay dos patas reversibles adiabáticas y dos patas reversibles térmicas. Podemos construir un ciclo de Carnot con muchos sistemas diferentes, pero los conceptos se pueden mostrar utilizando un fluido de trabajo familiar, el gas ideal. El sistema puede considerarse como una cámara encerrada por un pistón y llena con este gas ideal.
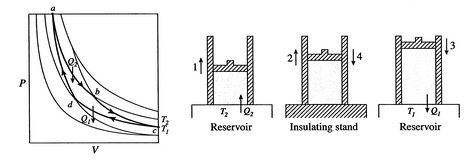
Los cuatro procesos en el ciclo de Carnot son:
- El sistema está a temperatura
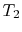 en el estado
en el estado  . Se produce en contacto con un depósito de calor, que es solo una masa líquida o sólida de una extensión lo suficientemente grande como para que su temperatura no cambie apreciablemente cuando se transfiere cierta cantidad de calor al sistema. En otras palabras, el depósito de calor es una fuente de temperatura constante (o receptor) de calor. A continuación, el sistema se somete a anisothermal expansión de
. Se produce en contacto con un depósito de calor, que es solo una masa líquida o sólida de una extensión lo suficientemente grande como para que su temperatura no cambie apreciablemente cuando se transfiere cierta cantidad de calor al sistema. En otras palabras, el depósito de calor es una fuente de temperatura constante (o receptor) de calor. A continuación, el sistema se somete a anisothermal expansión de  a
a 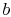 , con el calor absorbido
, con el calor absorbido 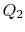 .
. - Atstate
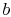 , el sistema está aislado térmicamente (se elimina del contacto con el depósito de calor) y luego se deja expandir a
, el sistema está aislado térmicamente (se elimina del contacto con el depósito de calor) y luego se deja expandir a 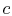 . Durante esta expansión, la temperatura disminuye a
. Durante esta expansión, la temperatura disminuye a 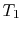 . El intercambiador de calor durante esta parte del ciclo,
. El intercambiador de calor durante esta parte del ciclo, 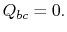 )
) - En el estado
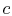 el sistema está en contacto con un depósito de calor a temperatura
el sistema está en contacto con un depósito de calor a temperatura 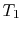 . Es isthen comprimido a estado
. Es isthen comprimido a estado 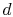 , rechazando calor
, rechazando calor 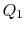 en el proceso.
en el proceso. - Finalmente, el sistema se comprime adiabáticamente de nuevo al estado inicial
 . El intercambio de calor
. El intercambio de calor 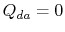 .
.
La eficiencia térmica del ciclo está dado por la definición
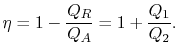 |
(3..4) |
En esta ecuación, hay una convención de signos implícita. Las cantidades![]()
![]() como se define son las magnitudes del calor absorbido andrejected. Las cantidades
como se define son las magnitudes del calor absorbido andrejected. Las cantidades ![]()
![]() en el otro lado están definedwith referencia al calor recibido por el sistema. En este ejemplo, elformador es negativo y el segundo es positivo. El calor absorbido y proyectado por el sistema tiene lugar durante los procesos isotérmicos y ya sabemos cuáles son sus valores a partir de la Ec.(3.1):
en el otro lado están definedwith referencia al calor recibido por el sistema. En este ejemplo, elformador es negativo y el segundo es positivo. El calor absorbido y proyectado por el sistema tiene lugar durante los procesos isotérmicos y ya sabemos cuáles son sus valores a partir de la Ec.(3.1):
La eficiencia ahora se puede escribir en términos de volúmenes en los diferentes estados como
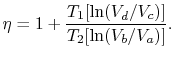 |
(3..5) |
The path from states ![]() to
to ![]() and from
and from ![]() to
to ![]() are bothadiabatic and reversible. For a reversible adiabatic process we knowthat
are bothadiabatic and reversible. For a reversible adiabatic process we knowthat ![]() . Using the ideal gas equation ofstate, we have
. Using the ideal gas equation ofstate, we have ![]() . Along curve
. Along curve![]()
![]() , therefore,
, therefore, ![]() . Alongthe curve
. Alongthe curve ![]()
![]()
![]() . Thus,
. Thus,

Comparing the expression for thermal efficiencyEq. (3.4) with Eq. (3.5) muestra dos consecuencias. En primer lugar, los calores recibidos y rechazados se relacionan con las temperaturas de las partes isotérmicas del ciclo por
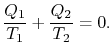 |
(3..6) |
en Segundo lugar, la eficiencia de un ciclo de Carnot se da de forma compacta por
 |
(3..7) |
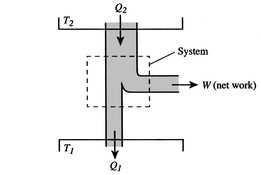
La eficiencia puede ser del 100% solo si la temperatura a la que se rechaza el calor es cero. Las transferencias de calor y trabajo hacia y desde el sistema se muestran esquemáticamente en la figura 3.5.
Barro Puntos
Desde ![]() , busca en la etiqueta
, busca en la etiqueta ![]()
![]() gráfico, doesthat significa el más separados, el
gráfico, doesthat significa el más separados, el ![]()
![]() isotermas son, thegreater eficiencia? Y que si estaban muy cerca, sería muy ineficiente? (MP 3.2)
isotermas son, thegreater eficiencia? Y que si estaban muy cerca, sería muy ineficiente? (MP 3.2)
En el ciclo de Carnot, ¿por qué solo tratamos con cambios de volumen y no cambios de presión en los adiabats e isotermas?(MP 3.3)
¿Existe una aplicación física para el ciclo de Carnot? ¿Podemos diseñar un motor Carnot para un dispositivo de propulsión?(MP 3.4)
¿Cómo sabemos qué ciclos usar como modelos para procesos reales?(MP 3.5)
Siguiente: 3.4 Refrigerador y Calor Arriba: 3. La Primera Ley Anterior: 3.2 Representación generalizada del Índice de Contenidos
UnifiedTP