¿Cuál es el potencial redox de una célula?
Modo de lectura
Los potenciales Redox se utilizan para caracterizar el costo de energía libre y la dirección de las reacciones que involucran transferencia de electrones, una de las reacciones bioquímicas más ubicuas e importantes. Tales reacciones de reducción-oxidación se caracterizan por un cambio de energía libre que comparte algunas características conceptuales con las utilizadas para describir el pKa en reacciones ácido-base en las que está involucrada la transferencia de protones en lugar de la transferencia de electrones. En esta viñeta, una de las más abstractas del libro, discutimos cómo se puede usar el potencial redox como medida de la fuerza impulsora de una reacción de oxidación-reducción de interés dada. A modo de contraste, a diferencia del pH, no hay sentido en el que uno pueda asignar un solo potencial redox a una célula entera.
El potencial redox, o más exactamente el potencial de reducción, de un compuesto se refiere a su tendencia a adquirir electrones y, por lo tanto, a ser reducido. Algunos lectores pueden recordar la mnemotécnica » OILRIG «que nos recuerda que» la oxidación es pérdida, la reducción es ganancia», donde la pérdida y la ganancia son de electrones. Considere una reacción que implica una transferencia de electrones: Aox + ne – ↔ Ared donde n electrones son absorbidos por la forma oxidada (Aox) para dar la forma reducida (Ared) del compuesto A. La diferencia de potencial redox ΔE entre el donante y el aceptor de electrones está relacionada con el cambio de energía libre asociado ΔG de la reacción a través de ΔG = nFΔE, donde n es el número de electrones transferidos y F es la constante de Faraday (96.485 J / mol / V o ≈100 kJ / mol / V). Al inspeccionar los valores tabulados de estos potenciales, es posible desarrollar una intuición de la tendencia a la transferencia de electrones y, por lo tanto, de la dirección de la reacción.

Figura 1: Una «torre redox» que muestra el potencial redox de las reacciones metabólicas medias comunes. Los procesos metabólicos pueden verse como electrones en movimiento entre moléculas, a menudo capturando parte de la energía liberada a medida que los electrones se mueven de estados de alta energía a estados de energía más baja, como en la glucólisis o la respiración. Los electrones donados por las» semi-reacciones » en la parte superior se pueden consumir en una semi-reacción más baja en la torre para completar una reacción termodinámicamente favorable. Por ejemplo, el proceso neto de glucólisis implica la oxidación de glucosa a piruvato junto con la reducción de NAD+ a NADH. Dado que la oxidación de la glucosa se encuentra en la parte superior de la torre y la reducción de NAD+ está por debajo de ella, este flujo de electrones es termodinámicamente favorable. En comparación con la barra de escala de hidrólisis de ATP, también podemos ver que este flujo de electrones es lo suficientemente favorable para generar ATP. La respiración aeróbica implica muchas transferencias intermedias de electrones a través de la cadena de transporte de electrones. Se muestran varias de estas transiciones, incluyendo el succinato de oxidación a fumarato que está acoplado mecánicamente a la reducción de ubiquinona a ubiquinol en las membranas mitocrondriales internas. Cada una de estas transferencias intermedias de electrones debe ser termodinámicamente favorable por sí sola para que la respiración proceda. Al comparar con la «escala de hidrólisis de ATP», podemos ver que las transformaciones individuales en la cadena de transporte de electrones no son lo suficientemente energéticas como para generar ATP por sí solas. Sin embargo, son lo suficientemente favorables para bombear un protón a través de la célula o la membrana mitocondrial. Esta es la base energética de la quimiosmosis: las células almacenan cuantos de energía demasiado pequeños para la síntesis de ATP en el gradiente de protones a través de una membrana. Esa energía se usa más tarde para generar ATP al convertir el gradiente H+ en enlaces de fosfoanhidruro en ATP a través de la ATP sintasa.
Aunque a menudo se afirma que el ATP es la moneda de energía de la célula, de hecho, para el equilibrio energético de la célula, los portadores de potencia reductora no son menos importantes. El ejemplo más importante de estos portadores es la molécula NADH en sus formas reducidas u oxidadas (NAD+). Podemos utilizar el potencial redox para conectar estos dos protagonistas moleculares, y estimar un límite superior en el número de moléculas de ATP que se pueden producir a partir de la oxidación del NADH (producido, por ejemplo, en el ciclo de TCA). El par NAD+/NADH tiene un potencial redox de E = -0,32 V y es oxidado por el oxígeno para dar agua (protones procedentes de los medios) con un potencial redox de E = +0,82 V. Ambos se muestran en la Figura 1 como parte de una «torre redox» de semireacciones biológicas clave que se pueden vincular para encontrar el cambio de potencial redox general y, por lo tanto, la energía libre. Para la reacción considerada anteriormente de oxidación de NADH por oxígeno, la energía libre máxima asociada que se puede extraer es, por lo tanto,
ΔG = n x F x ΔE = 2 x 100 kJ/(molxV) x (0.82-(-0.32)) V = 230 kJ/mol≈ 90 kBT,
donde n=2 y F≈100kJ/mol/V. Como hidrólisis ATP tiene un cambio de energía libre de ≈50kJ/mol en condiciones fisiológicas encontramos que 228 kJ/mol son suficientes para producir un máximo de 228/50≈4,5 ATPs. En la célula, la oxidación del NADH procede a través de varios pasos en la respiración y resulta en la transferencia de 10 protones a través de la membrana contra el potencial electroquímico (BNID 101773). Estas transferencias de protones corresponden a otra forma de capturar energía bioquímica. Esta energía es utilizada por la ATPasa para producir 2-3 ATPs. Por lo tanto, encontramos que aproximadamente la mitad de la energía que se liberó en la transferencia de electrones del NADH al oxígeno se conserva en ATP. Asegurar que la reacción proceda de manera direccional para producir ATP en lugar de consumirlo requiere que parte de la energía se «desperdicie», ya que el sistema debe estar fuera de equilibrio.
¿Por qué se debe hablar de los potenciales redox de las reacciones medias y no de las energías libres de las reacciones completas? Las unidades mismas deben su origen a la capacidad en el campo de la electroquímica para medir en el laboratorio la diferencia de voltaje, es decir, el potencial medido en voltios, a través de dos cámaras que contienen diferentes portadores de electrones, y para detener la reacción neta con un voltaje. La utilidad de los potenciales redox para las reacciones medias radica en la capacidad de ensamblar combinaciones de diferentes donantes y aceptadores para evaluar la viabilidad termodinámica y la ganancia de energía de cada reacción considerada. Si tiene k compuestos de transferencia de electrones posibles, las reacciones ~k2 posibles se pueden predecir basándose solo en los potenciales redox de k.
Al igual que hablamos del pH de una solución, a primera vista, podríamos imaginar que sería posible hablar de un potencial redox aparentemente análogo de la célula. Conocer la concentración de las formas reducidas y oxidadas de un par de reacciones dado define su potencial redox de grupo a través de la relación
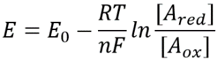
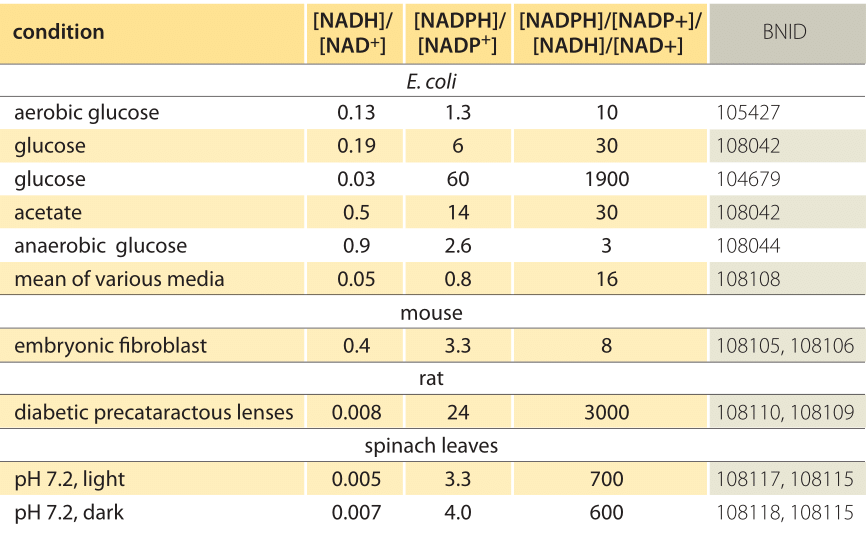
Tabla 1: relaciones de concentración de los pares donantes de electrones comunes NAD/NADH y NADP/NADPH. Como se puede ver, el primero está relativamente oxidado y el segundo relativamente reducido, con una proporción entre ellos generalmente mucho mayor que 1.
Esta ecuación (la llamada ecuación de Nernst) proporciona el valor del potencial redox en condiciones de concentración típicas de la célula en oposición a las condiciones de estado estándar (where by definition =). Como ejemplo, considere la donación de un electrón a NAD + dando como resultado la forma oxidada NADH. En la matriz mitocondrial se reporta una proporción de 10 veces más de la forma oxidada (BNID 100779) como se muestra en la Tabla 1. En este caso, encontramos que el factor es ≈30 mV y, por lo tanto, el potencial redox cambia de -0,32 V a -0,29 V. Para asegurarnos de que la dirección del efecto que obtenemos es sensible, notamos que con una sobreabundancia de la forma oxidada, la tendencia a ser oxidada por el oxígeno es algo menor, como se ve por el hecho de que el potencial redox ahora está más cerca que antes del par de intercambio de electrones oxígeno/agua (+0,82 V).
Una célula no está en equilibrio y hay acoplamiento débil entre diferentes pares redox. Esta situación conduce al establecimiento de diferentes potenciales redox para parejas redox coexistentes en la célula. Si los flujos de producción y utilización de las formas reducidas y oxidadas de un par redox, Ared y Aox y otro Criado y Caja, son mucho más grandes que su flujo de interconversión, Ared+Caja<>Aox+Criado, entonces A y B pueden tener potenciales redox muy diferentes. Como resultado, no está bien definido preguntar sobre el potencial redox general de la célula, ya que será diferente para los diferentes componentes dentro de la célula. A modo de contraste, el pH de la célula (o de algún compartimento en ella) está mucho mejor definido, ya que el agua sirve como el medio universal que acopla las diferentes reacciones ácido-base y equilibra lo que se conoce como el potencial químico de todas las especies.
Para un par redox dado en un compartimento celular dado, la relación de concentración de las dos formas prescribe el potencial redox de una manera bien definida. Los compuestos que intercambian electrones rápidamente estarán en equilibrio relativo y, por lo tanto, compartirán un potencial redox similar. Para ver cómo se desarrollan estas ideas, por lo tanto, es más útil considerar un par redox que participa en muchas reacciones celulares clave y, como resultado, está estrechamente relacionado con el estado redox de muchos compuestos. El glutatión en el citoplasma es un compuesto de este tipo, ya que participa en la reducción y oxidación de los enlaces tioles altamente prevalentes (los que contienen azufre) en los aminoácidos de cisteína de muchas proteínas. El glutatión es un tripéptido (compuesto de 3 aminoácidos), el central una cisteína que puede estar en una forma reducida (GSH) u oxidada donde forma un dímero con una cisteína de otra molécula de glutatión (GSSG). La media reacción para el glutatión es, por lo tanto, 2 x GSH <> GSSG + 2e– + 2H+. La reacción de la otra mitad es a menudo un enlace de azufre que se «abre» en una proteína receptiva, manteniéndose así en forma reducida debido a la acción constante del glutatión. El glutatión también es un jugador dominante en la neutralización de compuestos reactivos que tienen una alta tendencia a arrebatar electrones y, por lo tanto, oxidar otras moléculas. Estos compuestos se fabrican bajo estrés oxidativo, por ejemplo, cuando se alcanza la capacidad de las reacciones de transferencia de electrones de la respiración o la fotosíntesis. Colectivamente llamadas ROS (especies reactivas de oxígeno) pueden crear estragos en la célula y están implicadas en muchos procesos de envejecimiento. El doble papel del glutatión en mantener las proteínas plegadas correctamente y limitar las ROS, así como su concentración relativamente alta y reactividad de transferencia de electrones, lo convierten en el proxy principal para el estado redox de la célula. La concentración de glutatión en la célula es ≈10 mm (BNID 104679, 104704, 111464), lo que lo convierte en el segundo metabolito más abundante en la célula (después del glutamato), asegurando que desempeña un papel dominante como donante de electrones en el control redox de la función proteica. En otras funciones de las células hay otros pares de electrones dominantes. En reacciones anabólicas biosintéticas el par NADP+ / NADPH y en reacciones catabólicas de descomposición es NAD+ / NADH.
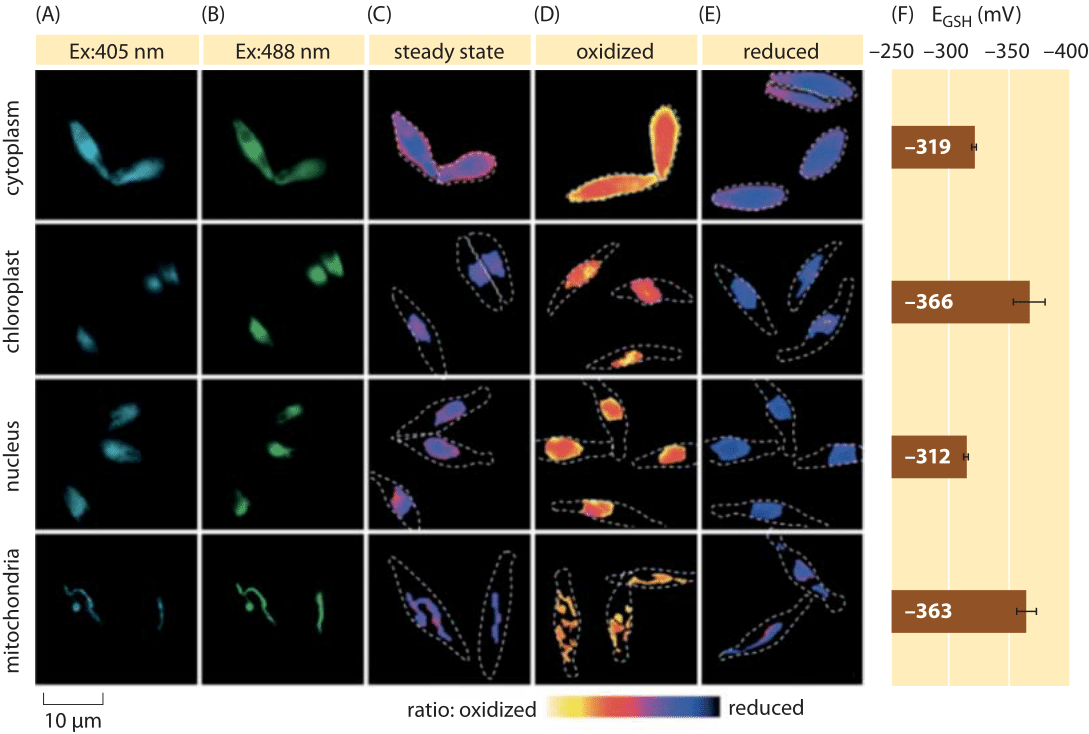
Figura 2: Imagen del potencial redox subcelular de la piscina de glutatión en algas diatomeas in vivo. Imágenes de microscopía de fluorescencia de células de P. tricornutum que expresan roGFP2 en varias localizaciones subcelulares. Las imágenes de fluorescencia a dos longitudes de onda de excitación (A, B) se dividieron para obtener valores ratiométricos (C). Para la calibración, las imágenes ratiométricas se capturan en condiciones de oxidante fuerte (150 mM H2O2) (D) y reductor (1 mm TDT) (E). Las líneas discontinuas representan el contorno de las celdas, dibujadas en función de las imágenes de campo brillante. F) El potencial redox en estado estacionario del grupo de glutatión, EGSH en vM, se calculó sobre la base de la ecuación de Nernst utilizando el nivel de oxidación bajo valores de pH dados para cada orgánulo. Adaptado de: S. Graff van Creveld et al., ISME J., 9: 385, 2015.
¿Cómo se mide el potencial redox en células vivas? Otro beneficiario de la revolución de las proteínas fluorescentes fue el sujeto de los potenciales redox. Un reportero GFP fue diseñado para ser sensible a redox mediante la incorporación de aminoácidos de cisteína que afectan la fluorescencia en función de su reducción por la piscina de glutatión. La Figura 2 muestra el resultado del uso de un reportero de este tipo para observar el potencial redox del glutatión en diferentes compartimentos de una diatomea.
A partir de mediciones del estado redox de la piscina de glutatión en diferentes orgánulos celulares y en condiciones variables, podemos inferir la relación de concentraciones de las formas reducidas a oxidadas. Los valores van desde aproximadamente -170 mV en la sala de emergencias y en las células apoptóticas hasta aproximadamente -300 mV en la mayoría de los otros orgánulos y en las células de proliferación (BNID 103543, 101823, 111456, 111465). Dado que el potencial redox estándar del glutatión es de -240 mV (BNID 111453, 111463), ¿cuál es la proporción de glutatión reducido a oxidado? Usando la ecuación de Nernst (o de forma equivalente, de la distribución de Boltzmann), un cambio de diez veces en la relación producto/reactivo corresponde a un aumento de ≈6 kJ/mol en energía libre (≈2 kBT). Dados los 2 electrones transferidos en la reacción GSH / GSSG, este cambio en la relación de concentración es generalmente igual a 30mV, aunque para el glutatión, la estequiometría de 2 moléculas de GSH que se fusionan en una molécula unida covalentemente a GSSG hace que esto sea solo una aproximación. El cambio de 100 mV reportado a través de las condiciones refleja una relación de concentraciones entre cantidades aproximadamente iguales de las formas reducidas y oxidadas (en células apoptóticas) a más de 1,000 veces más concentración de la forma reducida. De hecho, en la mayoría de las condiciones celulares, la forma oxidada es solo una fracción muy pequeña de la piscina general, pero aún con implicaciones fisiológicas.
Un aspecto confuso de las reacciones redox es que la transferencia puede tomar varias formas. En un caso, son solo electrones, como en las reacciones llevadas a cabo por citocromos en cadenas de transferencia de electrones. En otro caso común, es una combinación de electrones y protones, como en el cofactor NAD+ / NADH, donde se transfieren dos electrones y un protón (H+). Finalmente, están las reacciones en las que se transfiere el mismo número de electrones y protones cuando uno estaría naturalmente tentado a discutir la transferencia de hidrógenos. Este es, por ejemplo, el caso de la reacción general de oxidación de glucosa, donde el oxígeno se reduce a agua. Por lo tanto, se han transferido dos hidrógenos, por lo que se debe discutir la transferencia de electrones, hidrógenos o protones? La definición del potencial redox (dada anteriormente) se centra solo en el «estado» de electrones. ¿Qué pasa con los protones y qué pasa con ellos cuando uno se encuentra con una cadena de reacciones de transferencia de electrones donde algunos compuestos intermedios contienen los protones de hidrógeno y otros no? La explicación reside en el agua circundante y su pH. La reacción ocurre a un pH dado, y los compuestos que reaccionan están en equilibrio con este pH y, por lo tanto, emiten o reciben un protón no tiene efecto sobre la energía. El medio acuoso sirve como una piscina donde los protones pueden «estacionarse» cuando la reacción de transferencia es únicamente de electrones (la analogía tomada del libro introductorio de bioquímica muy accesible «La química de la vida» de Steven Rose). Estos protones estacionados se pueden tomar prestados en etapas posteriores, como ocurre en la etapa final de la respiración oxidativa, donde la citocromo oxidasa toma protones del medio. Debido a que se asume que el agua es ubicua, no es necesario tener en cuenta los protones, excepto para conocer el pH predominante, que representa la tendencia a dar o recibir protones. This is the reason why we discuss electron donors and acceptors rather than hydrogen donors and acceptors.




