Un buen punto de partida para encontrar la configuración electrónica de un ion es la configuración electrónica del átomo neutro.
En su caso, debe encontrar la configuración electrónica del anión fluoruro, # » F «^ ( – )#, así que comience escribiendo la configuración electrónica de un átomo de flúor neutro, # «F»#.
El flúor se encuentra en el período 2, grupo 17 de la tabla periódica y tiene un número atómico de # 9#. Esto te dice que el átomo de flúor neutro tiene un total de #9# electrones rodeando su núcleo.
Su configuración electrónica será
#»F:» 1s^2 2s^2 2p^5#
Ahora, el anión #»F»^(-)# se forma cuando se agrega #1# electrón a un átomo de flúor neutro.
Observe que la subcapa 2p del átomo neutro contiene # 5 # electrones. Su capacidad máxima es en realidad # 6 # electrones, dos electrones para cada orbital p.
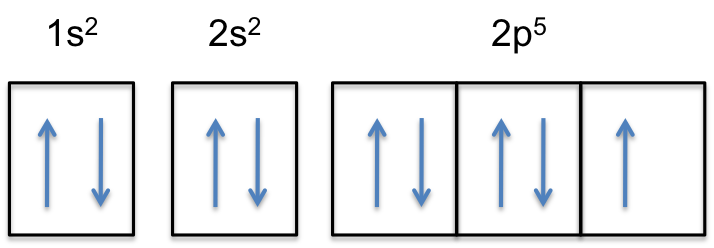
Esto significa que el# color(rojo)(«electrón extra») # se agregará a uno de los tres orbitales 2p, digamos a #2p_y#.
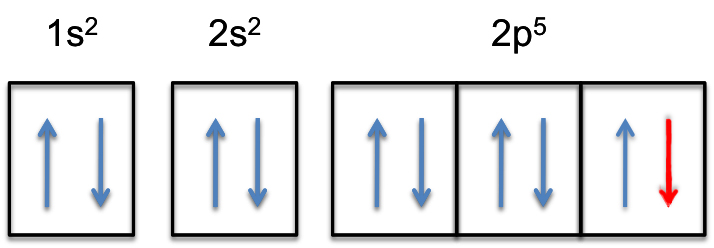
La subcapa 2p ahora estará completamente llena ,es decir, contendrá # 6 # electrones.
La configuración electrónica del anión fluoruro será
#color(verde)(|bar (ul(color(blanco)(a/a)color (negro) («F»^( -):color(blanco)(a) 1s^2color(blanco)(a) 2s^2 color(blanco)(a)2p^6)color(blanco)(a/a)|)))#
Observe que el anión fluoruro tiene un total de #8# electrones en su segunda capa, la capa más externa. Esto te dice que el anión tiene un octeto completo.
Debido a que el anión fluoruro es isoelectrónico con neón, #»Ne»#, puede escribir su configuración electrónica usando la notación abreviada de gas noble como
#»F»^(-): #
Aquí
## – la configuración electrónica de neón