Bien, considere la deslocalización de la densidad electrónica. Es cuando la densidad electrónica se extiende tanto como sea posible a través de una molécula, de modo que la acumulación mínima de carga está presente en un orbital dado.
Que se describe:
- colectivamente por todos los contribuyentes de resonancia en las estructuras de Lewis.
- colectivamente por todas las contribuciones individuales de orbitales moleculares en diagramas de orbitales moleculares.
(Hay sutiles diferencias entre ellos, pero estos son análoga para la simplicidad. Vea aquí para más detalles.)
La localización de densidad electrónica es la falta de eso.
Es cuando metemos toda la densidad electrónica en unos pocos orbitales, en lugar de extenderla, y casi nunca sucede realmente en una molécula real o sistema cuántico (incluso si no hay resonancia).
EJEMPLO CON ESTRUCTURAS DE RESONANCIA
Considere el catión alílico aislado (sin reacción), #»C»_3″H»_5^(+)#.
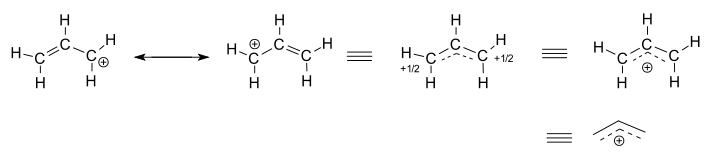
- Las dos estructuras de la izquierda son contribuyentes de resonancia, cada una de las cuales son representaciones localizadas de la verdadera estructura deslocalizada.
- Las tres estructuras de la derecha son representaciones de la estructura híbrida de resonancia, o la estructura deslocalizada.
La estructura deslocalizada se describe básicamente por una colección de orbitales moleculares de unión.
EJEMPLO CON UN DIAGRAMA ORBITAL MOLECULAR
Considere el catión alílico de nuevo en un diagrama MO que SOLO describe los electrones # bbpi# (es decir, los electrones que estarían en un enlace #pi# en un enlace doble localizado!), pero permite la participación en reacciones:
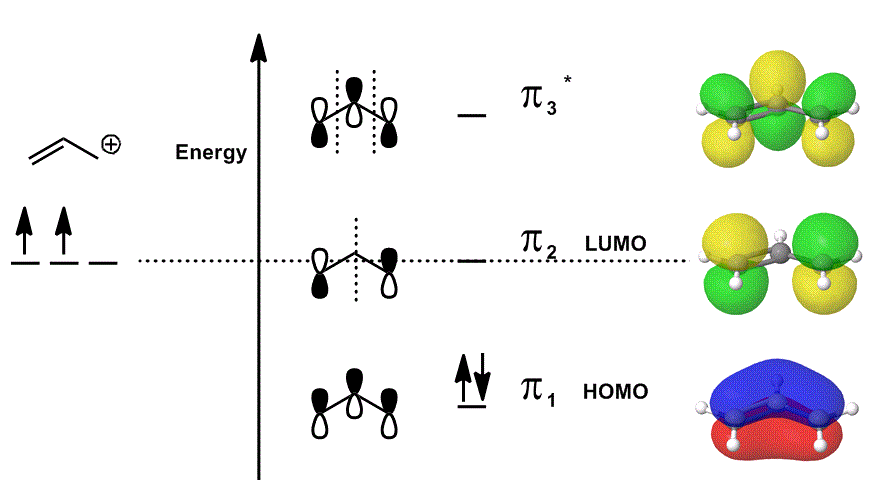
- Cada una de las contribuciones orbitales en el medio se representan localizadas; los orbitales atómicos que se superpondrían se muestran como sí mismos (fase incluida).
- Cada uno de los orbitales del extremo derecho (uno por fila) se representa deslocalizado; se permite que la densidad electrónica se extienda de modo que los orbitales moleculares se representen con una consideración completa de superposiciones, nodos y fases.
Cuando se superpone #pi_1#, # pi_2# y # pi_3^ » * » # e incorpora la contribución ponderada de estos estados (ponderada de acuerdo con los coeficientes #c_i#), se obtiene la combinación lineal de orbitales moleculares:
#Psi_(«alilo»^(+)) = c_1overbrace(pi_1)^»bonding» + c_2overbrace(pi_2)^»nonbonding» + c_3overbrace(pi_3^»*»)^»antibonding»#
y #Psi_(«alilo»^(+))# a continuación, se describe la distribución general de los estados, que en conjunto describen la reactividad del catión alilo.
En otras palabras, #pi_1# (que dona electrones #pi# para unirse), #pi_2# (que acepta electrones para unirse) y #pi_3^»*»# (en este caso, rara vez participará) todos hacen algo cuando el catión alílico participa en una reacción química, porque (si está ocupado), existen al mismo tiempo.