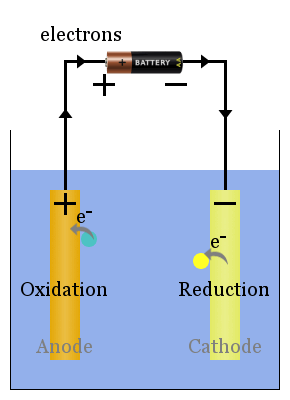
Una célula voltaica, a menudo conocida como célula galvánica, proporciona energía eléctrica. La fuente de esta energía es una reacción química espontánea, más específicamente una reacción redox espontánea.
Por ejemplo, todas las baterías están hechas de una o más celdas voltaicas;las baterías se agotan cuando la mayoría o todos sus reactivos se han convertido en productos, transformando su energía potencial química en energía eléctrica.
Células voltaicas-El Proceso básico
Energía Potencial química → Energía eléctrica
La célula voltaica es uno de los dos tipos básicos de células electroquímicas.El otro tipo es la célula electrolítica; en una célula electrolítica, la energía eléctrica se utiliza para impulsar una reacción química no espontánea.Por ejemplo, el agua se puede dividir en hidrógeno y oxígeno en una celda electrolítica. Además, cuando se recarga una batería recargable, funciona como una celda electrolítica.
Básica de la Célula Voltaica Esquemático

Espontánea de reacciones redox en los electrodos producen un voltaje.Correctamente configurado, este voltaje puede conducir electrones a través de dispositivos eléctricos, como la bombilla que se muestra here.In en este diagrama, las especies transfieren electrones al ánodo desde donde fluyen a través de la bombilla hasta el cátodo, donde producen una reducción.
Básico Celda Electrolítica Esquemático
No-espontánea de reacciones redox son conducidos por un voltaje externo.Los procesos de la célula electrolítica son opuestos a los de la célula voltaica: la corriente de la fuente de energía empuja electrones hacia el cátodo, donde causan la reducción de especies.
Lea más aquí sobre cátodos y ánodos en celdas voltaicas vs electrolíticas.
Ejemplo de una célula voltaica
La batería Edison
La batería Edison es una célula simple y recargable inventada por Thomas Edison.It consta de dos electrodos metálicos, uno de hierro y el otro de níquel.Durante la carga inicial, se forma una capa de óxido de níquel en el electrodo de níquel.
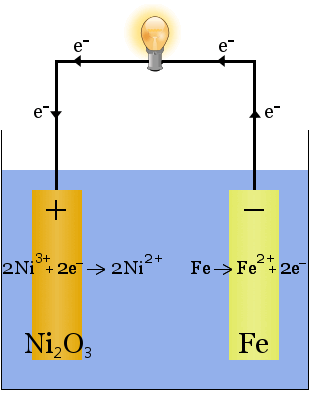
El electrolito (el líquido iónico entre los electrodos) es de 20-30 por ciento en peso de hidróxido de potasio en agua.El papel del hidróxido de potasio en este caso es aumentar la conductividad iónica para completar el circuito eléctrico: el hidróxido de potasio no se consume en la reacción.
Cuando se está descargando, la célula Edison funciona como una célula voltaica.Cuando se está cargando, la célula funciona como una célula electrolítica.
Las ecuaciones químicas para las reacciones en los electrodos son:
Durante la descarga, cuando la célula está suministrando energía eléctrica, las reacciones anteriores proceden a la derecha →.
Durante la carga, cuando la célula está convirtiendo energía eléctrica en energía potencial química, las reacciones anteriores proceden a la izquierda ←.
La celda Edison, con ambos electrodos compartiendo el mismo electrolito, es una de las celdas voltaicas más simples en uso práctico; la mayoría de las células voltaicas son más complicadas.Sus grandes ventajas son su notable robustez frente a errores como la sobrecarga y su larga vida útil, con ciclos de carga y descarga casi ilimitados.
Su mayor desventaja es que, en relación con su producción de energía, es muy pesada.
Otro ejemplo
Baterías de litio
Los avances en la tecnología de baterías han impulsado la miniaturización de dispositivos electrónicos.Sin estos avances, los dispositivos modernos, como los teléfonos celulares y las tabletas, serían más grandes y engorrosos.
En el corazón de estos avances ha estado la tecnología de iones de litio.El elemento litio es un metal de muy baja densidad: a 0,534 g/cm3 el litio es la mitad de denso que el agua; el litio flota en el agua.Compare esto con los metales en la celda de Edison, la densidad del níquel es de 8,908 g/cm3 y la del hierro es de 7,874 g/cm3: estos son más de 10 veces más altos que la densidad del litio.
El alto potencial redox del litio combinado con su baja densidad hace que sus iones sean perfectos para su uso como material de batería.
Una batería de iones de litio típica se basa en electrodos porosos que permiten que los iones de li entren y salgan de sus poros.Por ejemplo, una batería recargable de iones de litio podría tener un electrodo de grafito y un electrodo de óxido de cobalto dopado con litio con un electrolito de polioxietileno que contenga el LiPF6 de sal.
Cuando una batería de este tipo está alimentando un dispositivo, los átomos de litio mantenidos dentro de la estructura de capa del ánodo de grafito se oxidan para convertirse en iones.
En el cátodo, los iones de litio se reducen dentro de la estructura de óxido de cobalto.
These reactions are reversed when the cell is being charged.
