La deslocalización ocurre cuando la carga eléctrica se extiende sobre más de un átomo. Por ejemplo, los electrones de enlace pueden distribuirse entre varios átomos que están unidos entre sí.

Ejemplo 1:
Uno de los ejemplos más conocidos de una molécula en la que los electrones de enlace están deslocalizados es el benceno, que se muestra a continuación:
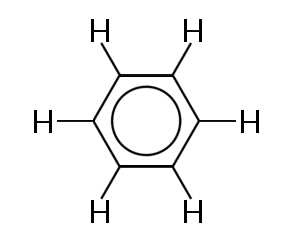
El benceno consiste en un anillo de seis átomos de carbono. Los átomos de carbono son todos sp2 hibridados con un orbital p sin hibridar.
Los orbitales híbridos sp2 producen enlaces covalentes normales, a veces llamados enlaces σ: estos son los enlaces simples C-C y los enlaces simples C-H.
Esto deja a cada carbono con un electrón en un orbital p perpendicular al plano del anillo.
En el diagrama de abajo, a la izquierda se pueden ver los orbitales sp2 formando enlaces covalentes. A la derecha, pueden ver los orbitales p, cada uno de los cuales contiene un electrón.
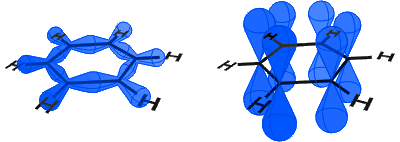
Los orbitales p se combinan de lado a lado y los electrones en los orbitales p se describen como electrones π.
En el diagrama de abajo, los orbitales p se han combinado, y los electrones π están deslocalizados. En promedio, todos los enlaces de anillo son idénticos.
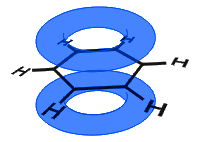
A diferencia del siguiente ejemplo, los electrones deslocalizados en el benceno se mantienen dentro de la molécula y no son libres de moverse a través del material a granel.
Ejemplo 2: Los metales tienen una alta conductividad térmica y eléctrica porque los electrones más externos en sus átomos están deslocalizados. Estos electrones no están asociados con ningún núcleo metálico en particular, por lo que son libres de moverse por todo el metal.
Reconocimiento: Las imágenes de color azul de los orbitales de benceno son cortesía de Sansculotte. Estas imágenes están bajo la licencia Creative Commons Atribución Compartir Igual 1.0 Genérica.