Mecanismos de Catálisis Enzimática
La unión de un sustrato al sitio activo de una enzima es una interacción muy específica. Los sitios activos son hendiduras o surcos en la superficie de una enzima, generalmente compuestos de aminoácidos de diferentes partes de la cadena polipeptídica que se unen en la estructura terciaria de la proteína plegada. Los sustratos se unen inicialmente al sitio activo por interacciones no covalentes, incluyendo enlaces de hidrógeno, enlaces iónicos e interacciones hidrofóbicas. Una vez que un sustrato se une al sitio activo de una enzima, múltiples mecanismos pueden acelerar su conversión al producto de la reacción.
Aunque el ejemplo simple discutido en la sección anterior involucró solo una molécula de sustrato, la mayoría de las reacciones bioquímicas involucran interacciones entre dos o más sustratos diferentes. Por ejemplo, la formación de un enlace peptídico implica la unión de dos aminoácidos. Para tales reacciones, la unión de dos o más sustratos al sitio activo en la posición y orientación adecuadas acelera la reacción (Figura 2.23). La enzima proporciona una plantilla sobre la cual los reactivos se unen y se orientan adecuadamente para favorecer la formación del estado de transición en el que interactúan.

Figura 2.23
Catálisis enzimática de una reacción entre dos sustratos. La enzima proporciona una plantilla sobre la cual los dos sustratos se unen en la posición y orientación adecuadas para reaccionar entre sí.
Las enzimas aceleran las reacciones también alterando la conformación de sus sustratos para acercarse a la del estado de transición. El modelo más simple de interacción enzima-sustrato es el modelo de bloqueo y llave, en el que el sustrato encaja con precisión en el sitio activo (Figura 2.24). En muchos casos, sin embargo, las configuraciones de la enzima y el sustrato se modifican por unión al sustrato, un proceso llamado ajuste inducido. En tales casos, la conformación del sustrato se altera para que se asemeje más a la del estado de transición. La tensión producida por dicha distorsión del sustrato puede facilitar aún más su conversión al estado de transición al debilitar los enlaces críticos. Además, el estado de transición se estabiliza por su unión apretada a la enzima, lo que reduce la energía de activación requerida.

Figura 2.24
Modelos de interacción enzima-sustrato. A) En el modelo de cerradura y llave, el sustrato encaja con precisión en el sitio activo de la enzima. (B) En el modelo de ajuste inducido, la unión al sustrato distorsiona las conformaciones tanto del sustrato como de la enzima. Esta distorsión(más…)
Además de unir múltiples sustratos y distorsionar la conformación de los sustratos para acercarse al estado de transición, muchas enzimas participan directamente en el proceso catalítico. En tales casos, cadenas laterales de aminoácidos específicas en el sitio activo pueden reaccionar con el sustrato y formar enlaces con los intermedios de reacción. Los aminoácidos ácidos y básicos a menudo están involucrados en estos mecanismos catalíticos, como se ilustra en la siguiente discusión de la quimotripsina como un ejemplo de catálisis enzimática.
La quimotripsina es un miembro de una familia de enzimas (serinas proteasas) que digieren proteínas catalizando la hidrólisis de enlaces peptídicos. La reacción se puede escribir de la siguiente manera:

Los diferentes miembros de la familia de la serina proteasa (incluidas la quimotripsina, la tripsina, la elastasa y la trombina) tienen características específicas de sustrato distintas; se dividen preferentemente enlaces peptídicos adyacentes a diferentes aminoácidos. Por ejemplo, mientras que la quimotripsina digiere enlaces adyacentes a aminoácidos hidrofóbicos, como el triptófano y la fenilalanina, la tripsina digiere enlaces junto a aminoácidos básicos, como la lisina y la arginina. Sin embargo, todas las serinas proteasas tienen una estructura similar y utilizan el mismo mecanismo de catálisis. Los sitios activos de estas enzimas contienen tres aminoácidos críticos-serina, histidina y aspartato—que impulsan la hidrólisis del enlace peptídico. De hecho, estas enzimas se llaman serinas proteasas debido al papel central del residuo de serina.
Los sustratos se unen a las serinas proteasas mediante la inserción del aminoácido adyacente al sitio de escisión en una bolsa en el sitio activo de la enzima (Figura 2.25). La naturaleza de esta bolsa determina la especificidad del sustrato de los diferentes miembros de la familia de la serina proteasa. Por ejemplo, la bolsa de unión de quimotripsina contiene aminoácidos hidrofóbicos que interactúan con las cadenas laterales hidrofóbicas de sus sustratos preferidos. En contraste, la bolsa de unión de tripsina contiene un aminoácido ácido con carga negativa (aspartato), que es capaz de formar un enlace iónico con los residuos de lisina o arginina de sus sustratos.
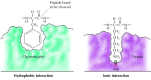
Figura 2.25
Unión al sustrato por serinas proteasas. El aminoácido adyacente al enlace peptídico a ser escindido se inserta en una bolsa en el sitio activo de la enzima. En quimotripsina, la bolsa se une a los aminoácidos hidrofóbicos; la bolsa de unión de tripsina contiene (más…)
La unión del sustrato posiciona el enlace peptídico a ser escindido adyacente a la serina del sitio activo (Figura 2.26). El protón de esta serina se transfiere entonces al sitio activo histidina. La conformación del sitio activo favorece esta transferencia de protones porque la histidina interactúa con el residuo de aspartato cargado negativamente. La serina reacciona con el sustrato, formando un estado de transición tetraédrico. El enlace peptídico se rompe y la porción C-terminal del sustrato se libera de la enzima. Sin embargo, el péptido N-terminal permanece unido a la serina. Esta situación se resuelve cuando una molécula de agua (el segundo sustrato) entra en el sitio activo y revierte las reacciones anteriores. El protón de la molécula de agua se transfiere a la histidina, y su grupo hidroxilo se transfiere al péptido, formando un segundo estado de transición tetraédrico. El protón se transfiere de la histidina a la serina, y el péptido se libera de la enzima, completando la reacción.

Figura 2.26
Mecanismo catalítico de quimotripsina. Tres aminoácidos en el sitio activo (Ser-195, His-57 y Asp-102) desempeñan un papel crítico en la catálisis.
Este ejemplo ilustra varias características de la catálisis enzimática; la especificidad de las interacciones enzima-sustrato, el posicionamiento de diferentes moléculas de sustrato en el sitio activo y la participación de residuos del sitio activo en la formación y estabilización del estado de transición. Aunque las miles de enzimas en las células catalizan muchos tipos diferentes de reacciones químicas, los mismos principios básicos se aplican a su funcionamiento.