Introducción
Los recursos fósiles son la principal materia prima para la energía y los compuestos orgánicos, y su uso resulta en la emisión de gases de efecto invernadero asociados con el cambio climático. La próxima crisis climática exige una transición urgente de una economía basada en los fósiles a una economía basada en la biotecnología en la que se utilice biomasa lignocelulósica en lugar de petróleo para la producción de combustibles, productos químicos y materiales. La madera es una fuente importante de biomasa lignocelulósica; se compone principalmente de paredes celulares de espesor secundario ricas en celulosa, hemicelulosas y lignina. Los tres polímeros se pueden valorizar en la economía de base biológica. La celulosa es una fuente para la industria de la pulpa y el papel, y tanto la celulosa como las hemicelulosas se pueden despolimerizar a sus monosacáridos para la fermentación en, por ejemplo, bioetanol, ácido láctico y detergentes (Vanholme et al., 2013b). Dado que la lignina afecta negativamente a la eficiencia del procesamiento de la madera para estas aplicaciones, los árboles se pueden diseñar para acumular menos lignina y volverse más susceptibles para la producción de papel y azúcares fermentables. Por otro lado, la lignina se considera cada vez más un componente valioso en la bioeconomía. De hecho, dado que la lignina es la fuente aromática renovable más grande de la Tierra, la viabilidad económica de una biorrefinería puede aumentar significativamente si la lignina también se valoriza y se utiliza como recurso para la producción de productos químicos (Holladay et al., 2007; Tuck et al., 2012; Davis et al., 2013; Ragauskas et al., 2014; Li C. et al., 2015; Van den Bosch et al., 2015; Rinaldi et al., 2016; Upton y Kasko, 2016; Schutyser et al., 2018).
El polímero de lignina está compuesto por monolignoles que son producidos por las vías biosintéticas de fenilpropanoide y monolignol, por una serie de reacciones enzimáticas que comienzan con la desaminación de fenilalanina (Figura 1). Los monolignoles se sintetizan en el citoplasma y se translocan al apoplasto, donde se deshidrogenan a radicales monolignol por la acción de lacasas y peroxidasas (Berthet et al., 2011; Zhao et al., 2013). Estos radicales monolignol luego se acoplan entre sí de manera combinatoria, generando una gama de enlaces químicos como el enlace aril-éter (β-O-4), el enlace resinol (β-β) y el enlace fenilcumarán (β-5) (Boerjan et al., 2003; Ralph et al., 2004; Vanholme et al., 2010). Los monolignoles más comunes son los alcoholes hidroxicinamílicos p-cumarilo, coniferilo y sinapilo, que generan las unidades H, G y S tras su incorporación al polímero de lignina, respectivamente (Bonawitz y Chapple, 2010; Ralph et al., 2019; Vanholme et al., 2019). La contribución relativa de los bloques de construcción de lignina varía según los taxones, la etapa de desarrollo, el tipo de tejido y célula, e incluso la capa de la pared celular; la lignina de maderas blandas (gimnospermas) está compuesta casi en su totalidad de unidades G con una fracción menor de unidades H, mientras que la lignina de maderas duras (angiospermas) tiene unidades S además de unidades G y trazas de unidades H (Boerjan et al., 2003; Vanholme et al., 2010, 2019). Además de estos monolignoles tradicionales, una variedad de otras moléculas aromáticas p-hidroxiladas se pueden incorporar en el polímero de lignina a varios niveles(Vanholme et al., 2019).
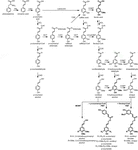
Figure 1. Lignin biosynthetic pathway. Alternative monomers and heterologously expressed enzymes are shown in bold. PAL, phenylalanine ammonia-lyase; C4H, cinnamate 4-hydroxylase; 4CL, 4-coumarate:CoA ligase; HCT, p-Hydroxycinnamoyl-CoA:quinate/shikimate-p-hydroxycinnamoyltransferase; C3’H, p-coumaroyl quinate/shikimate 3’-hydroxylase; CSE, caffeoyl shikimate esterase; CCoAOMT, caffeoyl-CoA O-methyltransferase; CCR, cinnamoyl-CoA reductase; F5H, ferulate 5-hydroxylase/CAld5H, coniferaldehyde 5-hydroxylase; COMT, ácido cafeico O-metiltransferasa; CAD, alcohol cinamílico deshidrogenasa; FMT, monolignol transferasa feruloil-CoA; PMT, monolignol transferasa p-cumaroil-CoA.
Dado que la lignina es un importante factor de recalcitrancia en los procesos de deslignificación de la madera, se han dedicado grandes esfuerzos de investigación para desentrañar la vía biosintética de la lignina, y para estudiar los efectos de las perturbaciones de los genes de biosíntesis de la lignina en la cantidad y composición de la lignina, y en la eficiencia del procesamiento de la madera. Mientras que las modificaciones en los genes que van desde los que codifican factores de transcripción hasta los que codifican enzimas oxidativas han dado lugar a una alteración del contenido, la composición o la deposición de lignina (Eriksson et al., 2000; Li Y. H. et al., 2003; Liang et al., 2008; Lu et al., 2013; Lin et al., 2016; Xu et al., 2017; Yang et al., 2017; Obudulu et al., 2018), esta revisión se centrará en los resultados obtenidos mediante la ingeniería de genes biosintéticos de lignina.
Ingeniería de la Vía de la lignina
La tabla 1 proporciona una visión general de los diferentes estudios sobre genes biosintéticos de lignina corregidos o mutados en álamo, pino, eucalipto y abedul, con los efectos resultantes en la eficiencia del procesamiento de la madera, cuando se determina. La reducción de la actividad de cualquier paso de la vía biosintética de la lignina, desde PAL hasta CAD, puede dar lugar a una reducción del contenido de lignina (Tabla 1). Varios parámetros influyen en el grado de reducción de la lignina, como el gen diana y el grado de regulación a la baja de la actividad enzimática, que a su vez depende de la eficiencia de la construcción de silenciamiento utilizada, el tamaño de la familia de genes y la redundancia dentro de la familia de genes. En general, la regulación a la baja de los pasos desde C4H hasta CCR resulta en una reducción más drástica de la cantidad de lignina (Hu et al., 1999; Meyermans et al., 2000; Zhong et al., 2000; Li L. et al., 2003; Jia et al., 2004; Lu et al., 2004; Leplé et al., 2007; Coleman et al., 2008a, b; Bjurhager et al., 2010; Mansfield et al., 2012; Ralph et al., 2012; Min et al., 2014; Van Acker et al., 2014; Zhou et al., 2015, 2018; Saleme et al., 2017; Xiang et al., 2017) que la regulación a la baja de F5H, COMT y CAD (Van Doorsselaere et al., 1995; Baucher et al., 1996; Lapierre et al., 1999; Jouanin et al., 2000; Van Acker et al., 2014; Wang et al., 2018). La reducción de lignina puede asociarse con un aumento de S / G, como en C3’H- (Coleman et al., 2008a; Ralph et al., 2012) y árboles con regulación descendente de CCoAOMT (Meyermans et al., 2000), o una disminución de la relación S/G como en CSE- (Saleme et al., 2017), y árboles con regulación descendente COMT (Van Doorsselaere et al., 1995; Lapierre et al., 1999; Jouanin et al., 2000). Curiosamente, se encontró que los álamos regulados a la baja en lignina 4CL tenían un aumento en S / G (Min et al., 2014; Xiang et al., 2017), una disminución de S/G (Voelker et al., 2010; Zhou et al., 2015), o proporciones comparables a las de tipo salvaje (Hu et al., 1999; Li L. et al., 2003). Esta varianza no puede asociarse con el promotor o el método utilizado para la regulación a la baja, lo que sugiere que las diferencias en el grado de silenciamiento, las condiciones de crecimiento o el estado de desarrollo influyen en este rasgo. Por otro lado, los efectos más fuertes sobre la composición de lignina H/G/S se han observado en árboles con regulación a la baja en C3’H y HCT, que depositan lignina con grandes aumentos en el contenido de unidad H (Coleman et al., 2008a; Ralph et al., 2012; Vanholme et al., 2013a), mientras que los árboles que sobreexpresan F5H producen lignina fuertemente enriquecida en unidades S (Franke et al., 2000; Li L. et al., 2003; Stewart et al., 2009), y los árboles que se regulan a la baja en COMT han reducido drásticamente la biosíntesis de la unidad S (Van Doorsselaere et al., 1995; Lapierre et al., 1999).

la Tabla 1. Resumen de árboles forestales con expresión modificada de genes de biosíntesis de lignina.
La eficiencia de procesamiento de la biomasa también se puede modificar mediante una mayor incorporación de moléculas que generalmente representan componentes menores en la lignina de plantas de tipo silvestre. La incorporación de ácido ferúlico en árboles con deficiencia de CCR resulta en la formación de enlaces acetales en el polímero de lignina, que se rompen fácilmente en pretratamientos de biomasa ácida (Leplé et al., 2007; Ralph et al., 2008; Van Acker et al., 2014). De hecho, los niveles de ácido ferúlico en la lignina se correlacionaron positivamente con una mayor eficiencia de sacarificación (Van Acker et al., 2014). La incorporación de alcohol 5-hidroxiconiferílico y 5-hidroxiconiferaldehído en la lignina de álamos con deficiencia de COMT (Van Doorsselaere et al., 1995; Lapierre et al., 1999; Jouanin et al., 2000; Morreel et al., 2004; Lu et al., 2010) da lugar a enlaces benzodioxanos, lo que potencialmente impide los enlaces covalentes entre la lignina y los grupos hidroxilos polisacáridos (Weng et al., 2010; Vanholme et al., 2012; Nishimura et al., 2018). Por otro lado, la deficiencia de COMT también resulta en una lignina más condensada debido a los niveles relativamente más altos de los enlaces β-β y β-5 condensados, y los niveles más bajos de enlaces β-O-4, cuando la frecuencia de la unidad S cae. El despulpado químico de madera derivada de álamos fuertemente regulados a la baja para COMT resultó en un mayor rendimiento de pulpa, contrarrestado por el contenido residual de lignina en la pulpa. Estos árboles tenían un menor contenido de lignina y un mayor contenido de celulosa (Jouanin et al., 2000). Por otro lado, los álamos que se regularon modestamente a la baja para COMT tuvieron una gran disminución en el rendimiento de pulpa, presumiblemente porque el contenido de lignina se había mantenido normal, mientras que la lignina tenía una mayor frecuencia de enlaces condensados que afectaban negativamente a la extracción de lignina (Lapierre et al., 1999; Pilato et al., 2002). La incorporación de cinamaldehídos en el polímero de lignina en árboles deficientes en CAD da como resultado cadenas de polímeros de lignina más cortas, por lo tanto, una mayor proporción de grupos terminales fenólicos libres que aumentan la solubilidad del polímero en álcalis. La incorporación de cinamaldehídos en el polímero de lignina probablemente también reduce la interacción covalente de la cadena alifática con la hemicelulosa, haciendo que la lignina sea más soluble. Además, debido al sistema conjugado extendido que se genera cuando un cinamaldehído β-O-4 se acopla con otro monómero, el enlace éter aromático del cinamaldehído incorporado se vuelve más susceptible a la escisión alcalina (Lapierre et al., 1989; Van Acker et al., 2017).
La polimerización de lignina es un proceso de acoplamiento radical combinatorio, que permite incorporar de forma natural una amplia gama de compuestos fenólicos al polímero de lignina (Boerjan et al., 2003; Vanholme et al., 2019). Los investigadores han intentado adaptar la cantidad y composición de lignina para mejorar el procesamiento de biomasa mediante la expresión de genes heterólogos, con el objetivo de biosíntesis e incorporación de varios compuestos fenólicos compatibles como monolignoles alternativos en el polímero de lignina (Ralph, 2006; Vanholme et al., 2012; Mottiar et al., 2016; Mahon y Mansfield, 2018). Un ejemplo es la introducción de genes que codifican enzimas que son necesarios para la biosíntesis de la unidad S en pino; la expresión simultánea de F5H, COMT y CAD introdujo con éxito unidades S en Pinus radiata (Wagner et al., 2015; Edmunds et al., 2017). La introducción del gen que codifica una monolignol 4-O-metiltransferasa (MOMT4) en el álamo conduce a la formación de alcoholes coniferil y sinapil 4-O-metilados, que no pueden incorporarse al polímero de lignina en crecimiento porque carecen del grupo hidroxilo aromático. Esto conduce a una interrupción de la polimerización de lignina y da como resultado árboles con menor contenido de lignina y mayor eficiencia de sacarificación (Bhuiya y Liu, 2010; Cai et al., 2016). Los álamos también se han diseñado para contener enlaces éster en la columna vertebral del polímero de lignina. Los ésteres ferulados de coniferilo se introdujeron en el polímero a través de la expresión de un gen FERULOIL-CoA:MONOLIGNOL TRANSFERASA (FMT) derivado de Angélica sinensis (Wilkerson et al., 2014), lo que lleva a una eficiencia de sacarificación mejorada en varias condiciones de pretratamiento (Wilkerson et al., 2014; Kim et al., 2017; Bhalla et al., 2018), y una eficiencia de pulpa kraft mejorada en comparación con el tipo salvaje (Zhou et al., 2017). Los ésteres de monolignol p-cumarato también se han diseñado en álamo, a través de la expresión de un gen de arroz p-CUMAROIL-CoA:MONOLIGNOL TRANSFERASA (PMT), lo que resulta en una mayor frecuencia de enlaces interunitarios resistentes y una mayor frecuencia de unidades terminales G y S con grupos fenólicos libres (Smith et al., 2015; Sibout et al., 2016). Mientras que en Arabidopsis la expresión heteróloga de PMT resultó en una cantidad reducida de lignina acompañada de una mayor eficiencia de sacarificación(Sibout et al., 2016), no hubo disminución en la cantidad de lignina en el álamo y no se determinó la eficiencia de sacarificación (Smith et al., 2015).
Si bien se demostró que varias modificaciones de la cantidad y composición de lignina proporcionaban mejoras en el procesamiento de la biomasa, estas modificaciones a menudo iban acompañadas de una penalización en el rendimiento de la biomasa (Leplé et al., 2007; Wadenbäck et al., 2008; Wagner et al., 2009; Voelker et al., 2010; Stout et al., 2014; Van Acker et al., 2014; Sykes et al., 2015; Zhou et al., 2018). Un metaestudio reciente perturbó 21 genes de biosíntesis de lignina en P. trichocarpa, e integró de manera integral los resultados de los datos transcriptómicos, proteómicos, fluxómicos y fenoménicos de 221 líneas. Los autores concluyeron que el crecimiento de los árboles no está asociado con la cantidad de lignina, la composición de subunidades o enlaces específicos (Wang et al., 2018), pero más bien se correlacionó con la presencia de vasos xilémicos colapsados (Coleman et al., 2008a, b; Wagner et al., 2009; Voelker et al., 2010; Vargas et al., 2016; De Meester et al., 2018), la activación de una vía de integridad de la pared celular (Bonawitz et al., 2014) y/o la acumulación de inhibidores químicos (Gallego-Giraldo et al., 2011; Muro-Villanueva et al., 2019).
Mientras que se han realizado esfuerzos sustanciales para disminuir el contenido de lignina mediante la regulación a la baja de los genes biosintéticos de lignina, los estudios sobre la regulación al alza de la vía de la lignina y la sobreproducción de lignina han sido escasos. De hecho, los informes sobre la sobreexpresión de F5H muestran un contenido de lignina sin cambios o incluso una disminución (Huntley et al., 2003; Li L. et al., 2003; Stewart et al., 2009; Mansfield et al., 2012; Edmunds et al., 2017). La sobreexpresión de CAD y COMT ha dado lugar a silenciamiento genético en lugar de regulación ascendente, o no se detectó ningún efecto en los niveles de expresión (Baucher et al., 1996; Lapierre et al., 1999; Jouanin et al., 2000; Leplé et al., 2007; Van Acker et al., 2014). La sobreexpresión de los factores de transcripción R2R3-MYB PtoMYB92, PtoMYB216 y PtoMYB74 dio lugar a capas adicionales de xilema, paredes celulares de xilema más gruesas, así como depósitos ectópicos de lignina, y las plantas acumularon entre un 13% y un 50% más de lignina (Tian Q. et al., 2013; Li C. F. et al., 2015; Li et al., 2018). Las líneas de sobreexpresión de MYB regularon constitutivamente los genes de la vía de biosíntesis de la lignina, y mientras que las plantas que sobreexpresaban MYB92 y MYB74 tenían una penalización de biomasa, la sobreexpresión de MYB216 resultó en plantas con hasta un 50% más de lignina y sin fenotipo de desarrollo. A medida que la lignina se considera cada vez más un recurso importante para la producción sostenible de productos químicos (Cao et al., 2018) la ingeniería de plantas que producen en exceso lignina debe explorarse más a fondo.
Ensayos de campo
Los ejemplos mencionados anteriormente muestran claramente que la ingeniería de lignina a través de la regulación descendente o ascendente de los genes de la vía fenilpropanoide, o la expresión de genes heterólogos, tiene el potencial de aumentar la eficiencia de procesamiento de la biomasa lignocelulósica. Debido a razones prácticas y reglamentarias, la mayoría de los estudios reportan datos obtenidos del análisis de árboles cultivados en un invernadero. Sin embargo, los experimentos con árboles cultivados en un invernadero no suelen tener en cuenta los procesos de desarrollo, como el cese del crecimiento y la inactividad. Además, los experimentos de invernadero no proporcionan suficiente información sobre la interacción de la planta diseñada con factores ambientales como el tipo de suelo, el viento y los patógenos. Comprender estas interacciones es un paso importante en la traducción de los resultados de la investigación hacia aplicaciones comerciales. De hecho, el cuerpo de trabajo producido por los estudios para los que se concedió permiso para establecer ensayos de campo, destaca importantes diferencias en el fenotipo entre los árboles cultivados en invernadero y en campo. La Tabla 1 resume los informes de ensayos de campo realizados con árboles 4CL, CCoAOMT, CCR, COMT y CAD regulados a la baja.
Confirmando el potencial de la biomasa lignocelulósica modificada como sustrato para aplicaciones, varios árboles cultivados en ensayos de campo con ingeniería de lignina mostraron mejoras en el procesamiento de la madera. Álamos con regulación a la baja para CCoAOMT cultivados durante 5 años en un ensayo de campo en Beijing (China), mostraron un aumento de la liberación de glucosa y xilosa tras la sacarificación (Wang et al., 2012). Los álamos con regulación a la baja para CCR y cultivados en un ensayo de campo en Francia, demostraron ser más susceptibles al despulpado químico kraft (Leplé et al., 2007). Dos ensayos de campo adicionales realizados en Francia y Bélgica con álamos regulados a la baja por CCR resultaron en una mejora de hasta el 160% en la producción de etanol en ensayos simultáneos de sacarificación y fermentación (SSF); sin embargo, las plantas tuvieron una reducción de biomasa de hasta el 50% (Van Acker et al., 2014). Los ensayos de campo con álamo con regulación descendente CAD también mostraron resultados prometedores. Estos árboles mostraron un poco menos de lignina que los silvestres y demostraron ser más susceptibles a la deslignificación kraft (Lapierre et al., 1999). Consistentemente, las mismas líneas cultivadas en ensayos de campo a mayor escala en Francia y el Reino Unido mostraron una leve disminución en la cantidad de lignina y una mejora en la fabricación de pasta kraft considerada comercialmente relevante, ya que las plantas necesitaban un 6% menos de álcali para lograr una deslignificación similar a la de los árboles de tipo silvestre (Pilate et al., 2002).
Sin embargo, informes contradictorios sobre el rendimiento de la biomasa y la eficiencia del procesamiento posterior sugieren que estos parámetros están altamente influenciados por factores ambientales. Mientras que un ensayo de campo realizado en China utilizando álamos con regulación a la baja de 4 CL encontró que, incluso con una disminución del 28% en el contenido de lignina en comparación con el tipo silvestre, los árboles tenían un aumento de altura de aproximadamente un 8% (Tian X. M. et al., 2013), consistente con estudios de invernadero (Hu et al., 1999), otros ensayos de campo encontraron que los álamos 4CL con regulación a la baja habían disminuido la biomasa y a veces incluso eran empequeñecidos (Voelker et al., 2010; Stout et al., 2014; Marchin et al., 2017). Los informes también difieren en cuanto a la eficiencia de procesamiento de la madera derivada de estos álamos cultivados en campo con regulación descendente de 4 CL. Mientras que se encontró un aumento de hasta el 100% en la recuperación de azúcar para árboles 4CL1 con regulación descendente (construcción antisentido 4CL impulsada por 35S) cultivados en un sitio de montaña en los Estados Unidos (Xiang et al., 2017), los datos obtenidos de estudios de campo realizados en Oregón (Estados Unidos) encontraron que los álamos 4CL1 silenciados antisentido impulsados por promotores Pt4CL1 no mejoraron la eficiencia de sacarificación en comparación con los de tipo salvaje (Voelker et al., 2010). Del mismo modo, un estudio a largo plazo en Wenling (China), encontró que los álamos con regulación a la baja de 4 CL no mostraron una mejora significativa en el rendimiento de azúcar en comparación con el tipo silvestre (Wang et al., 2012). En ambos casos, los árboles mostraron disminuciones leves en la cantidad de lignina que no se tradujeron en una mayor eficiencia de procesamiento, potencialmente debido a la mayor concentración de extractivos que podrían interferir con la actividad enzimática (Voelker et al., 2010).
Los estudios de campo han demostrado que los factores ambientales pueden influir en la lignificación y restaurar los rasgos a niveles de tipo silvestre en comparación con los niveles alcanzados cuando las mismas plantas se cultivaron en el invernadero. Mientras que los árboles con regulación descendente de 4 Cl habían disminuido el contenido de lignina cuando se cultivaban en condiciones de invernadero, el análisis de los mismos álamos antisentidos de 4 CL, pero cultivados en el campo, a menudo ha demostrado que el contenido de lignina aumentó en comparación con los árboles cultivados en invernadero y, a veces, incluso se restauró a niveles de tipo silvestre (Stout et al., 2014; Xiang et al., 2017). De manera similar, los niveles de lignina se redujeron mucho menos en álamos con deficiencia de CCR cuando se cultivaron en el campo en comparación con cuando se cultivaron en el invernadero (Van Acker et al., 2014). Al menos para los álamos con deficiencia de CCR, es posible que el mayor nivel de lignificación de los árboles cultivados en el campo se deba al hecho de que las muestras de madera se tomaron durante el invierno. Cuando el crecimiento de los árboles cesa en otoño, los árboles todavía tienen tiempo de lignificar completamente sus paredes celulares para el momento en que el árbol entra en latencia, en comparación con los árboles cultivados en invernadero que desarrollan nuevo xilema continuamente. También se ha demostrado que la composición de la lignina difiere entre los árboles de baja lignina cultivados en invernadero y en el campo. Los álamos con regulación descendente de 4 CL cultivados en un campo en Carolina del Norte tenían lignina con menor S/G que cuando se cultivaban las mismas líneas en el invernadero (Stout et al., 2014).
Tomados en conjunto, estos resultados muestran que los datos obtenidos de árboles cultivados en invernadero no pueden extrapolarse fácilmente a árboles cultivados en campo, lo que respalda la necesidad de experimentos de campo en diferentes lugares. Algunas líneas presentaban una penalización de rendimiento, lo que las hacía menos interesantes para las aplicaciones, destacando la necesidad de comprender mejor la base molecular de la penalización de rendimiento y el desarrollo de estrategias para superar este problema.
Se ha demostrado que la lignina desempeña un papel importante en la resistencia a los patógenos (Miedes et al., 2014; Zhao y Dixon, 2014), y desempeña un papel fundamental al permitir que la planta transporte agua. Esto sugiere que las modificaciones de la lignina podrían tener un impacto en la tolerancia al estrés de la planta. Si bien se necesita más investigación para abordar completamente esta posibilidad, la regulación a la baja de 4CL, COMT y CAD en álamos no alteró drásticamente el rendimiento de alimentación de los herbívoros que se alimentan de hojas (Tiimonen et al., 2005; Brodeur-Campbell et al., 2006; Hjalten et al., 2013). El efecto de la regulación a la baja de COMT y CAD en álamo sobre las interacciones planta-insecto también se ha evaluado en árboles cultivados en el campo, y se demostró que los árboles modificados con lignina tenían una incidencia normal de insectos visitantes y alimentadores, así como respuestas normales a patógenos microbianos (Pilate et al., 2002; Halpin et al., 2007). Estos resultados indican que los árboles con lignina modificada no sufren necesariamente más plagas y enfermedades que las plantas silvestres. Sin embargo, el perfilado del microbioma bacteriano de la endosfera de la madera cosechada de álamos cultivados en campo con regulación a la baja por CCR demostró cambios en la comunidad bacteriana, presumiblemente debido a la abundancia alterada de metabolitos fenólicos particulares en el xilema (Beckers et al., 2017).
Considerando el papel de la lignina en la función y estructura del xilema, se han evaluado las relaciones hídricas de unos pocos álamos modificados con poca lignina. Se encontró que los álamos con regulación a la baja de 4 CL tenían una conductividad hidráulica reducida, lo que podría interferir con el crecimiento de las plantas (Marchin et al., 2017). Experimentos de estrés hidráulico con álamos con regulación a la baja para CCR, COMT o CAD mostraron que estas plantas tenían una menor resistencia a la cavitación, mientras mantenían la conductividad hidráulica del xilema normal y el transporte de agua(Awad et al., 2012). Estos resultados sugieren que el crecimiento de mutantes de baja lignina podría verse influenciado por la disponibilidad de agua. Al igual que para cualquier híbrido nuevo obtenido a partir del mejoramiento clásico, se necesitan pruebas de campo para evaluar el rendimiento de campo y la tolerancia al estrés de los árboles con ingeniería de lignina.
Perspectivas para la Ingeniería de Lignina en Árboles forestales
El rendimiento de las plantas de ingeniería de lignina parece estar muy influenciado por las condiciones ambientales. Sin embargo, no está claro si las diferencias observadas entre árboles cultivados en invernadero y en campo, o entre árboles cultivados en diferentes lugares de campo, son el resultado de diferentes niveles de supresión génica o de la interacción del rasgo de ingeniería con el medio ambiente (GxE). De hecho, la regulación a la baja inestable es una deficiencia de las técnicas de silenciamiento de genes que se basan en ARNi. Esto se observa al observar la variación en el fenotipo del xilema rojo que se observa cuando genes de biosíntesis de lignina particulares, como CAD, COMT o CCR, se regulan a la baja. La coloración roja del xilema a menudo no es uniforme en todo el xilema, sino que aparece en parches que reflejan niveles variables de silenciamiento génico (Leplé et al., 2007; Voelker et al., 2010; Van Acker et al., 2014; Gráfico 2). Además, el uso de métodos de silenciamiento de genes puede resultar potencialmente en silenciamiento concomitante de miembros de la familia de genes estrechamente relacionados, tal vez en varios grados, nublando las interpretaciones y camuflando los efectos de la regulación a la baja de genes individuales.

la Figura 2. Regulación a la baja de genes irregular por ARNi. Fenotipo de xilema rojo irregular observado en troncos de álamos con deficiencia de CCR (derecha) cultivados en un ensayo de campo en Bélgica. El xilema rojo indica áreas de regulación descendente de CCR. La madera de árboles silvestres es blanquecina (izquierda).
Estos problemas ahora se pueden superar fácilmente mediante el uso de tecnologías de edición de genes basadas en CRISPR que permiten mutaciones estables de pérdida de función (knock-outs) en genes diana específicos, lo que permite la disección de la función de genes individuales dentro de las familias. Por ejemplo, la selección de miembros individuales de la familia del gen 4CL en el álamo mostró que la 4CL1 está relacionada con la lignificación, mientras que la 4CL2 está involucrada en la producción de proantocianidina (Zhou et al., 2015). Además de los alelos knock-out, la edición de genes basada en CRISPR también permite crear nuevos alelos que confieren una reducción parcial de la actividad enzimática. Esto abre la posibilidad de ajustar el nivel de actividad enzimática residual y evitar la penalización del rendimiento que a menudo se observa cuando la cantidad de lignina cae por debajo de un nivel umbral. Otra vía prometedora para la ingeniería de lignina en árboles forestales que es posible a través de la ingeniería genómica basada en CRISPR es la edición simultánea de múltiples genes (apilamiento de alelos) para optimizar la eficiencia del procesamiento de biomasa, como se ejemplifica en Arabidopsis, donde el apilamiento de las mutaciones transaldolasa (tra) y comt, las mutaciones c4h y comt, o las mutaciones 4cl y comt resultaron en mejoras aditivas y sinérgicas en la eficiencia de la sacarificación (de Vries et al., 2018). De hecho, un enfoque de sistemas en P. trichocarpa predice que la regulación a la baja concomitante de PAL y CCoAOMT, o PAL, C3’H y CCOAOMT mejorará sustancialmente las propiedades de la madera y la liberación de azúcar (Wang et al., 2018).
El uso de la edición genómica basada en CRISPR en la mejora de árboles para las industrias de pulpa y papel y de biorrefinería, así como para la producción de aromáticos de plataforma a partir de la descomposición hidrogenolítica de la lignina, será más valioso cuando esta tecnología se combine estratégicamente con otras técnicas de mejoramiento (Figura 3). De hecho, ya existe una gran variación en la cantidad de lignina y la composición S/G en las poblaciones naturales de árboles forestales (Studer et al., 2011). Dado que ambos rasgos afectan la liberación de glucosa tras la sacarificación (Yoo et al., 2018), explotando esta diversidad genética mediante el mejoramiento convencional, con la ayuda de Estudios de Asociación del Genoma Completo (GWAS, por sus siglas en inglés) (Porth et al., 2013; Fahrenkrog et al., 2017; Liu et al., 2018), Reproducción con Alelos Defectuosos Raros (BRDA) (Vanholme et al., 2013a) o selección genómica (Yin et al., 2010; Muchero et al., 2015; Pawar et al., 2018; Xie et al., 2018), es una estrategia valiosa para obtener líneas que han mejorado la eficiencia del procesamiento de la madera. Una vez que se obtienen árboles de élite mediante estos métodos de reproducción, la ingeniería genética y la edición genética de genes específicos basada en CRISPR es una vía muy prometedora para mejorar aún más estos genotipos de élite sin romper su constitución genética y sin pasar por largos ciclos de reproducción. Dado el inminente colapso climático, no tenemos más tiempo que perder en la adopción de estas nuevas técnicas de reproducción en nuestra carrera hacia la economía de base biológica.
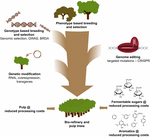
la Figura 3. Mejoramiento genético de árboles forestales a través de una combinación de herramientas de mejoramiento. Para acelerar la mejora genética de los árboles forestales para aplicaciones de pulpa y biorrefinería, es necesario combinar de manera inteligente las herramientas clásicas y las nuevas de mejoramiento. El mejoramiento clásico implica la selección fenotípica de árboles para cruces controlados, seguida de la selección fenotípica. Con el advenimiento de la información de la secuencia del genoma de muchos árboles forestales, se han desarrollado nuevas estrategias como la Selección Genómica, los Estudios de Asociación Amplia del Genoma (GWAS) y la Reproducción con Alelos Defectuosos Raros (BRDA) para acelerar la captura y el enriquecimiento de polimorfismos de ADN asociados con rasgos beneficiosos. La edición del genoma basada en CRISPR permite modificar el genoma de una manera que imita polimorfismos naturales. La modificación genética implica la integración estable de ADN extraño en el árbol para sobreproducir (una) enzima(s) o regular a la baja (un) gen(s). Es necesario combinar las Técnicas clásicas y las Nuevas Técnicas de Mejoramiento para proporcionar suficiente madera de alta calidad para la sociedad.
Contribuciones de los autores
Todos los autores enumerados han hecho una contribución sustancial, directa e intelectual al trabajo y lo han aprobado para su publicación.
Financiación
Reconocemos la financiación parcial del proyecto BIOLEUM de IWT – SBO (Subvención No. 130039), y de SBO-FISH a través del proyecto ARBOREF. AC ha recibido financiación del FWO y del Programa de Investigación e Innovación Horizonte 2020 de la Unión Europea en el marco del Acuerdo de Subvención Marie Skłodowska-Curie No 665501. El LdV fue financiado por el Instituto para la promoción de la Innovación a través de la Ciencia y la Tecnología de Flandes (IWT-Vlaanderen) para una beca predoctoral.
Declaración de Conflicto de Intereses
Los autores declaran que la investigación se realizó en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Agradecimientos
Agradecemos a Annick Bleys por preparar este manuscrito para su envío.
Boerjan, W., Ralph, J., and Baucher, M. (2003). Biosíntesis de lignina. Annu. Modif. De La Planta Biol. 54, 519–546.
Resumen de PubMed/Google Scholar
Lapierre, C., Pollet, B., Petit-Conil, M., Toval, G., Romero, J., Pilate, G., et al. (1999). Las alteraciones estructurales de ligninas en álamos transgénicos con una actividad deprimida de alcohol cinamílico deshidrogenasa o ácido cafeico O-metiltransferasa tienen un impacto opuesto en la eficiencia de la pulpa kraft industrial. Fisiol Vegetal. 119, 153–163.
Resumen de PubMed/Google Scholar
Ralph, J. (2006). «¿ Qué hace un buen sustituto del monolignol?, «in The Science and Lore of the Plant Cell Wall-Biosynthesis, Structure and Function, ed. T. Hayashi (Boca Raton, FL: BrownWalker Press).
Google Scholar