The chemical element krypton is classed as a noble gas and a nonmetal. It was discovered in 1898 by William Ramsay and his assistant Morris Travers.

Data Zone
| Classification: | Krypton is a noble gas and a nonmetal |
| Color: | colorless |
| Atomic weight: | 83.80 |
| State: | gas |
| Melting point: | -157.3 oC, 115.9 K |
| Boiling point: | -153.2 oC, 119.4 K |
| Electrons: | 36 |
| Protons: | 36 |
| Neutrons in most abundant isotope: | 48 |
| Electron shells: | 2,8,18,8 |
| Electron configuration: | 3d10 4s2 4p6 |
| Density @ 20oC: | 0.003708 g/cm3 |
Show more, including: Heats, Energies, Oxidation,
Reactions, Compounds, Radii, Conductivities
| Atomic volume: | 38.9 cm3/mol |
| Structure: | fcc: face-centered cubic |
| Hardness: | – |
| Specific heat capacity | 0.248 J g-1 K-1 |
| Heat of fusion | 1.638 kJ mol-1 |
| Heat of atomization | 0 kJ mol-1 |
| Heat of vaporization | 9.029 kJ mol-1 |
| 1st ionization energy | 1350.7 kJ mol-1 |
| 2nd ionization energy | 2350.3 kJ mol-1 |
| 3rd ionization energy | 3565.1 kJ mol-1 |
| Electron affinity | – kJ mol-1 |
| Minimum oxidation number | 0 |
| Min. common oxidation no. | 0 |
| Maximum oxidation number | 2 |
| Max. common oxidation no. | 2 |
| Electronegativity (Pauling Scale) | 3 |
| Polarizability volume | 2.5 Å3 |
| Reaction with air | none |
| Reaction with 15 M HNO3 | none |
| Reaction with 6 M HCl | none |
| Reaction with 6 M NaOH | none |
| Oxide(s) | none |
| Hydride(s) | none |
| Chloride(s) | none |
| Atomic radius | 88 pm |
| Ionic radius (1+ ion) | – |
| Ionic radius (2+ ion) | – |
| Ionic radius (3+ ion) | – |
| Ionic radius (1- ion) | – |
| Ionic radius (2- ion) | – |
| Ionic radius (3- ion) | – |
| Thermal conductivity | 0.01 W m-1 K-1 |
| Electrical conductivity | – |
| Freezing/Melting point: | -157.3 oC, 115.9 K |
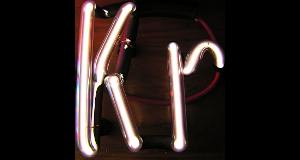
Krypton gas glows with the help of a few thousand volts. Image: Pslawinski.

el Criptón del Espectro.

William Ramsay apuntando a la columna final de la tabla periódica que contiene los gases nobles (o inertes). Ramsay fue galardonado con el Premio Nobel de Química en 1904 por su trabajo en el descubrimiento de los gases inertes. Imagen: Vanity Fair

> Un láser terciario de iones de criptón de 568 nm utilizado en la investigación de proteínas. Foto: Centro de Investigación del Cáncer
Descubrimiento de Criptón
El químico escocés William Ramsay y su asistente el químico inglés Morris Travers descubrieron criptón en 1898 en Londres.
Ramsay había descubierto previamente helio y argón. Es consciente de que en el mismo grupo de la tabla periódica deben encontrarse más elementos nuevos.
Ramsay y Travers consideraron la brecha en la tabla periódica entre el helio y el argón. Razonaron que un nuevo elemento (ahora se llama neón) debe existir para llenar este vacío; estaban decididos a encontrarlo. Y lo encontraron, pero solo después de que su búsqueda revelara por primera vez otro elemento nuevo: krypton. (1)
Consciente de la historia de la química, Ramsay sabía que a veces un nuevo elemento puede ocultar otro. Por ejemplo, Johan Gadolin había descubierto el itrio en el mineral que ahora llamamos gadolinita. Algunos años más tarde, Carl Gustaf Mosander descubrió los nuevos elementos erbio y terbio en la gadolinita; habían estado allí todo el tiempo, pero Gadolin no los había encontrado. Ramsay se preguntó sobre la posibilidad de encontrar pequeñas cantidades del nuevo elemento escurridizo escondido en uno de sus primeros descubrimientos, el argón.
Ramsay y Travers decidieron que extraerían un gran volumen de argón del aire. Licuaban el argón, y luego lo destilaban en fracciones separadas para ver si las fracciones más ligeras contenían el nuevo gas. (2)
Con poca experiencia en el manejo de gases líquidos, obtuvieron un litro de aire líquido para averiguar cómo trabajar con él. En su trabajo de práctica, evaporaron la mayor parte, dejando solo 100 ml. Ramsay sabía que era muy improbable que el gas nuevo, más ligero que el argón, pudiera estar presente en esta muestra residual, pero se le ocurrió la emocionante idea de que un gas nuevo, más pesado, podría estar presente.
Con esto en mente, Travers eliminó oxígeno y nitrógeno del gas utilizando cobre al rojo vivo y magnesio. Colocó una muestra del gas restante en un tubo de vacío y aplicó un alto voltaje para medir el espectro del gas.
Descubrió que el argón estaba presente, como era de esperar, pero también dos nuevas líneas brillantes, una amarilla y otra verde, que nunca se habían visto antes.
Ramsay y Travers midieron la relación entre el calor específico del gas a presión constante y su calor específico a volumen constante y encontraron que era de 1,66. Este valor solo se podía obtener si el nuevo gas consistía en átomos individuales, demostrando que no podía ser un compuesto. Si no era un compuesto, tenía que ser un elemento nuevo.
El criptón había sido descubierto. Ramsay eligió el nombre del elemento de la palabra griega ‘kryptos’ que significa ‘oculto’.’
Durante muchos años después de que se descubrieran los gases nobles, la mayoría de los científicos creían que no formarían compuestos. Esto resultó ser incorrecto.
William Ramsay en realidad creía que los compuestos serían posibles, escribiendo en 1902: «He tenido durante mucho tiempo la idea de que el criptón y el xenón pueden entrar en combinaciones mucho más fácilmente que los otros gases, pero ¿cómo lograrlo?»(3)
Tomó otros 60 años antes de que su pregunta fuera respondida. (Ver Datos Interesantes a continuación.)
William Ramsay recibió el Premio Nobel de Química en 1904, » en reconocimiento a sus servicios en el descubrimiento de los elementos gaseosos inertes en el aire, y su determinación de su lugar en el sistema periódico.»Fue el responsable de añadir un grupo completamente nuevo a la tabla periódica. El radón fue el único gas noble que no descubrió.
Datos interesantes sobre el criptón
- Entre 1960 y 1983, la unidad científica de longitud, el metro, se definió como 1 650 763.73 longitudes de onda de la línea espectral rojo anaranjado de krypton-86. (El medidor se define ahora como la distancia recorrida por la luz en el vacío durante un intervalo de tiempo de
1/299 792 458 de segundo.) - Desde su descubrimiento en 1898 hasta la década de 1960, la mayoría de los científicos creían que era imposible hacer compuestos de kriptón, o cualquier otro gas noble, aunque véase William Ramsay, más arriba. El difluoruro de criptón se fabricó en 1963. Es un sólido cristalino blanco, estable a temperaturas inferiores a -30 oC. (4)
- El criptón no es muy abundante en la atmósfera de nuestro planeta: Por cada átomo de kriptón, hay alrededor de 8200 átomos de argón, 184 000 moléculas de oxígeno y 685 000 moléculas de nitrógeno.
- Krypton-85 en la atmósfera se puede utilizar para detectar la presencia de instalaciones de investigación y producción de armas nucleares secretas. (5)
- Los láseres de kriptón y flúor producen pulsos con 500 veces la potencia de toda la red eléctrica de los Estados Unidos. No es sorprendente que estos pulsos sean de corta duración: cuatro mil millonésimas de segundo. (6)


Krypton brillantes en alta tensión en una toma de tubo de descarga. Foto: Alquimista-hp
Apariencia y Características
los efectos Nocivos:
Krypton es considerado no tóxico.
Características:
El criptón es un gas incoloro, inodoro e inerte.
Aunque es extremadamente no reactivo, el criptón puede reaccionar con el flúor de gas muy reactivo. Se han preparado algunos compuestos de kriptón, incluidos el fluoruro de kriptón (II) y los clatratos de kriptón.
El criptón sólido es blanco y cristalino.
Usos del criptón
El criptón se utiliza en productos de iluminación:
Un uso importante es en luces de pista de aeropuertos parpadeantes de alta potencia.
El gas de criptón ionizado parece blanquecino, ver foto a la izquierda, lo que hace que las bombillas a base de criptón sean útiles como fuente de luz blanca brillante en fotografía de alta velocidad.
El criptón se emplea junto con otros gases para hacer señales luminosas de estilo «luz de neón» que brillan con una luz amarillo verdosa.
El criptón se utiliza como gas de llenado para luces fluorescentes de ahorro de energía y como gas de llenado inerte en bombillas incandescentes.
La abundancia relativa de criptón versus hidrógeno puede ser utilizada por los astrónomos para medir cuánta nucleosíntesis (formación de elementos) ha tenido lugar en cualquier región del espacio interestelar. (7)
Entre 1960 y 1983, un acuerdo internacional definió la longitud del metro en términos de la longitud de onda de la luz emitida por el isótopo de criptón, 86Kr. (El medidor se define ahora como la distancia recorrida por la luz en el vacío durante un tiempo de 1/299,792,458 de segundo. El tiempo se mide utilizando un reloj atómico de cesio.)
Abundancia e isótopos
Abundancia corteza terrestre: 100 partes por trillón en peso, 30 partes por trillón en moles
Abundancia sistema solar: partes por millón en peso, partes por millón en moles
Costo, puro: $33 por 100 g
Costo, a granel: $ por 100g
Fuente: El criptón se obtiene comercialmente por destilación fraccionada de aire líquido.
Isótopos: El criptón tiene 25 isótopos cuyas vidas medias se conocen, con números de masa de 71 a 95. Naturalmente krypton es una mezcla de seis isótopos y que se encuentran en los porcentajes mostrados: 78Kr (0.4%), 80Kr (2.3%), 82Kr (11.6%), 83Kr (11.5%), 84Kr (57.0%) y 86Kr (17.3%). El isótopo más abundante es de 84Kr al 57,0%.

- William Ramsay, Premio Nobel de la Conferencia. 12 de diciembre de 1904.
- William Ramsay, The Recently Discovered Gases and Their Relation to the Periodic Law (en inglés)., Science, 1898, Vol. IX, p273-280.
- Leonello Paoloni, The noble gas compounds: the views of William Ramsay and Giuseppe Oddo in 1902., J. Chem. Educ., 1983, 60 (9), p758.
- D. R. MacKenzie, Difluoruro de criptón: Preparación y manipulación., Science 20 de septiembre de 1963, Vol. 141 no. 3586 p1171.
- BBC Report, New N Korea nuclear plant suspected Domingo, 20 de julio de 2003.
- Laboratorio de Investigación Naval, láseres de kriptón y flúor.
- Stefan I. B. Cartledge et al., Interstellar Krypton Abundances: The Detection of Kiloparsec-scale Differences in Galactic Nucleosynthetic History., 2008, The Astrophysical Journal., 687, p1043.
Cite esta página
Para enlaces en línea, copie y pegue uno de los siguientes:
<a href="https://www.chemicool.com/elements/krypton.html">Krypton</a>
o
<a href="https://www.chemicool.com/elements/krypton.html">Krypton Element Facts</a>
Para citar esta página en un documento académico, utilice la siguiente cita compatible con MLA:
"Krypton." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/krypton.html>.