U. S. Pharm. 2008; 33 (4) (suppl Oncológico): 20-30. RESUMEN: Aproximadamente el 75% de las mujeres posmenopáusicas con cáncer de mama tienen enfermedad con receptor hormonal positivo (HR+).1 El tamoxifeno fue el estándar de terapia para el cáncer de mama HR + en mujeres posmenopáusicas hasta el advenimiento de los inhibidores selectivos de la aromatasa de tercera generación, que son anastrozol, letrozol y exemestano.3,4 Estos fármacos han demostrado una supervivencia sin enfermedad superior en ensayos clínicos en comparación con el tamoxifeno, pero no se ha establecido su beneficio cuando se usan durante más de cinco años en mujeres posmenopáusicas con cáncer de mama HR+.3,4
Se ha estimado que tres cuartas partes de las mujeres posmenopáusicas con cáncer de mama tienen enfermedad con receptor hormonal positivo (HR+).1 Tamoxifeno mod un modulador selectivo del receptor de estrógeno con efectos estrogénicos en los huesos, el tejido endometrial y los lípidos y anti!= efectos estrogénicos en el tejido mamario el ERS fue la terapia estándar para el cáncer de mama HR + en mujeres posmenopáusicas hasta la introducción de los inhibidores selectivos de la aromatasa de tercera generación (AIs).2-4 Estos fármacos, anastrozol, letrozol y exemestano, han demostrado una supervivencia sin enfermedad (SSE) superior en comparación con el tamoxifeno en ensayos clínicos.3,4 Los efectos adversos asociados con el uso del tamoxifeno-cáncer de endometrio, complicaciones tromboembólicas y resistencia al tamoxifeno-han alentado el desarrollo de terapias con un mecanismo de acción diferente, como el AIs.2
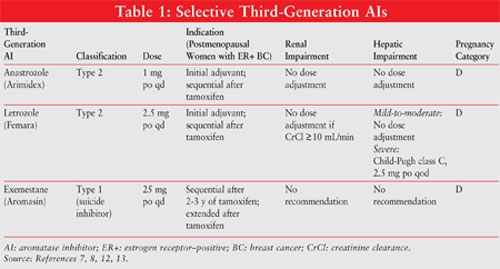
Ver TABLA 1 para un resumen de información importante sobre el AIs de tercera generación.
Antecedentes
El cirujano escocés George Beatson describió la contribución hormonal de los estrógenos a la carcinogénesis en relación con el cáncer de mama en 1896.5 Beatson reconoció que la extirpación de los ovarios (ooforectomía) mujeres con cáncer de mama inoperable.5 Este estado de privación de estrógeno inducido quirúrgicamente contribuyó a la inhibición del crecimiento tumoral en células de cáncer de mama en mujeres con enfermedad HR+.5
La aminoglutetimida, formulada originalmente como agente anticonvulsivo, fue la primera IA inespecífica promovida inicialmente a finales de la década de 1970 como agente de segunda línea después del tamoxifeno para mujeres posmenopáusicas con cáncer de mama HR+ avanzado.6 Los efectos secundarios tóxicos, como la supresión suprarrenal y la necesidad de terapia con esteroides, llevaron a la retirada de la aminoglutetimida del mercado.6 En mujeres posmenopáusicas con cáncer de mama HR+ en estadio temprano y tardío, los AIS de tercera generación muestran un mejor perfil de toxicidad, más selectividad, mayor potencia y mejor eficacia clínica en comparación con los fármacos más antiguos. 6
Clasificación4, 7
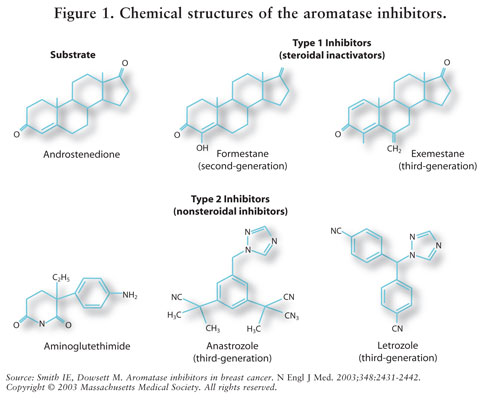
Los AIS se clasifican como inhibidores esteroideos de tipo 1 (no competitivos, irreversibles) o inhibidores no esteroideos de tipo 2 (competitivos, reversibles). El exemestano, un inhibidor de tipo 1, se une irreversiblemente al sitio de la molécula de aromatasa y se conoce como inhibidor del suicidio. Los inhibidores de tipo 2 anastrozol y letrozol se unen reversiblemente a la aromatasa. Véase la FIGURA 1 para las estructuras químicas de los diferentes AIs.
Mecanismo de Acción
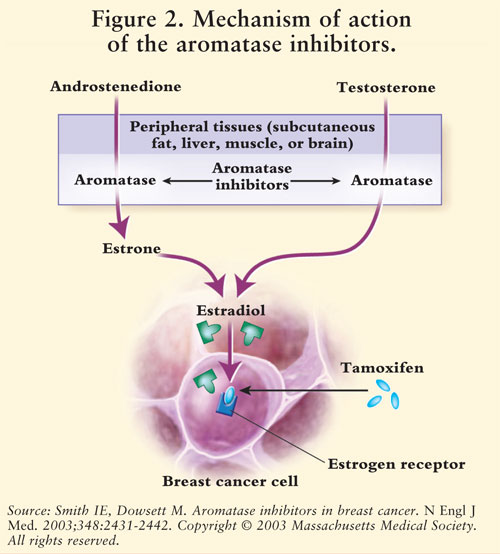
Los estrógenos de síntesis es mediada por la enzima aromatasa.7 La aromatasa convierte la androstenediona y la testosterona en estrona y estradiol.5,7 AIs reducen el estrógeno en mujeres posmenopáusicas, inhibiendo así su efecto cancerígeno en el tejido mamario.7 Debido a que los ovarios de las mujeres premenopáusicas aún funcionan, los AIs no están indicados para esta población fuera de los ensayos clínicos; en estas mujeres, los AIs estimularían el hipotálamo y la hipófisis para aumentar la producción de gonadotropinas.4 Véase LA FIGURA 2.
Toxicidas6,8
Los efectos adversos de los AIs incluyen disfunción cardiovascular, como hipertensión, vasodilatación, edema y dolor en el pecho. Se requieren estudios adicionales para evaluar el efecto completo del AIs en la función cardíaca. Los pacientes pueden experimentar disminución de la densidad mineral ósea( DMO), aumento del riesgo de fractura, síntomas vasomotores, sequedad vaginal, dolor musculoesquelético, dolor de cabeza, insomnio, depresión, aumento de la tos, disnea, molestias gastrointestinales, aumento de peso y posiblemente niveles de lípidos elevados. La pérdida ósea es un efecto secundario predominante; se han utilizado bisfosfonatos como el ácido zoledrónico para contrarrestarla. Los pacientes con AIs deben recibir suplementos de vitamina D y calcio. Aún no se han determinado los efectos adversos prolongados ni los efectos sobre la función cognitiva del tratamiento con IA.9 Los AIS están contraindicados en mujeres embarazadas. El anastrozol inhibe CYP1A2, CYP2C9 y CYP3A4. 10,11 El letrozol es metabolizado por CYP2A6 y CYP2C19, y el exemestano metaboliza los inductores de CYP3A4.8, 10-13 de CYP3A4, como rifampicina, fenitoína, carbamazepina y hierba de San Juan, que pueden causar una disminución de los niveles de exemestano cuando se administran de forma concomitante. 8,12,13 El tamoxifeno causa una disminución del 38% en letrozol y una disminución del 27% en anastrozol cuando se administra conjuntamente.2,7,8,14
Indicaciones y dosificación
Anastrozol 10,11: Anastrozol 1 mg una vez al día está indicado para el cáncer de mama en estadio temprano como terapia adyuvante inicial en mujeres posmenopáusicas con enfermedad sensible a las hormonas y como primera línea para la enfermedad metastásica o localmente avanzada HR+ o HR-desconocida. También está aprobado para su uso después de la terapia con tamoxifeno en mujeres con enfermedad progresiva. No es necesario ajustar la dosis en caso de insuficiencia renal o insuficiencia hepática de leve a moderada.
Letrozole11,12: Letrozole 2.5 mg una vez al día está indicado para mujeres posmenopáusicas con cáncer de mama en estadio temprano HR+ como terapia inicial o como terapia adyuvante prolongada después del tamoxifeno. También está indicado para la enfermedad metastásica HR+ o HR-desconocida. Se recomienda ajustar la dosis en caso de insuficiencia hepática grave.
Exemestane11, 14: Exemestano 25 mg po una vez al día está indicado como terapia adyuvante dos o tres años después del tamoxifeno para mujeres posmenopáusicas con cáncer de mama en estadio temprano HR+, durante un total de cinco años consecutivos de terapia hormonal. También se puede usar para enfermedades que han progresado después de la terapia con tamoxifeno. Debe tomarse después de una comida. No es necesario ajustar la dosis para insuficiencia hepática o renal
Ensayos clínicos
Las toxicidades relacionadas con el tamoxifeno, como el cáncer de endometrio, motivaron el inicio de ensayos clínicos a gran escala que investigaban el uso de AIs de tercera generación en mujeres posmenopáusicas con cáncer de mama HR+. Se utilizaron varios diseños de ensayos para evaluar el rendimiento de estos agentes en comparación con el tamoxifeno.6 Los resultados superiores en términos de eficacia clínica y perfiles de toxicidad establecieron el AIs como un nuevo estándar de terapia adyuvante en mujeres posmenopáusicas con cáncer de mama HR+.ATAC15: ATAC (Arimidex, Tamoxifeno Solo o en Combinación), un estudio multicéntrico, aleatorizado y doble ciego, comparó tres grupos de tratamiento: tamoxifeno 20 mg + placebo de anastrozol, anastrozol 1 mg + placebo de tamoxifeno y una combinación de tamoxifeno 20 mg + anastrozol 1 mg. El objetivo principal fue evaluar la seguridad y eficacia del tamoxifeno frente al anastrozol y la combinación de anastrozol y tamoxifeno durante cinco años. Un total de 9,366 pacientes–3,125 en el anastrozol brazo, 3,116 en el tamoxifeno brazo, y 3,125 en la combinación del brazo-fueron tratados durante una mediana de 33 meses.
Después de tres años, anastrozol demostró una SSE de 89,4% versus 87,4% para el tamoxifeno (cociente de riesgos instantáneos 0,83, IC 95%, P =.013). El anastrozol disminuyó la tasa de cáncer de mama contralateral (BCL) en comparación con el tamoxifeno (odds ratio 0,42, IC 95%, P =.007). El grupo de combinación se cerró porque no se encontró ningún beneficio clínico más allá del tamoxifeno. El anastrozol se relacionó con efectos adversos como cáncer de endometrio (P =.02), sangrado vaginal, secreción (P <.0001), acontecimientos cerebrovasculares (P =.0006), acontecimientos tromboembólicos venosos (P =.0006) y sofocos (P <.0001); el tamoxifeno se asoció con menos fracturas y menos dolor articular (P <.0001). Después de 68 meses, el anastrozol aumentó la SSE (HR 0,87, IC 95%, P =.01) y tiempo hasta la recidiva (CRI 0,79, IC 95%, P =.0005) y disminución de las metástasis a distancia (CRI 0,86, IC 95%, P =.04) y leucocitos (disminución del 42%, P=.01).16 Después de una mediana de intervalo de seguimiento de 100 meses, los pacientes con FC+ tratados con anastrozol mostraron mejorías en la SSE (FC 0,85; P =.003), aparición de leucocitos (HR 0,60, P=.004), tiempo hasta la recurrencia (HR 0,76, P =.0001), y tiempo hasta la recurrencia a distancia (HR 0,84, P=.022) en comparación con los pacientes tratados con tamoxifeno. La diferencia absoluta en las tasas de recurrencia mejoró de 2.8% después de cinco años a 4,8% después de nueve años. Las tasas de fractura de anastrozol fueron más altas durante el tratamiento, pero la diferencia disminuyó sustancialmente después del período de seguimiento de 100 meses. El período de terapia extendida tuvo un riesgo de fractura de 1,15 con anastrozol versus 1,02 con tamoxifeno. El riesgo de cáncer de endometrio se redujo dentro y fuera de la terapia con anastrozol en comparación con el tamoxifeno, con una tasa anual de 0,043 versus 0,14 y 0,014 versus 0,12, respectivamente. No se ha identificado una diferencia en la supervivencia global (SG).
MA.1712,17: MA.17 fue un ensayo aleatorizado, controlado con placebo, doble ciego que evaluó la efectividad de cinco años de terapia con letrozol en mujeres posmenopáusicas con cáncer de mama que ya habían completado cinco años de terapia adyuvante con tamoxifeno. Los pacientes recibieron 2,5 mg de letrozol o placebo al día durante cinco años. La variable principal fue la SSE; las variables secundarias fueron calidad de vida, perfil de seguridad extendido y SG. De los 5.187 pacientes, 2.593 recibieron letrozol y 2.594 recibieron placebo; la mediana de seguimiento fue de 2,4 años.
En el análisis preliminar hubo 207 recidivas locales o metastásicas de cáncer de mama o neoplasias malignas iniciales de leucocitos, 75 en el grupo de letrozol y 132 en el grupo de placebo. Las tasas de SDE proyectadas a cuatro años para los dos grupos fueron del 93% y el 87%, respectivamente (P ?.001 para la evaluación de los DFS). En el grupo de letrozol, la SSE tuvo un CRI de 0,61 (IC 95%, P ?.001). Letrozol demostró una disminución de 43% en la incidencia de cáncer de mama (CRI 0,57, IC 95%, P =.00008).4 Con la excepción de los pacientes con ganglios positivos (P=.04), la SG no alcanzó significación estadística (HR 0,82, P =.30).4 Pacientes en el brazo de letrozol experimentaron síntomas vasomotores de bajo grado, mialgia y artritis. La osteoporosis fue más común (aunque no significativamente) en el grupo de letrozol versus placebo (5,8% vs.4,5%; P=.07), y las tasas de fractura fueron comparables entre los brazos. El estudio se cerró después de una mediana de 2,4 años debido a una disminución de los episodios de cáncer de mama en el grupo de letrozol. La terapia adyuvante prolongada con letrozol después de completar cinco años de tamoxifeno mejoró la SSE.
BIG 1-987,9,18: El estudio Breast International Group (BIG) 1-98, un ensayo aleatorizado multicéntrico, doble ciego, inscribió a 8.028 mujeres posmenopáusicas con cáncer de mama en estadio temprano HR+. El estudio comprendió cuatro grupos de tratamiento que evaluaron cinco años de monoterapia con tamoxifeno, cinco años de monoterapia con letrozol, tamoxifeno durante dos años y luego un cambio a letrozol durante tres años, o letrozol durante dos años y luego un cambio a tamoxifeno durante tres años. El objetivo principal era el DAAT; los objetivos secundarios fueron el tiempo hasta la metástasis a distancia, la seguridad y la SG. La SSE aumentó en los pacientes que recibieron letrozol en comparación con los que recibieron tamoxifeno (CRI de 0,81, IC 95%, reducción relativa de 19%, P =.003), con una diferencia absoluta del 1,5% a los tres años. El tamoxifeno aumentó la aparición de episodios tromboembólicos en comparación con el letrozol (OR 0,38, P <.0001). Las fracturas óseas aumentaron en el brazo con letrozol (OR 1,44, P=.006).
IES14,19: El IES (Intergroup Exemestane Study) fue un estudio aleatorizado, doble ciego, multicéntrico, de fase III, cuyo objetivo era determinar si el cambio a exemestano después de dos o tres años de tamoxifeno fue más eficaz que continuar con el tamoxifeno durante cinco años. El juicio inscrito 4,742 mujeres postmenopáusicas asignados al azar a dos brazos de tratamiento; 2,362 sujetos fueron programados para cambiar a exemestano 25 mg po qd después de dos a tres años de tamoxifeno de 20 mg po qd para completar cinco años de terapia, y el resto de 2.380 que estaban programados para recibir tamoxifeno de 20 mg po qd por cinco años. La SSE fue la variable principal; las variables secundarias fueron la SG, el perfil de toxicidad extendido y la frecuencia de leucocitos.
Los acontecimientos adversos, que ocurrieron durante una mediana de 30,6 meses, incluyeron frecuencia de leucocitos, recidiva local o metastásica y muerte. Hubo 449 eventos, 183 en el grupo de exemestano y 266 en el grupo de tamoxifeno. El grupo de exemestano tuvo un HR sin ajustar de 0,68 (IC del 95%, P <.001 por la prueba de rango logarítmico), que demostró una disminución del riesgo del 32% y fue análoga a una ventaja en SLE de 4.75 (IC del 95%) a los tres años. Después de tres años, el grupo de exemestano tuvo una SSE de 91,5% (IC 95%) en comparación con 86,8% (IC 95%) en el grupo de tamoxifeno. No hubo diferencia significativa en la SG entre los dos grupos, con 93 muertes en el grupo de exemestano y 106 muertes en el grupo de tamoxifeno. Hubo una diferencia significativa en la frecuencia de leucocitos (P =.04) 2 20 sujetos en el grupo de tamoxifeno y nueve en el grupo de exemestano. El uso de exemestano para completar los cinco años de tratamiento después de dos o tres años de tamoxifeno mejoró la SSE en comparación con cinco años de tamoxifeno. Prevención de la Pérdida ósea a causa de la terapia con ai20 Las mujeres posmenopáusicas son propensas a desarrollar una disminución de la DMO debido a la reducción de los niveles de estrógeno. El tratamiento con IA en pacientes posmenopáusicas con cáncer de mama exacerba esta tendencia. El denosumab, un anticuerpo monoclonal de investigación completamente humano, se une al activador del receptor del ligando kB del factor nuclear (RANKL) y previene la actividad del RANKL. El RANKL es vital para la actividad osteoclástica, lo que significa la descomposición del hueso. Se está evaluando la capacidad de denosumab y risedronato, un bisfosfonato, para contrarrestar la pérdida ósea asociada con la terapia de IA.
Estudio de Denosumab 20: Un estudio multicéntrico aleatorizado de fase III evaluó el uso de denosumab 60 mg administrado por vía subcutánea una vez cada seis meses en mujeres posmenopáusicas que tomaban AIs para cáncer de mama HR+ no metastásico. El objetivo fue evaluar el cambio en la DMO de la columna lumbar desde el inicio hasta los 12 meses. De los 252 pacientes, 127 fueron asignados a denosumab y 125 a placebo. Ambos grupos recibieron calcio y vitamina D. La DMO se evaluó mediante absorciometría de rayos X de doble energía. Después de 12 y 24 meses de tratamiento con denosumab o placebo, hubo una diferencia de 5,5% y 7,6%, respectivamente, en el aumento de la DMO en la región de la columna lumbar a favor de denosumab (P <.0,001 para ambos meses). Denosumab demostró un perfil de toxicidad comparable con respecto al placebo. Aún no se ha evaluado el tratamiento con denosumab durante más de 24 meses.
Subestudio óseo IBIS-II 21: El Subestudio Óseo del International Breast Cancer Intervention Study-II (IBIS-II) se derivó del IBIS-II, que evaluó a mujeres posmenopáusicas con una mayor probabilidad de desarrollar cáncer de mama que fueron aleatorizadas a anastrozol o placebo durante cinco años. El subestudio, con una inscripción actual de 700 pacientes, está evaluando risedronato versus placebo para la prevención de la pérdida de DMO en mujeres con puntajes T bajos al inicio del estudio. Un subgrupo de pacientes del ensayo IBIS-II se asignó a una de tres estrategias de tratamiento diferentes en el subestudio. Después de un año de terapia, 350 pacientes con anastrozol y 350 con placebo de IBIS-II recibieron resultados de subestudio. El estrato 1 comprendía 227 pacientes en tratamiento con anastrozol con puntuaciones T normales (¿puntuación T ?1), el estrato 2 comprendía 80 pacientes con osteopenia (ñ2. 5 ? Puntuación T < 1) que fueron asignados a risedronato 35 mg una vez a la semana o placebo, y el estrato 3 comprendió a 43 pacientes con osteoporosis (ñ4 <puntuación T <2,5) que fueron asignados a risedronato 35 mg una vez a la semana.
Para pacientes con osteopenia u osteoporosis al inicio del tratamiento, el risedronato pareció inhibir la pérdida ósea asociada con anastrozol. En el estrato II, el risedronato demostró efectos favorables en la preservación de la DMO para la cadera total, pero no para la columna lumbar (P=.005 y P =.15, respectivamente, frente a placebo). No se asociaron efectos adversos graves ni interacciones medicamentosas con el risedronato.
Ensayo de AIs en Mujeres premenopáusicas (BLANDAS) de 21 a 26 años
Aproximadamente el 33% de las mujeres menores de 50 años recibirán un diagnóstico de cáncer de mama invasivo. 22 El Estudio de supresión de la función Ovárica (SOFT, IBCSG 24-02, BIG 2-02) está investigando el uso de la terapia de IA en mujeres premenopáusicas con cáncer de mama HR+. El ensayo, que tiene una inscripción de pacientes dirigida de 3,000, involucra a mujeres premenopáusicas con cáncer de mama HR+ que han completado quimioterapia o que solo han recibido cirugía. La ablación ovárica se establece mediante la administración de triptorelina (una hormona liberadora de gonadotropina) una vez al mes durante cinco años, ooforectomía quirúrgica o irradiación pélvica. Las pacientes serán aleatorizadas a uno de los tres grupos, el primer grupo recibirá tamoxifeno una vez al día durante cinco años, el segundo grupo recibirá tamoxifeno durante cinco años en combinación con ablación ovárica y el tercer grupo recibirá exemestano durante cinco años en combinación con ablación ovárica. Los pacientes recibirán exemestano o tamoxifeno durante cinco años.
Ensayos de quimioprevención 23-27
El tamoxifeno está indicado para la quimioprevención del cáncer de mama.6 Su perfil de toxicidad es una causa de restricción con respecto al uso terapéutico.6 El AIs puede reducir la incidencia de cáncer de mama HR+ en pacientes de alto riesgo debido a una disminución en la incidencia de glóbulos blancos en comparación con el tamoxifeno en ensayos clínicos como ATAC.6
Los estudios de quimioprevención con IA incluyen el ensayo 31-03 del International Breast Cancer Study Group (IBCSG) (IBCSG 31-03) y el MAP del Instituto Nacional del Cáncer de Canadá.3 juicio. El objetivo principal del ensayo multicéntrico, internacional, aleatorizado, controlado con placebo IBCSG 31-03 es evaluar el uso de anastrozol para la prevención del cáncer de mama en mujeres posmenopáusicas. Su medida de resultado principal es la incidencia de cáncer de mama invasivo y no invasivo; la medida de resultado secundaria es la incidencia de osteoporosis y fracturas.5 El ensayo IBCSG 31-03 tiene un objetivo de inscripción de 6,000. mapeo.3 el ensayo evalúa el exemestano como agente quimiopreventivo en mujeres posmenopáusicas. El objetivo principal de la PAM controlada con placebo.3 el ensayo tiene por objeto evaluar la eficacia del exemestano para disminuir la incidencia de cáncer de mama invasivo.
Usos potenciales en el futuro: Informes de casos
El letrozol se utilizó después del fracaso del clomifeno para inducir la fertilidad en 22 mujeres con síndrome de ovario poliquístico. Letrozol indujo la ovulación en el 75% de los ciclos frente al 44,4% de los ciclos inducidos por clomifeno. Cuatro embarazos resultaron de las ovulaciones inducidas por letrozol, y no se asociaron efectos adversos significativos con letrozol.28,29
Una mujer obesa de 57 años con endometriosis después de histerectomía y salpingooforectomía bilateral recibió anastrozol después de la terapia con megestrol. La paciente no presentó lesiones endometriales después de nueve meses.28,30
A un paciente con síndrome de McCune-Albright se le administró anastrozol para la pubertad prematura; el estradiol del paciente se normalizó después de 2,5 años de anastrozol y la edad ósea avanzó a los seis meses.28,31 El aumento de estrógeno puede inducir ginecomastia e hipogonadismo hipogonadotrópico.28,31 La disminución de estrógeno con un IA resultó en gonadotropina y testosterona normales en hombres con ginecomastia e hipogonadismo hipogonadotrópico. 28,31,32
El letrozol se estudió en pacientes con cáncer de ovario recidivante; las pacientes que recibieron letrozol tuvieron estabilización de la enfermedad.Se administró letrozol neoadyuvante a 28,33 mujeres posmenopáusicas con cáncer de endometrio; el fármaco demostró cambios clínicos constructivos y no tuvo un impacto quirúrgico negativo.28,34
Cuando se comparó el tratamiento con testolactona frente a anastrozol en hombres infértiles, la eficacia de los dos fármacos fue similar.28,35 pacientes con síndrome de Klinefelter recibieron un tratamiento más eficaz con testolactona que con anastrozol.28,35
Conclusiones
Los AIs de tercera generación han mostrado una SSE superior en mujeres posmenopáusicas con cáncer de mama HR+, pero no se ha establecido el beneficio clínico de más de cinco años de terapia con IA en estas pacientes.4 El ensayo B-33 (exemestano) del National Surgical Adjuvant Breast and Bowel Project (NSABP) y una aleatorización posterior de la MA.el ensayo 17 (letrozol) examinará el uso de estos AIs versus placebo durante cinco años adicionales.4 Los AIS son una alternativa adecuada para mujeres posmenopáusicas HR+ en las que el tamoxifeno está contraindicado.4
Los efectos beneficiosos del AIs de tercera generación incluyen un perfil de toxicidad más tolerable y una SSE superior en comparación con el tamoxifeno. El nivel de eficacia entre estos agentes y el tamoxifeno es comparable. Sigue habiendo incertidumbre con respecto a la duración seleccionada de la terapia, el perfil de toxicidad a largo plazo y la secuencia apropiada de administración para el AIs.4 Se necesitan nuevos estudios para producir moduladores selectivos de aromatasa que produzcan menos toxicidad que el AIs.25,36-37
1. Robertson JFR. Fulvestrant (FaslodexÆ) how cómo mejorar una buena droga. Oncólogo . 2007;12:774-784.
2. Osborne CK. Terapia farmacológica: tamoxifeno en el tratamiento del cáncer de mama. N Engl J Med. 1998;339:1609-1618.
3. Red Nacional Integral contra el Cáncer. Directrices de práctica clínica del NCCN en oncología v v. 1. 2008. Cáncer de mama. www.nccn.org/professionals/physician_gls/f_guidelines.asp Consultado el 11 de octubre de 2007.
4. Winer EP, Hudis C, Burstein HJ, et al. American Society of Clinical Oncology technology assessment on the use of aromatase inhibitors as adjuvant therapy for postmenopausal women with hormone receptor-positive breast cancer: status report 2004. J Clin Oncol . 2005;23:619-629.
5. Dunn BK, Wickerham DL, Ford LG. Prevención de cánceres relacionados con hormonas: cáncer de mama. J Clin Oncol. 2005;23:357-367.
6. Smith IE, Dowsett M. Inhibidores de la aromatasa en el cáncer de mama. N Engl J Med. 2003;348:2431-2442.
7. Goss PE, Strasser K. Inhibidores de la aromatasa en el tratamiento y prevención del cáncer de mama. J Clin Oncol . 2001;19:881-894.
8. Lacy CF, Armstrong LL, Goldman MP, et al, eds. Manual de Información sobre Drogas. 13th ed. Hudson, OH: Lexi-Comp; 2005: 117.598.871.
9. Ellis MJ, ed. Inhibidores de la aromatasa para el tratamiento del cáncer de mama. Manhasset, NY: Oncology Publishing Group, CMP Healthcare Media; 2005: 29-45.
10. Prospecto de Arimidex (anastrozol). Wilmington, DE: AstraZeneca Pharmaceuticals LP; mayo de 2007.
11. Arora A, Potter JF. Aromatase inhibitors: current indications and future prospects for treatment of postmenopausal breast cancer. J Am Geriatr Soc. 2004;52:611-616.
12. Femara (letrozole) package insert. East Hanover, NJ: Novartis Pharmaceuticals Corp; December 2006.
13. Shaw G. In preventing breast cancer occurrence…anastrozole beats tamoxifen in ATAC. Clin Oncol News . 1/2008. www.clinicaloncology.com/index.asp?ses=ogst§ion_id=148&mostrar=dept&article_id=9884. Consultado el 17 de marzo de 2008.
14. Prospecto de Aromasin (exemestano). Nueva York, Nueva York: Pfizer Inc; febrero de 2007.
15. Baum M, Budzar AU, Cuzick J, et al, para el Grupo de Trialistas de ATAC. Anastrozol solo o en combinación con tamoxifeno versus tamoxifeno solo para el tratamiento adyuvante de mujeres posmenopáusicas con cáncer de mama precoz: primeros resultados del ensayo aleatorizado ATAC. Lanceta. 2002;359:2131-2139.
16. Howell A, Cuzick J, Baum M, et al, para el Grupo de Trialistas de ATAC. Resultados del ensayo ATAC (Arimidex, Tamoxifeno, Solo o en Combinación) después de completar el tratamiento adyuvante de 5 años para el cáncer de mama. Lanceta. 2005;365:60-62.
17. Goss PE, Ingle JN, Martino S, et al. Un ensayo aleatorizado de letrozol en mujeres posmenopáusicas después de cinco años de terapia con tamoxifeno para el cáncer de mama en estadio temprano. N Engl J Med. 2003;349:1793-1802.
18. Thrlimann B, Keshaviah A, Coates AS, et al, para el Grupo Colaborativo Breast International Group (BIG) 1-98. Una comparación de letrozol y tamoxifeno en mujeres posmenopáusicas con cáncer de mama temprano. N Engl J Med. 2005;353:2747-2757.
19. Coombes RC, Hall E, Gibson LJ, et al, para el Estudio Intergrupo Exemestano. Un ensayo aleatorizado de exemestano después de dos o tres años de terapia con tamoxifeno en mujeres posmenopáusicas con cáncer de mama primario. N Engl J Med. 2004; 350:
1081-1092.
20. Ellis G, Bone HG, Chlebowski R, et al. Un estudio de fase 3 del efecto de la terapia con denosumab sobre la densidad mineral ósea en mujeres que reciben inhibidores de la aromatasa para el cáncer de mama no metastásico. Ponencia presentada en: el 30o Simposio Anual de Cáncer de Mama de San Antonio; 13-16 de diciembre de 2007; San Antonio, TX. Resumen 47.
21. Singh S, Cuzick J, Edwards R, et al. Efecto del anastrozol sobre la densidad mineral ósea después de un año de tratamiento: resultados del subestudio óseo del International Breast Cancer Intervention Study (IBIS-II). Paper presented at: el 30o Simposio Anual de Cáncer de Mama de San Antonio; 13 al 16 de diciembre de 2007; San Antonio, TX. Resumen 28.
22. Dellapasqua S, Colleoni M, Gelber RD, Goldhirsch A. Terapia endocrina adyuvante para mujeres premenopáusicas con cáncer de mama precoz. J Clin Oncol. 2005;23:1736-1750.
23. Instituto Nacional del Cáncer. Tratamiento del cáncer de mama (PDQ). www.cancer.gov/cancertopics/pdq/treatment/breast/healthprofessional Consultado el 26 de diciembre de 2007.
24. Estudios Clínicos de la Facultad de Medicina de Baylor. Ensayo de Supresión de la Función Ovárica (SOFT). www.breastcenter.tmc.edu/clinic/trials/soft.htm Consultado el 26 de diciembre de 2007.
25. Aebi S, Castiglione-Gertsch M. Terapia endocrina adyuvante para pacientes muy jóvenes. Seno. 2003;12:509-515.
26. ClinicalTrials.gov Supresión de la función ovárica más tamoxifeno o exemestano en comparación con el tamoxifeno solo en el tratamiento de mujeres premenopáusicas con cáncer de mama con respuesta hormonal. www.clinicaltrials.gov/. Consultado el 26 de diciembre de 2007.
27. Cuzick J. Inhibidores de la aromatasa para la prevención del cáncer de mama. J Clin Oncol. 2005;23:1636-1643.
28. Karaer O, OruÁ S, Koyuncu FM. Inhibidores de la aromatasa: posibles aplicaciones futuras. Acta Obstet Gynecol Scand. 2004:83:699-706.
29. Mitwally MF, Casper RF. Uso de un inhibidor de la aromatasa para inducir la ovulación en pacientes con una respuesta inadecuada al citrato de clomifeno. Fertil Steril. 2001;75:305-309.
30. Bulun SE, Yang S, Fang Z, et al. Papel de la aromatasa en la enfermedad endometrial. J Esteroide Bioquímico Mol Biol. 2001;79:19-25.
31. Feuillan P, Merke D, Leschek EW, Cutler GB. Uso de inhibidores de la aromatasa en la pubertad precoz. Endocr Relat Cáncer. 1999;6:303-306.
32. Shozu M, Sebastian S, Takayama K, et al. Exceso de estrógeno asociado con nuevas mutaciones de ganancia de función que afectan al gen de la aromatasa. N Engl J Med. 2003;348:1855-1865.
33. Bowman A, Gabra H, Langdon SP, et al. La respuesta a CA 125 se relaciona con la expresión de receptores de estrógeno en un ensayo de fase II de letrozol en cáncer de ovario: identificación de un subgrupo sensible al sistema endocrino. Clin Cancer Res. 2002; 8: 2233-2239.
34. Berstein L, Maximov S, Gershfeld E, et al. Terapia neoadyuvante del cáncer de endometrio con el inhibidor de la aromatasa letrozol: efectos endocrinos y clínicos. Eur J Obstet Gynecol Reprod Biol. 2002;105:161-165.
35. Raman JD, Schlegel PN. Inhibidores de la aromatasa para la infertilidad masculina. J Urol. 2002;167:624-629.
36. Simpson ER, Dowsett M. Aromatase and its inhibitors: significance for breast cancer therapy (en inglés). Recent Prog Horm Res. 2002; 57: 317-338.