care este potențialul redox al unei celule?
mod cititor
potențialele Redox sunt utilizate pentru a caracteriza costul energiei libere și direcția reacțiilor care implică transferul de electroni, una dintre cele mai omniprezente și importante reacții biochimice. Astfel de reacții de reducere-oxidare se caracterizează printr-o schimbare de energie liberă care împărtășește unele caracteristici conceptuale cu cea utilizată pentru a descrie pKa în reacțiile acido-bazice în care transferul de protoni este implicat mai degrabă decât transferul de electroni. În această vinietă, una dintre cele mai abstracte din carte, discutăm despre modul în care potențialul redox poate fi utilizat ca măsură a forței motrice pentru o anumită reacție de reducere a oxidării de interes. Prin contrast, spre deosebire de pH, nu există nici un sens în care se poate atribui un singur potențial redox unei celule întregi.
potențialul redox, sau mai precis potențialul de reducere, al unui compus se referă la tendința sa de a dobândi electroni și, prin urmare, de a fi redus. Unii cititori ar putea aminti mnemonic ” OILRIG „care ne amintește că” oxidarea este pierdere, reducerea este câștig”, unde pierderea și câștigul sunt de electroni. Luați în considerare o reacție care implică un transfer de electroni: AOX + ne– Ared în care n electronii sunt preluați de forma oxidată (Aox) pentru a da forma redusă (Ared) a compusului A. Diferența de potențial redox OQUSTE între donorul de electroni și acceptor este legată de schimbarea de energie liberă asociată a reacției prin intermediul OQUA=NF oqua unde n este numărul de electroni transferați și F este constanta lui Faraday (96.485 J/mol/V sau 100 kJ/mol/v). Prin inspectarea valorilor tabelate ale acestor potențiale, este posibil să se dezvolte o intuiție pentru tendința de transfer de electroni și, prin urmare, a direcției reacției.

Figura 1: un „turn redox” care arată potențialul redox al jumătăților de reacții metabolice comune. Procesele metabolice pot fi văzute ca electroni în mișcare între molecule, captând adesea o parte din energia eliberată pe măsură ce electronii se deplasează de la energie înaltă la stări de energie mai mici ca în glicoliză sau respirație. Electronii donați de” jumătate de reacții ” deasupra pot fi consumați într-o jumătate de reacție mai mică pe turn pentru a finaliza o reacție favorabilă termodinamic. De exemplu, procesul net de glicoliză implică oxidarea glucozei în piruvat cuplată la reducerea NAD+ LA NADH. Deoarece oxidarea glucozei se află în partea de sus a turnului și reducerea NAD+ este sub ea, acest flux de electroni este favorabil termodinamic. Comparând cu bara de scală de hidroliză ATP, putem vedea, de asemenea, că acest flux de electroni este suficient de favorabil pentru a genera ATP. Respirația aerobă implică multe transferuri intermediare de electroni prin lanțul de transport al electronilor. Sunt prezentate mai multe dintre aceste tranziții, inclusiv succinatul de oxidare la fumarat, care este cuplat mecanic la reducerea ubiquinonei la ubiquinol în membranele mitochrondriale interioare. Fiecare dintre aceste transferuri intermediare de electroni trebuie să fie favorabil termodinamic pe cont propriu pentru ca respirația să continue. Comparând cu „scala de hidroliză ATP” putem vedea că transformările individuale din lanțul de transport al electronilor nu sunt suficient de energice pentru a genera ATP pe cont propriu. Cu toate acestea, ele sunt suficient de favorabile pentru a pompa un proton peste celulă sau membrana mitocondrială. Aceasta este baza energetică pentru chimiosmoză: celulele stochează cantități de energie prea mici pentru sinteza ATP în gradientul de protoni de-a lungul unei membrane. Această energie este utilizată ulterior pentru a genera ATP prin conversia gradientului H+ în legături fosfoanhidride pe ATP prin sintaza ATP.deși ATP este adesea pretins a fi moneda energetică a celulei, de fapt, pentru echilibrul energetic al celulei, purtătorii puterii de reducere nu sunt ei înșiși mai puțin importanți. Cel mai important exemplu al acestor purtători este molecula NADH în formele sale reduse sau oxidate (NAD+). Putem folosi potențialul redox pentru a conecta acești doi protagoniști moleculari și pentru a estima o limită superioară a numărului de molecule ATP care pot fi produse din oxidarea NADH (produsă, de exemplu, în ciclul TCA). Perechea nad + /NADH are un potențial redox de E = -0,32 V și este oxidată de oxigen pentru a da apă (protoni proveniți din mediu) cu un potențial redox de E = +0,82 V. ambele sunt prezentate în Figura 1 ca parte a unui „turn redox” al jumătăților biologice cheie reacții care pot fi legate pentru a găsi schimbarea globală a potențialului redox și, astfel, energia liberă. Pentru reacția considerat mai presus de NADH oxidare cu oxigen, maxim asociat liber de energie care poate fi extrasă este, astfel,
ΔG = n x F x ΔE = 2 x 100 kJ/(molxV) x (0.82-(-0.32)) V = 230 kJ/mol≈ 90 kBT,
în cazul în care n=2 și F≈100kJ/mol/V. Ca hidroliza ATP are o energie liberă schimbare de ≈50kJ/mol în condiții fiziologice aflăm că 228 kJ/mol suficient pentru a produce un maxim de 228/50≈4.5 Atp. În celulă, oxidarea NADH trece prin mai multe etape în respirație și are ca rezultat transferul a 10 protoni peste membrană împotriva potențialului electro-chimic (BNID 101773). Aceste transferuri de protoni corespund unui alt mod de captare a energiei biochimice. Această energie este apoi utilizată de ATPase pentru a produce 2-3 ATP-uri. Astfel, descoperim că aproximativ jumătate din energia care a fost eliberată în transferul de electroni de la NADH la oxigen este conservată în ATP. Asigurarea faptului că reacția se desfășoară într-o manieră direcțională pentru a produce ATP, mai degrabă decât pentru a o consuma, necesită ca o parte din energie să fie „irosită”, deoarece sistemul trebuie să fie în afara echilibrului.
de ce ar trebui să discutăm potențialele redox ale jumătăților de reacții și nu energiile libere ale reacțiilor complete? Unitățile în sine își datorează originile capacității din domeniul electrochimiei de a măsura în laborator diferența de tensiune, adică potențialul măsurat în volți, pe două camere care conțin purtători de electroni diferiți și de a opri reacția netă cu o tensiune. Utilitatea potențialelor redox pentru jumătate de reacții constă în capacitatea de a asambla combinații de donatori și acceptori diferiți pentru a evalua fezabilitatea termodinamică și câștigul de energie al fiecărei reacții considerate. Dacă aveți k posibili compuși de transfer de electroni, reacțiile posibile ~k2 pot fi prezise numai pe baza potențialelor k redox.la fel cum vorbim despre pH-ul unei soluții, la prima presupunere, ne-am putea imagina că ar fi posibil să vorbim despre un potențial redox aparent analog al celulei. Cunoașterea concentrației formelor reduse și oxidate ale unei perechi de reacții date definește potențialul redox al grupului lor prin relația
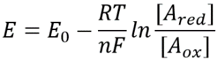
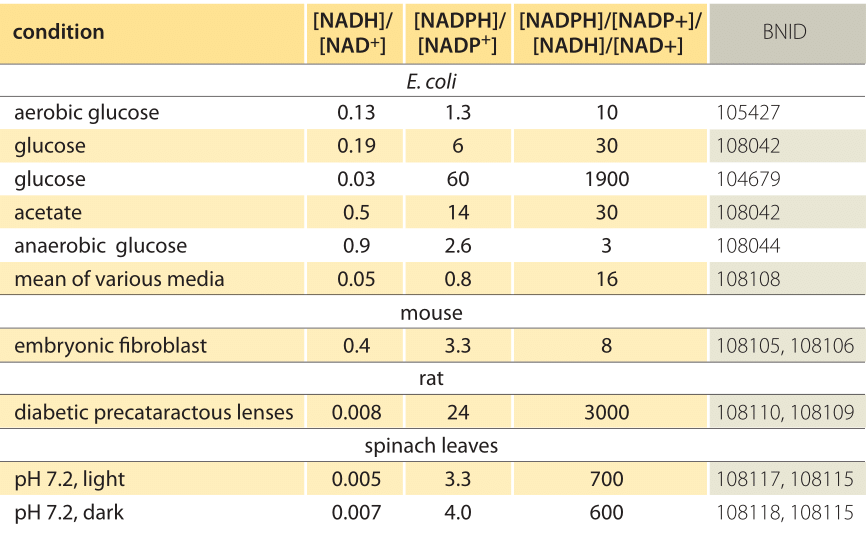
Tabelul 1: raporturile de concentrație ale perechilor comune de donatori de electroni NAD/NADH și NADP/NADPH. După cum se poate observa, primul este relativ oxidat, iar al doilea relativ redus, cu un raport între ele, de obicei, mult mai mare decât 1.
această ecuație (o așa-numită ecuație Nernst) oferă valoarea potențialului redox în condiții de concentrație tipice celulei, spre deosebire de condițiile de stare standard (unde prin definiție =). De exemplu, luați în considerare donarea unui electron către NAD+ rezultând forma oxidată NADH. În matricea mitocondrială este raportat un raport de 10 ori mai mare din forma oxidată (BNID 100779) așa cum se arată în tabelul 1. În acest caz, constatăm că factorul este de 30 MV și astfel potențialul redox se modifică de la -0.32 V la -0.29 V. Pentru a ne asigura că direcția efectului pe care am obținut-o este sensibilă, observăm că, cu o supraabundență a formei oxidate, tendința de a fi oxidată de oxigen este ceva mai mică, așa cum se vede prin faptul că potențialul redox este acum mai aproape decât înainte de cel al perechii de schimb de electroni oxigen/apă (+0,82 V).
o celulă nu este în echilibru și există o cuplare slabă între diferite perechi redox. Această situație duce la stabilirea diferitelor potențiale redox pentru coexistența perechilor redox în celulă. Dacă fluxurile de producție și utilizare a formelor reduse și oxidate ale unei perechi redox, Ared și AOX și o altă rasă și cutie, sunt mult mai mari decât fluxul lor de interconversie, Ared+Box<>AOX+crescut atunci A și B pot avea potențiale redox foarte diferite. Ca urmare, este greșit definit să întrebați despre potențialul redox global al celulei, deoarece va fi diferit pentru diferite componente din celulă. Prin contrast, pH-ul celulei (sau al unui compartiment din ea) este mult mai bine definit, deoarece apa servește ca mediu universal care cuplează diferitele reacții acido-bazice și echilibrează ceea ce este cunoscut sub numele de potențialul chimic al tuturor speciilor.
pentru o pereche redox dată într-un compartiment celular dat, raportul de concentrație al celor două forme prescrie potențialul redox într-o manieră bine definită. Compușii care schimbă rapid electronii vor fi în echilibru relativ și astfel vor împărtăși un potențial redox similar. Pentru a vedea cum se desfășoară aceste idei, este deci foarte util să luăm în considerare o pereche redox care participă la multe reacții celulare cheie și, ca urmare, este strâns legată de starea redox a multor compuși. Glutationul din citoplasmă este un astfel de compus, deoarece participă la reducerea și oxidarea legăturilor tiol foarte răspândite (cele care conțin sulf) în aminoacizii cisteinei din multe proteine. Glutationul este o tripeptidă (compusă din 3 aminoacizi), cea centrală o cisteină care poate fi într-o formă redusă (GSH) sau oxidată, unde formează un dimer cu o cisteină dintr-o altă moleculă de glutation (notată GSSG). Reacția pe jumătate pentru glutation este astfel 2 x GSH <> GSSG + 2e– + 2h+. Cealaltă jumătate de reacție este adesea o legătură de sulf care este” deschisă ” într-o proteină receptivă, fiind astfel menținută în forma redusă datorită acțiunii constante a glutationului. Glutationul este, de asemenea, un jucător dominant în neutralizarea compușilor reactivi care au o tendință ridicată de a smulge electroni și astfel de a oxida alte molecule. Astfel de compuși sunt produși sub stres oxidativ, de exemplu atunci când se atinge capacitatea reacțiilor de transfer de electroni ale respirației sau fotosintezei. Denumite colectiv ROS (specii reactive de oxigen), ele pot crea ravagii în celulă și sunt implicate în multe procese de îmbătrânire. Rolul dublu al glutationului în menținerea proteinelor pliate corect și limitarea ROS, precum și concentrația relativ ridicată și reactivitatea transferului de electroni îl fac principalul proxy pentru starea redox a celulei. Concentrația de glutation în celulă este de 10 mm (BNID 104679, 104704, 111464), făcându-l al doilea metabolit cel mai abundent din celulă (după glutamat), asigurându-se că joacă un rol dominant ca donator de electroni în controlul redox al funcției proteice. În alte funcții ale celulelor există și alte perechi de electroni dominanți. În reacțiile anabolice biosintetice perechea NADP+ / NADPH și în reacțiile catabolice de defalcare este NAD+ / NADH.
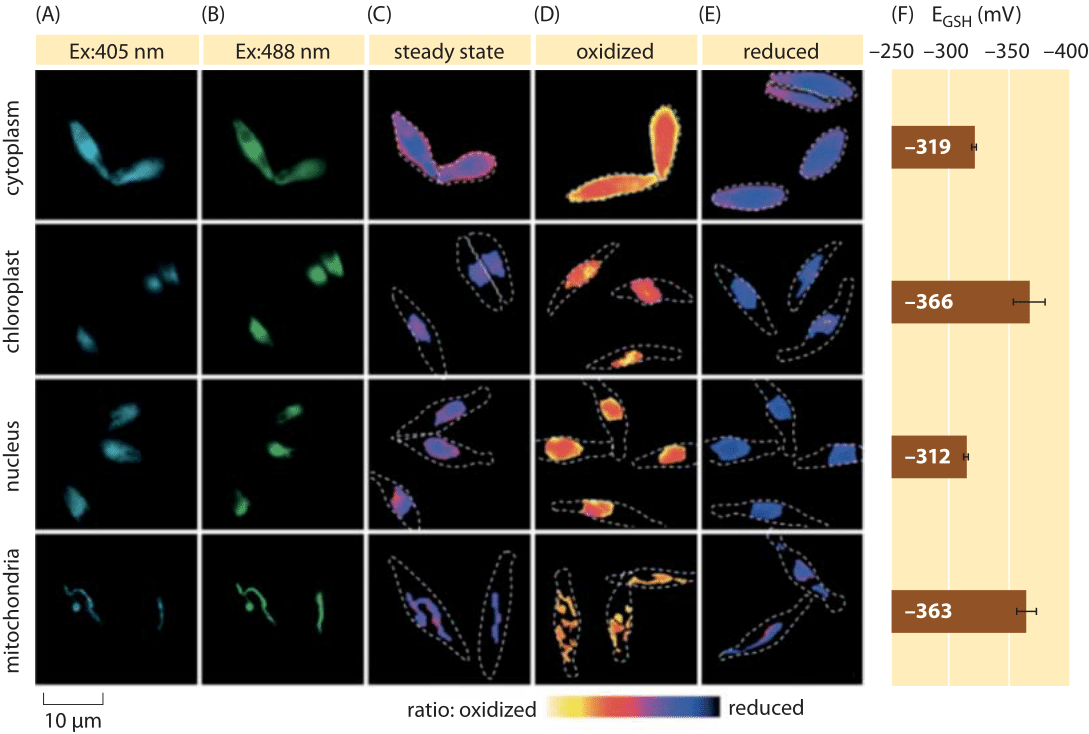
Figura 2: imagistica potențialului redox subcelular al bazinului de glutation în algele de diatomee in vivo. Imagistica prin microscopie fluorescentă a celulelor P. tricornutum care exprimă roGFP2 în diferite localizări subcelulare. Imaginile fluorescente la două lungimi de undă de excitație (a, B), au fost împărțite pentru a obține valori ratiometrice (C). Pentru calibrare, imaginile ratiometrice sunt capturate în condiții de oxidant puternic (150 mM H2O2) (D) și reductor (1 mM DTT) (E). Liniile punctate reprezintă conturul celulelor, desenat pe baza imaginilor de câmp luminoase. (F) potențialul redox la starea de echilibru al grupului de glutation, EGSH în mV, a fost calculat pe baza ecuației Nernst folosind nivelul de oxidare sub valorile pH date pentru fiecare organit. Adaptat de la: S. Graff van Creveld și colab., ISME J., 9: 385, 2015.
cum se măsoară potențialele redox în celulele vii? Un alt beneficiar al Revoluției proteinelor fluorescente a fost subiectul potențialelor redox. Un reporter GFP a fost proiectat pentru a fi sensibil la redox prin încorporarea aminoacizilor cisteinei care afectează fluorescența pe baza reducerii lor de către bazinul de glutation. Figura 2 prezintă rezultatul utilizării unui astfel de reporter pentru a analiza potențialul redox al glutationului în diferite compartimente ale unei diatomee.
Din măsurătorile stării redox a bazinului de glutation în diferite organite celulare și în condiții variate putem deduce raportul dintre concentrațiile formelor reduse și oxidate. Valorile variază de la aproximativ -170 mV în ER și în celulele apoptotice la aproximativ -300 mV în majoritatea celorlalte organite și în celulele de proliferare (BNID 103543, 101823, 111456, 111465). Având în vedere că potențialul redox standard al glutationului este -240 mV (BNID 111453, 111463), care este atunci raportul dintre glutationul redus și cel oxidat? Folosind ecuația Nernst (sau echivalent, din distribuția Boltzmann), o modificare de zece ori a raportului produs/reactant corespunde unei creșteri de 6 kJ/mol în energie liberă (2 KBT). Având în vedere cei 2 electroni transferați în reacția GSH/GSSG, această modificare a raportului de concentrație este de obicei egală cu 30mv, deși pentru glutation, stoichiometria a 2 molecule GSH care fuzionează cu o moleculă legată covalent de GSSG face ca aceasta să fie doar o aproximare. Modificarea de 100 mV raportată în condiții reflectă un raport de concentrații între cantități egale de forme reduse și oxidate (în celulele apoptotice) la o concentrație de peste 1.000 de ori mai mare a formei reduse. Într-adevăr, în majoritatea condițiilor celulare, forma oxidată este doar o fracțiune foarte mică din bazinul general, dar totuși cu implicații fiziologice.
un aspect confuz al reacțiilor redox este că transferul poate lua mai multe forme. Într-un caz, este vorba doar de electroni ca în reacțiile efectuate de citocromi în lanțurile de transfer de electroni. Într-un alt caz comun, este o combinație de electroni și protoni ca în cofactorul NAD+/NADH unde sunt transferați doi electroni și un proton (H+). În cele din urmă, există reacțiile în care același număr de electroni și protoni este transferat atunci când cineva ar fi în mod natural tentat să discute transferul de hidrogeni. Acesta este, de exemplu, cazul reacției generale a oxidării glucozei în care oxigenul este redus la apă. Doi hidrogeni au fost astfel transferați, deci ar trebui să discutăm transferul de electroni, hidrogeni sau protoni? Definiția potențialului redox (dată mai sus) se concentrează numai pe „starea”electronului. Ce se întâmplă cu protonii și ce se întâmplă cu aceștia atunci când se întâlnește un lanț de reacții de transfer de electroni în care unii compuși intermediari conțin protonii de hidrogen și unii nu? Explicația rezidă în apa din jur și pH-ul lor. reacția are loc la un pH dat, iar compușii care reacționează sunt în echilibru cu acest pH și astfel degajarea sau primirea unui proton nu are niciun efect asupra energeticii. Mediul apos servește ca un bazin în care protonii pot fi „parcați” atunci când reacția de transfer este exclusiv de electroni (analogia împrumutată din cartea introductivă de biochimie foarte accesibilă „chimia vieții” de Steven Rose). Acești protoni parcați pot fi împrumutați înapoi în etapele ulterioare, așa cum se întâmplă în stadiul final al respirației oxidative în care citocrom oxidaza ia protoni din mediu. Deoarece se presupune că apa este omniprezentă, nu este nevoie să se țină cont de protoni, cu excepția cunoașterii pH-ului predominant care descrie tendința de a da sau de a primi protoni. This is the reason why we discuss electron donors and acceptors rather than hydrogen donors and acceptors.




