E-Autor:
Dr. Mark Schonbeck, Virginia Association for Biological Farming
- Abstract
- Einführung
- Beschreibung und Identifizierung
- Lebenszyklus, Fortpflanzung, Samenausbreitung, Samenruhe und Keimung
- Wachstumsgewohnheit und Auswirkungen auf Pflanzen
- Management
- Anbau und Flammenjäten
- Mähen und Weiden
- Mulchen
- Nährstoff- und Feuchtigkeitsmanagement
- Fruchtfolge, Pflanzpläne und abgestandenes Saatbett
- Pflanzenwettbewerb und Deckanbau
- Verwaltung der Pigweed Seed Bank
- Dieser Artikel ist Teil einer Serie über die invasive Familie der Schweinekraut. Weitere Informationen finden Sie in den folgenden Artikeln:
- Referenzen zitiert
Abstract
Pigweed ist der gebräuchliche Name für mehrere eng verwandte Sommereinjährige, die in den Vereinigten Staaten und in weiten Teilen der Welt zu wichtigen Unkräutern von Gemüse- und Reihenkulturen geworden sind. Die meisten Pigweeds sind große, aufrechte bis buschige Pflanzen mit einfachen, ovalen bis rautenförmigen, abwechselnden Blättern und dichten Blütenständen (Blütenbüscheln), die aus vielen kleinen, grünlichen Blüten bestehen. Sie entstehen, wachsen, blühen, setzen Samen und sterben innerhalb der frostfreien Vegetationsperiode.Pigweeds gedeihen bei heißem Wetter, tolerieren Trockenheit, reagieren auf hohe Mengen an verfügbaren Nährstoffen und sind angepasst, um Schattierung durch schnelle Stammverlängerung zu vermeiden. Sie konkurrieren aggressiv gegen Pflanzen der warmen Jahreszeit und vermehren sich durch produktive Samenproduktion.
In ökologischen Produktionssystemen kann Schweinekraut durch eine Kombination von verwaltet werden:
- Rechtzeitige Kultivierung, Flammenjäten und manuelle Entfernung
- Abgestandenes Saatbett
- Mulchen
- Fruchtfolgen, die den Zeitpunkt der Bodenbearbeitung und anderer Vorgänge variieren
- Deckfrüchte und wettbewerbsfähige Cash Crops
- Maßnahmen zur Verhinderung oder Minimierung der Produktion von lebensfähigem Saatgut
Einführung
Praktisch jeder Landwirt in Nordamerika kennt und setzt sich mit Pigweed auseinander, einem Begriff, der mehrere Arten der Gattung Amaranthus umfasst, darunter:
- Redroot pigweed (A. retroflexus)
- glattes Schweinekraut (A. hybridus)
- Powell-Amaranth (A. powelii)
- Palmer-Amaranth (A. palmeri)
- stacheliger Amaranth (A. spinosus)
- Taumelschweinekraut (A. albus)
- niederliegendes Schweinekraut (A. blitoides)
- waterhemp (A. tuberculatus = A. rudis)
Diese wärmeliebenden Sommerjahrbücher entstehen nach dem Frühlingsfrostdatum, wachsen schnell, konkurrieren heftig mit Pflanzen der warmen Jahreszeit, vermehren sich durch Samen und sterben mit dem Herbstfrost. Pigweeds sind Hauptunkräuter von Gemüse der warmen Jahreszeit (Webster, 2006) und Reihenkulturen (Sellers et al., 2003).
Pigweeds, auch Amaranthe genannt, sind in Teilen Nord- und Mittelamerikas beheimatet. Kulturpflanzenanbau und menschlicher Handel haben neue Nischen eröffnet, die es Schweinekraut ermöglichen, in landwirtschaftliche Ökosysteme in ganz Amerika sowie in Teile Europas, Asiens, Afrikas und Australiens einzudringen. Die meisten Amaranthe machen nahrhaftes grünes Gemüse oder Getreide, und das bewusste Pflanzen für Nahrung hat einigen Unkrautarten geholfen, sich auf der ganzen Welt zu verbreiten. Keines der hier diskutierten Schweinekraut wird jedoch kommerziell für Getreide angebaut, und moderne Getreide-Amaranth-Sorten gelten nicht als wichtige landwirtschaftliche Unkräuter.
Pigweed-Probleme haben in Direktsaat-Produktionssystemen mit konventionellen Herbiziden zugenommen, die Unkrautsamen an der Oberfläche belassen und für herbizidresistente Populationen auswählen (Sellers et al., 2003). Hohe Schweinekrautpopulationen können jedoch in ökologischen und nicht biologischen Betrieben sowie in konventionellen, Naturschutz- und Direktsaatsystemen auftreten.
Beschreibung und Identifizierung
Schweinekraut ist leicht zu erkennen, aber die korrekte Identifizierung von Schweinekrautarten kann schwierig sein. Zwei oder mehr Pigweed-Arten kommen häufig zusammen auf demselben Feld vor (Abb. 1) können innerhalb einer Art signifikante Variationen auftreten, und gelegentlich treten interspezifische Hybriden auf (Sellers et al., 2003). Einige Forscher betrachten Tall Waterhemp und Common Waterhemp als eine einzige Art: A. tuberculatus (Pratt und Clark, 2001). Die Kansas State University Extension hat einen ausgezeichneten Pigweed Identification Guide mit Fotoillustrationen und einem Schlüssel zur Unterscheidung reifer Pflanzen von neun verschiedenen unkrautartigen Amaranthen veröffentlicht (Horak et al., 1994).

Abbildung 1. Zwei Pigweed-Arten, die vorläufig als Palmer Amaranth (links) und Smooth Pigweed (rechts) identifiziert wurden, wachsen am Rand eines Kunststoff-Mulchbeets in der Bio-Gemüseproduktion in Clemson, South Carolina. Bildnachweis: Mark Schonbeck, Virginia Association für biologische Landwirtschaft.
Neu aufkommende Pigweed-Sämlinge öffnen ein Paar lange, schmale Keimblätter, etwa 0,5 Zoll lang und 0,1 Zoll breit, gefolgt von den ersten echten Blättern, die im Umriss breiter sind (Abb. 2). Pflanzen bilden mäßig tiefe, verzweigte Pfahlwurzeln und können eine deutliche rötliche Färbung an Wurzeln, unteren Stängeln und Blattunterseiten aufweisen.

Abbildung 2. In dieser Phase des Sommers jährliche Unkrautsämlinge, pigweed (Amaranthus sp.) kann durch sein Paar langer, schmaler Keimblätter (Samenblätter) und bei älteren Sämlingen durch echte Blätter mit viel breiterem ovalem Umriss unterschieden werden. Bildnachweis: Mark Schonbeck, Virginia Association für biologische Landwirtschaft.Die meisten Pigweeds wachsen in große, aufrechte bis buschige Pflanzen, 2-7 Fuß in der Höhe, mit einfachen, gestielten (gestielten) Blättern, die abwechselnd (einzeln) auf Stielen angeordnet sind (Abb. 3a). Blattspreiten sind in der Regel oval bis rautenförmig und 2-6 Zoll lang. Prostrate Pigweed bildet eine niedrige, sich ausbreitende Matte mit kleineren (etwa einem Zoll) Blättern, die an der Spitze deutlich eingekerbt sind (Abb. 3b).

Abbildung 3. a. Diese glatten pigweeds im frühen Frühling sind ungefähr vier Fuß hoch. b. Prostrate Pigweed bildet eine niedrige, sich ausbreitende Matte. Fotokredit: Mark Schonbeck, Virginia Vereinigung für biologische Landwirtschaft.
Einzelne Pigweed-Blüten sind klein, unauffällig und normalerweise grünlich gefärbt. Männliche und weibliche Blüten werden auf derselben Pflanze (die meisten Arten) oder separaten Pflanzen (Waterhemp, Palmer Amaranth) getragen. Jede Pflanze trägt Tausende von Blüten in kleinen Büscheln in Blattachseln oder größere, oft verzweigte, dicht gepackte Stacheln an den Spitzen der Hauptstiele und Hauptäste (Abb. 4). Weibliche Blüten bilden einzelne, kleine, runde, meist glänzende, dunkelrotbraune bis schwarze Samen mit einem Durchmesser von etwa 0,04 Zoll (Abb. 5). Etwa 50.000-90.000 Samen wiegen eine Unze.

Abbildung 4. Stacheliger Amaranth (links) und glattes Schweinekraut (rechts) in voller Blüte. Bildnachweis: Mark Schonbeck, Virginia Association für biologische Landwirtschaft.
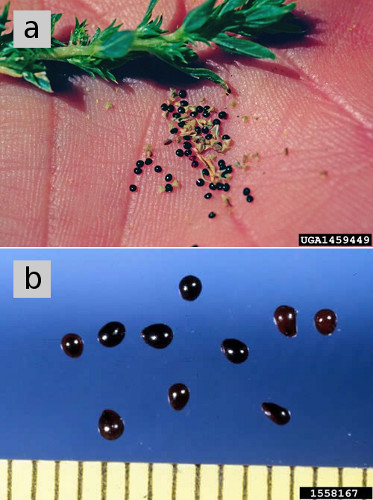
Abbildung 5. (a) Samen von trockenem Schweinekraut. (b) Samen von Redroot Pigweed, vergrößert, mit dunkler, glänzender Samenschale reifer Samen. Abbildung credits: (a) Steve Dewey, Utah State University, Bugwood.org . (b) Ken Chamberlain, Ohio State Universität, Bugwood.org.Siehe Tabelle 1 unten für eine Kurzanleitung zu acht gemeinsamen nordamerikanischen pigweed Arten, mit Links zu zusätzlichen Informationen über jeden.
| Allgemeiner und wissenschaftlicher Name | Wachstumsgewohnheit | Blütenstand* | Geografische Reichweite** | Andere Pflanzenmerkmale |
|---|---|---|---|---|
| Redroot Pigweed Amaranthus retroflexus | Aufrecht, verzweigt, 2-7 ft | Steife, verzweigte Endstacheln, einzelne Zweige normalerweise <2 in lang, dicker als Bleistift | In ganz Nordamerika einschließlich Alaska | Oberer Stiel und Blätter normalerweise mit feinen Haaren bedeckt; blattspreiten groß (6 in) auf kräftigen Pflanzen |
| Glatte Pigweed Amaranthus hybridus | Aufrecht, verzweigt, 2-7 ft | Weiche, stark verzweigte terminale Spikes, einzelne Zweige dünner als Bleistift | In ganz Nordamerika | Ähnlich wie Redroot, aber sehr variabel, viele lokale Varianten, können mit eng verwandten Arten hybridisieren |
| Palmer Amaranth Amaranthus palmeri | Aufrecht, verzweigt, 2-10 ft | Lang (bis 18 in), einfache oder schwach verzweigte Endstacheln; männlich weich, weiblich borstig | Südliche Hälfte der USA., Great Plains, Mexiko | Extrem schnelles, aggressives Wachstum in heißen Klimazonen, männliche und weibliche Blüten auf getrennten Pflanzen; Pflanzen glatt und haarlos |
| Powell Amaranth Amaranthus powellii | Aufrecht, verzweigt, 2-6 ft | Steife, verzweigte Endstacheln, Zweige 4-8 lang, dicker als Bleistift, in der Nähe der Hauptachse gehalten | Im gesamten Norden Amerika |
Erste echte blätter schmaler und mehr verjüngt in Richtung Spitze als Rotwurzel oder glatt; pflanze kann glatt oder behaart sein |
| Stacheliger Amaranth Amaranthus spinosus | Aufrecht bis buschig 1-4 ft | Schlanke, verzweigte Endstacheln meist männliche Blüten; Achselhaufen meist weiblich | In ganz Nordamerika, aber meistens im Südosten der USA | Paar steife, scharfe, eingelassene Stacheln an der Basis jedes Blattes; Stämme glatt, haarlos, oft rot |
| Waterhemp Amaranthus rudis oder A. tuberculatus *** | Aufrecht, hoch 3-10 ft | Schlanke, einfache oder verzweigte Endspitzen | In den gesamten USA. und Südkanada außer trockensten Gebieten | Männliche und weibliche Blüten auf getrennten Pflanzen; Stängel und Blätter glatt und haarlos; Blätter oft länger und schmaler als andere Arten |
| Prostrate Pigweed Amaranthus blitoides | Prostrate bis zu 3 ft über | Kleine, dichte Cluster in Blattachseln | In den USA und Südkanada | Blätter klein (Klinge etwa 1 in) mit ausgeprägter Kerbe an der Spitze; Samen mattschwarz, größer als bei anderen Schweinekraut (0.06 in) |
| Tumble Pigweed Amaranthus albus | Kugelbusch, 1-3 ft Durchmesser | Kleine, dichte Büschel in Blattachseln | In ganz Nordamerika | Reife Pflanzen brechen auf Bodenhöhe ab und werden vom Wind getragen und zerstreuen Samen; Stängel weiß bis hellgrün, Blätter hellgrün |
| * Kleine Büschel von Blumen sind in der Regel in Blattachseln aller amaranth ** In Nordamerika (Kanada, USA, Mexiko); viele Arten haben sich auf anderen Kontinenten eingebürgert. *** Einige Autoren erkennen zwei Arten, gemeinsame waterhemp (A. rudis) und tall waterhemp (A. tuberculatus); andere betrachten sie als Unterart oder synonym. |
||||
Lebenszyklus, Fortpflanzung, Samenausbreitung, Samenruhe und Keimung
Schweinekraut sind frostzarte Sommerjahrbücher, die innerhalb der frostfreien Zeit auftauchen, wachsen, blühen und reifen Samen bilden. Sämlinge entstehen über einen längeren Zeitraum mit großen Spülungen im späten Frühjahr oder Frühsommer (Abb. 6). Bei den meisten Arten finden Blüte und Samenentwicklung hauptsächlich nach der Sommersonnenwende statt, als Reaktion auf die Verkürzung der Tageslängen.
Abbildung 6. Eine Spülung glatter Pigweed-Setzlinge auf einer Gemüsefarm in der Tidewater-Region von Virginia, fotografiert am 20.Juni 2010, etwa zwei Wochen nach dem Auflaufen. Bildnachweis: Mark Schonbeck, Virginia Association für biologische Landwirtschaft.
Schweinekraut vermehrt sich vollständig durch Samen. Eine einzelne große Pflanze kann 100.000–600.000 Samen und Populationen von 0 reifen.1-1 Pflanzen pro Quadratfuß können 10.000 bis 45.000 Samen pro Quadratfuß oder 0,4 bis 2 Milliarden pro Hektar abwerfen (Massinga et al., 2001; Sellers et al., 2003). Diese produktive Samenproduktion macht es besonders schwierig, Schweinekraut zu verwalten, da die erfolgreiche Reifung von nur einer Pflanze pro 10.000 aufkommenden Sämlingen es ermöglichen kann, dass sich die Schweinekrautpopulationen von einem Jahr auf das nächste um das Mehrfache erhöhen.
Schweinekraut beginnt typischerweise etwa sechs Wochen nach dem Auflaufen (WAE) zu blühen und Pollen (Anthesis) abzuwerfen, obwohl Blüten bereits bei 3 WAE oder erst bei 9 WAE auftreten können (Huang et al., 2000; Keeley, et al., 1987; Shrestha und Swanton, 2007). Die Blüten öffnen sich etwa 1-2 Wochen, nachdem die Blütenknospen mit bloßem Auge sichtbar geworden sind.Die angegebenen Zeitintervalle von der Bestäubung bis zur Bildung lebensfähiger Samen reichen von 7-12 Tagen in Waterhemp (Bell und Tranel, 2010) bis zu 6 Wochen in Feldpopulationen von Redroot Pigweed in Ontario (Shrestha und Swanton, 2007). In Kalifornien bildete Palmer Amaranth 2-6 Wochen nach der Blüte lebensfähige Samen (Keeley et al., 1987). Samen werden ungefähr zur gleichen Zeit lebensfähig, zu der sie ihre reife dunkelbraune oder schwarze Farbe entwickeln.
Die Fortpflanzungsentwicklung wird durch die Verkürzung der Tageslänge nach der Sommersonnenwende in Feldpopulationen beschleunigt (Keeley et al., 1987) und verläuft in kurzen (~ 12 Stunden) schneller als in längeren (≥14 Stunden) Photoperioden in einer Wachstumskammer (Huang et al., 2000). Obwohl die meiste Samenproduktion im Spätsommer und Frühherbst stattfindet, wurden einige reife Samen in glatten Pigweed-Samenköpfen zur Sommersonnenwende in Virginia gefunden (persönliche Beobachtung).
Die Fähigkeit von Pigweed-Pflanzen, die bei der Blüte entwurzelt oder abgetrennt wurden, die Samenreifung abzuschließen, wurde nicht untersucht. Im Bundesstaat New York wurde jedoch festgestellt, dass 2-4-Zoll-Fragmente von Powell-Amaranth-Blütenständen, die auf der Bodenoberfläche lagen, 3 Wochen nach der Unkrautbekämpfung bei der Blüte schwarze Samen enthielten (Charles Mohler, Cornell University, Pers. commun.). Wenn die Bestäubung stattfindet, bevor Schweinekraut gezogen oder gehackt wird, besteht anscheinend ein gewisses Potenzial für eine lebensfähige Samenproduktion.
Schweinekrautsamen werden durch Bewässerung oder Hochwasser, Gülle und Boden, der an Schuhen, Traktorreifen oder Bodenbearbeitungswerkzeugen haftet, an neue Standorte verteilt. Darüber hinaus verteilt das Schweinekraut aktiv Samen, wenn reife Pflanzen abbrechen und sich mit dem Wind bewegen.Pigweed-Samen haben mehrere Ruhemechanismen, so dass Samen, die in einer bestimmten Jahreszeit produziert werden, in den nächsten Jahren zu verschiedenen Zeiten keimen, wodurch die langfristige Persistenz des Unkrauts verbessert wird (Egley, 1986). Neu verschüttete Pigweed-Samen sind meist ruhend und werden im folgenden Frühjahr weniger. Die Keimung wird durch hohe Temperaturen (95 ° F), täglich schwankende Temperaturen (z. B. 85-95 ° F Tag, ~ 70 ° F Nacht) und manchmal Licht (Guo und Al-Khatib, 2003) gefördert; Schonbeck und Egley, 1980 und 1981 Steckel et al., 2004).Pigweed tritt am leichtesten aus den oberen 0,5–1,0 Zoll des Bodenprofils aus, wobei nur wenige aus Samen austreten, die tiefer als ein Zoll liegen (Mohler und Di Tommaso, unveröffentlicht). Die Samen benötigen ausreichend Feuchtigkeit und einen guten Samen–Boden-Kontakt, um Feuchtigkeit aufzunehmen und zu keimen. Tiefer vergrabene Samen bleiben mehrere Jahre lang ruhend und lebensfähig und keimen, wenn sie durch Bodenbearbeitung oder Kultivierung an die Oberfläche gebracht werden. Obwohl Spülungen des Auflaufens häufig der Saatbettvorbereitung oder -kultivierung folgen, wurden zunehmende Pigweed-Probleme in agronomischen Kulturen auf die weit verbreitete Einführung von Direkt- und Minimalbearbeitung zurückgeführt, die kürzlich vergossene Unkrautsamen an oder in der Nähe der Bodenoberfläche hinterlassen (Sellers et al., 2003).
Wachstumsgewohnheit und Auswirkungen auf Pflanzen
Schweinekraut hat den Photosyntheseweg C4, der die Fähigkeit verleiht, bei hohen Temperaturen und hohen Lichtverhältnissen schnell zu wachsen, Dürre zu tolerieren und aggressiv mit Gemüse der warmen Jahreszeit um Licht, Feuchtigkeit und Nährstoffe zu konkurrieren. Das Wachstum hängt mit kumulativen Wachstumsgradtagen zusammen, mit einer Basistemperatur von 50 ° F (Shrestha und Swanton, 2007; Horak und Loughin, 2000); So wachsen Schweinekraut in heißen Klimazonen viel schneller als in nördlichen Regionen mit kühleren Sommern.
Aufrechte Pigweed-Arten können kurze Kulturen wie Brokkoli oder Snap Bean schnell überdecken. In höheren Kulturen wie Mais reagieren Pigweeds auf Baldachinschatten, indem sie das Stängelwachstum erhöhen und Blätter höher auf der Pflanze verteilen, wodurch ein größerer Anteil des verfügbaren Lichts abgefangen wird (Massinga et al., 2003; McLachlan et al., 1993). Ein bis drei Pigweed-Pflanzen pro 10 Fuß Reihe, die mit Mais oder Sojabohnen wachsen, können erhebliche Ertragsverluste verursachen (Klingman und Oliver, 1994; Knezevic et al., 1994; Massinga et al., 2001) Schweinekraut, das mehrere Wochen nach dem Auftauchen der Ernte auftaucht, hat einen viel geringeren Einfluss auf die Erträge.
Schweinekraut reagiert sehr gut auf Nährstoffe, insbesondere auf die Nitratform von Stickstoff (N) (Blackshaw und Brandt, 2008; Teyker et al., 1991). Die Düngung verbessert sowohl die Unkrautbiomasse als auch die Samenproduktion. Darüber hinaus kann Nitrat die Keimung von Pigweed-Samen stimulieren (Egley, 1986). Es wurde beobachtet, dass ein Mulch von Hülsenfruchtdeckfruchtresten in einigen Jahren das Auftreten von Schweinekraut verstärkt (Abb. 7), wahrscheinlich als Folge einer schnellen Mineralisierung von Leguminosen (Teasdale und Mohler, 2000).

Abbildung 7. In diesem Feldversuch konkurriert eine Spülung Schweinekraut mit Brokkoli, der direkt in getötete Haarwicke gepflanzt wurde (Vordergrund), während Brokkoli, der in getöteten Roggen oder Roggenwicke gepflanzt wurde, relativ frei von Schweinekraut ist (Hintergrund). Die schnelle N-Mineralisierung aus den Leguminosen-Deckpflanzenresten stimulierte offenbar die Keimung und das Wachstum von Pigweed. Bildnachweis: Mark Schonbeck, Virginia Association für biologische Landwirtschaft.Da die kleinen Samen nur über minimale Nährstoffreserven verfügen, sind Pigweed-Sämlinge zunächst stärker auf leicht verfügbare Nährstoffe aus dem Boden, insbesondere Phosphor (P) und Kalium (K), angewiesen als Pflanzen mit größeren Samen wie Mais, Bohnen und Kürbisgewächse (Hoveland et al., 1976; Mohler, 1996). In Studien, die auf organischen (Mist-) Böden in Florida durchgeführt wurden, reagierten glattes Schweinekraut und stacheliger Amaranth jedoch weniger auf P-Spiegel als Salat, und eine Bandanwendung von P-Dünger verbesserte die Fähigkeit der Ernte, gegen diese Unkräuter zu konkurrieren (Santos et al., 1997; Shrefler et al., 1994).
Pigweeds sind schattenintolerant, und das Wachstum und die Reproduktion von Individuen, die unter einem schweren Erntedach auftauchen, sind erheblich reduziert. Jedoch erlaubt schnelle Stammverlängerung pigweeds, Schattierung in vielen Anbausituationen zu entgehen. Spätsaisonschweinekraut, das etablierte Kürbisgewächse, Tomaten, Paprika und anderes Gemüse durchbricht, kann Pflanzenkrankheiten fördern, indem es die Luftzirkulation verringert, die Ernte beeinträchtigt und viele tausend Samen setzt (Abb. 8).

Abbildung 8. Das Schweinekraut tauchte einige Wochen nach dem Kürbispflanzen auf und hatte keinen Einfluss auf den Ertrag. Am Ende der Ernte reifte jedoch jedes Unkraut Tausende von Samen und wird eine schwere Ablagerung in die Unkrautsamenbank machen, es sei denn, sie werden sofort entfernt. Fotokredit: Mark Schonbeck, Virginia Vereinigung für biologische Landwirtschaft.
Es wird berichtet, dass Schweinekraut Schädlingsnematoden (Meloidogyne spp.) und viele Gemüsepflanzenpathogene, einschließlich Pilze, die frühe Fäule in Kartoffel und Tomate (Alternaria solani), Salattropfen (Sclerotinia sclerotiorum) und südliche Fäule (Sclerotium rolfsii) in einer breiten Palette von Kulturen verursachen. Virale Erreger wie Gurkenmosaikvirus und Tomatenwelkevirus können auch von Schweinekraut übertragen werden (Mohler und DiTommaso, unveröffentlicht).
Schweinekraut ist zum Schwerpunkt der Biokontrollbemühungen mit Pilzpathogenen und Pflanzen fressenden Insekten geworden, obwohl den Landwirten noch keine Biokontrollprodukte zur Verfügung stehen. Der Amaranth-Flohkäfer (Disonycha glabrata) kommt in weiten Teilen der Vereinigten Staaten vor (Tisler, 1990) und ernährt sich von Pigweed-Laub (Abb. 9) und kann in einigen Gebieten, einschließlich Floyd County, Virginia (persönliche Beobachtung), zu einem bedeutenden natürlichen Feind von Pigweed werden. Es kontrolliert jedoch normalerweise nicht das Unkraut und ernährt sich gelegentlich von einigen Gemüsesämlingen.

Abbildung 9. Der Amaranth-Flohkäfer ernährt sich von Pigweed-Laub und es wurde beobachtet, dass er in einigen Teilen Virginias eine erhebliche Entlaubung verursacht und die Unkrautkraft verringert. Dieses Insekt kann gelegentlich zu einem Schädling in Rüben und Mangold werden, indem es sich von Sämlingen ernährt. Bildnachweis: Mark Schonbeck, Virginia Association für biologische Landwirtschaft.
Management
Bio-Landwirte verwalten Schweinekraut, indem sie ihre Schwachstellen ausnutzen. Die kleinen Samen haben minimale Nährstoffreserven; so können Sämlinge nur aus Samen hervorgehen, die sich innerhalb eines Zolls der Bodenoberfläche befinden, und sind sofort vom Boden abhängig, um leicht verfügbare Nährstoffe zu erhalten. Transplantierte und Großsaatkulturen verfügen über erhebliche Nährstoffreserven und können einen Wettbewerbsvorteil gegenüber Pigweed-Sämlingen erzielen, wenn Nährstoffquellen mit langsamer Freisetzung verwendet werden.
Die empfindlichen Sämlinge werden leicht durch Durchtrennen, Entwurzeln, Vergraben oder Hitze getötet. Rechtzeitiges Flammenjäten oder Kultivieren mit einer Vielzahl von Geräten kann eine Spülung von Pigweed-Sämlingen ausschalten. Schwellenschweinekraut ist auch anfällig für Beschattung und körperliche Behinderung durch Mulch. Eine Feldstudie in Beltsville, Maryland, dokumentiert die größere Empfindlichkeit von Pigweed gegenüber der Unterdrückung mit organischen Mulchen im Vergleich zu mehreren anderen häufigen Unkräutern: Redroot pigweed > lamb’s quarter > giant foxtail > velvetleaf (Teasdale und Mohler, 2000).
Rechtzeitiges Handeln ist von entscheidender Bedeutung, da Schweinekraut schnell schwerer zu töten ist, sobald sie größer als ein Zoll werden und vier oder mehr echte Blätter entwickeln (Abb. 10). In kühlen Klimazonen können Pigweed-Sämlinge bis zu 4 WAE anfällig für die Kultivierung bleiben (Weaver und McWilliams, 1980); In wärmeren Klimazonen können sie jedoch innerhalb von 2 WAE auf 2-4 Zoll wachsen (Sellers et al., 2003).

Abbildung 10. Der Pigweed-Sämling auf der rechten Seite befindet sich im anfälligen Stadium, in dem er leicht durch flache Kultivierung oder Beflammung getötet oder durch Mulch blockiert werden kann. Wenn Pigweed so groß wird wie der Sämling auf der linken Seite, wird es schwieriger zu töten, was eine kräftigere Kultivierung erfordert. Fotokredit: Mark Schonbeck, Virginia Vereinigung für biologische Landwirtschaft.
Schweinekrautpopulationen passen sich leicht an Produktionssysteme und Kontrolltaktiken an. Zum Beispiel zeigen Samenkeimungsreaktionen adaptive Änderungen an verschiedene Fruchtfolgen (Brainard et al., 2007), und eine weit verbreitete Herbizidresistenz wurde bei mehreren Arten berichtet (Fugate, 2009; Volenberg et al., 2007). Daher wird die Abhängigkeit von einem einzigen Management-Tool oder der gleichen Strategie Jahr für Jahr wahrscheinlich im Laufe der Zeit abnehmende Renditen bringen.
In Kombination können die unten beschriebenen Verfahren ein effektives Management von Schweinekraut in organischen Systemen ermöglichen.
Anbau und Flammenjäten
Überwachen Sie die Pflanzen regelmäßig auf Unkrautaufkommen. Kultivieren Sie, wenn sich Schweinekraut im Keimblattstadium befindet oder bevor sie einen Zoll hoch werden, und arbeiten Sie so nah wie möglich an der Erntereihe. Wenn die Ernte ausreichend etabliert ist, stellen Sie die Grubber so ein, dass sie etwa einen Zentimeter Boden in Reihen bewegen, um kleine Unkräuter zu begraben. Die oberflächliche Schicht aus lockerem, trockenem Boden, die durch die Kultivierung zurückbleibt (Staubmulch), schreckt die zusätzliche Keimung von Schweinekraut ab. Vermeiden Sie eine erneute Verdichtung des Bodens, da die Verdichtung einen weiteren Auflauf fördern kann (Abb. 11).

Abbildung 11 Der Anbau hinterließ einen Staubmulch um diese jungen Kürbispflanzen, wodurch die Keimung von Schweinekraut und anderen kleinkörnigen Unkräutern verhindert wird. Der Fußverkehr verdichtete den Boden jedoch so weit, dass der Kontakt zwischen Samen und Boden in der Nähe der Oberfläche wiederhergestellt werden konnte, wodurch Unkrautsamen Feuchtigkeit aufnehmen, keimen und in den Fußabdrücken wachsen konnten. Fotokredit: Mark Schonbeck, Virginia Vereinigung für biologische Landwirtschaft.
Flame Weeding kann Pigweed und andere breitblättrige Sämlinge kurz vor dem Auflaufen der Ernte entfernen. Es wird oft für langsam startende Pflanzen wie Karotten, Rüben und Pastinaken verwendet. Da das Abflammen normalerweise keine Graskrautsämlinge abtötet, wird es nicht empfohlen, wenn Gräser einen erheblichen Teil der Unkrautflora ausmachen.
Mähen und Weiden
Sobald die Ernte zu groß ist, um mit dem Traktor kultiviert zu werden, mähen, schneiden oder ziehen Landwirte Unkraut in Gassen, um die Luftzirkulation um die Ernte aufrechtzuerhalten, die Ernte zu erleichtern und die Unkrautvermehrung zu verhindern. Dies sollte vor dem Öffnen der Pigweed-Blüten erfolgen (innerhalb weniger Tage, nachdem die Blütenköpfe zum ersten Mal sichtbar werden), um die Bildung lebensfähiger Samen zu verhindern.
Manche Landwirte mähen Gassen zwischen breiten Reihen oder kunststoffgemulchte Beete mit einem Schubmäher oder Linientrimmer als bodenschonende Alternative zum Anbau. Zwei rechtzeitige Mähungen vor dem Schließen der Überdachung haben eine ausreichende Kontrolle zwischen den Reihen von Riesenfuchsschwanz, Schweinekraut und Ambrosia in Sojabohnen gegeben, die in einem 30-Zoll-Reihenabstand gepflanzt wurden (Donald, 2000).
Die meisten Schweinekraut sind sehr schmackhaft für Vieh. Reife Samen passieren jedoch unversehrt den Verdauungstrakt der Tiere, und Mist ist eine berüchtigte Quelle für Schweinekrautsamen. Daher sollte Schweinekraut beweidet werden, während es noch vegetativ ist. Beachten Sie auch, dass das National Organic Program ein 120-tägiges Intervall zwischen den Dungablagerungen von Weidetieren und der nächsten Ernte von Nahrungspflanzen erfordert.
Mulchen
Mulchen kann eine effektive Bekämpfungstaktik für Schweinekraut in der Gemüseproduktion sein. Ein organischer Mulch, wie 3-4 Zoll Stroh oder Heu (~ 5-10 Tonnen / ac), angewendet innerhalb eines Tages nach dem Anbau einer etablierten Ernte, kann nachfolgende pigweed Entstehung um 90% reduzieren. Alternativ kann ein synthetischer Mulch wie schwarzer Kunststoff vor dem Pflanzen der Kultur gelegt werden und Unkraut durch Anbau, Mähen, organischen Mulch oder Deckfrucht bekämpfen. Beachten: Wenn Kunststoff oder anderer synthetischer Mulch für ökologische Kulturen verwendet wird, muss er am Ende der Ernte oder der Vegetationsperiode vom Feld entfernt werden.
Organisches direktes Umpflanzen von Tomaten und anderem Sommergemüse in rollgecrimpte oder gemähte Winterdeckfrüchte kann leichte bis mittelschwere Schweinekrautpopulationen kontrollieren. Roggenrückstände setzen natürliche Pflanzenwachstumshemmer (Allelochemikalien) frei, die Pigweed und einige andere einjährige Unkräuter unterdrücken (Barnes und Putnam, 1983; Putnam et al., 1983), ohne das transplantierte Gemüse zu beeinträchtigen.
Nährstoff- und Feuchtigkeitsmanagement
Verwenden Sie Quellen mit langsamer Freisetzung von N und anderen Pflanzennährstoffen und vermeiden Sie die Anwendung von Materialien mit schnellerer Freisetzung wie Blutmehl und Knochenmehl, die Pigweed den Sprung auf die Ernte ermöglichen können. Für schwere Feeder wie Brokkoli oder Spinat, die zu Beginn des schnellen Pflanzenwachstums einige schnelle N-, Band- oder Seitenkleidmaterialien innerhalb oder in der Nähe der Erntereihe benötigen.
Verwenden Sie die Reihen-Tropfbewässerung, um Wasser und flüssigen organischen Dünger direkt an die Ernte zu liefern, ohne Unkraut zwischen den Reihen zu füttern und zu gießen. Unterirdische Tropfleitungen können die Ernte mit Feuchtigkeit versorgen und die Bodenoberfläche trocken lassen, wodurch das Auftreten von Unkraut innerhalb der Reihe minimiert wird.
Fruchtfolge, Pflanzpläne und abgestandenes Saatbett
Planen Sie die Fruchtfolge und planen Sie Feldoperationen, um die Lebenszyklen von Schweinekraut zu stören. Vermeiden Sie es, Jahr für Jahr eine offene Nische (kahler Boden) für das Auftauchen von Schweinekraut im späten Frühjahr bis Frühsommer bereitzustellen. Abwechselndes Gemüse der warmen und kühlen Jahreszeit. Erwägen Sie, die Saatbettvorbereitung für ein Sommergemüse bis nach dem Auflaufen der Schweinekraut zu verzögern. Drehen Sie das Feld nach mehreren Jahren intensiver Gemüseproduktion zwei oder drei Jahre lang auf mehrjährige Grasnarbe (z. B. Orchardgrass–Rotklee), um die Lebenszyklen von Schweinekraut zu stören und die Räuberei von Unkrautsamen zu fördern.
Wenn die Schweinekrautpopulationen hoch sind (Abb. 12), bereiten eine abgestandene saatbett im späten frühjahr zu ziehen unten die unkraut samen bank. Bis oder kultivieren, dann rolle oder cultipack die boden zu verbessern samen-boden kontaktieren, wodurch die förderung unkraut keimung. Sprinkle bewässern, wenn der Boden trocken ist. Wiederholen Sie die Kultivierung nach Bedarf. Verwenden Sie kurz vor dem Pflanzen oder Auflaufen der Ernte eine flache Kultivierung und lassen Sie die Oberfläche locker, um eine zusätzliche Unkrautkeimung zu verhindern. Der letzte Flush kann auch durch Flamme getötet werden, wenn Gras Unkraut wenige oder abwesend sind.

Abbildung 12. Ein Teppich aus stacheligen Amaranth-Sämlingen entsteht aus einer großen Unkrautsamenbank. Ein abgestandenes Saatbeet oder kultivierte Brache ist erforderlich, um diese Situation unter Kontrolle zu bringen. Bildnachweis: Mark Schonbeck, Virginia Association für biologische Landwirtschaft.
Pflanzenwettbewerb und Deckanbau
Mit einer guten Unkrautbekämpfung zu Beginn der Saison können kräftige Kulturen wie Tomaten, Süßkartoffeln und Winterkürbis später aufkommende Schweinekraut tolerieren. Jedoch kann Erntekonkurrenz pigweeds, wegen ihrer Schattenvermeidungsreaktion und Fähigkeit, die Erntedecke durch schnelle Stammverlängerung zu durchbrechen, nicht kontrollieren.Kompetitive Sommerdeckfrüchte wie Buchweizen, Sorghum–Sudangras, Kuherbsen und Futtersojabohnen werden häufig verwendet, um Unkraut zwischen Frühlings- und Herbstgemüsekulturen zu unterdrücken. In Florida reduzierten Cowpea-, Sunnhemp- oder Velvetbean-Deckfrüchte, die mit hohen Raten ausgesät wurden, das glatte Pigweed-Wachstum (Collins et al., 2008).
Wenn Sie Sommerdeckfrüchte zur Bekämpfung von Schweinekraut verwenden, säen Sie mit hohen Raten (1,5–2 mal normal) und verwenden Sie gute Aussaatmethoden, um einen unkrautunterdrückenden Deckfruchtstand zu erhalten. Kombinieren Sie Cowpea, Futtersoyabohne oder andere Sommerleguminosen mit einem hohen Gras wie Perlhirse oder Sorghum–Sudangrass, um einen Baldachin zu entwickeln, der sowohl hoch als auch dicht ist. Beobachten Sie die Ernte genau; wenn eine erhebliche Menge an Pigweed mitwächst, beenden Sie die Ernte sofort, wenn Unkrautblütenköpfe zum ersten Mal erscheinen.
Verwaltung der Pigweed Seed Bank
Da Pigweeds so viel Saatgut produzieren, ist es wichtig, den jährlichen Samenregen auf den Boden zu minimieren. Obwohl eine strenge Unkrautbekämpfung für sechs Jahre die Samenbank von Pigweed um 99% reduzieren kann, ermöglicht eine entspannte Unkrautbekämpfung, dass sich die Samenzahlen innerhalb von drei Jahren auf nahezu das ursprüngliche Niveau erholen (Schweizer und Zimdahl, 1984). Pigweed, das nach der minimalen unkrautfreien Periode einer Ernte auftaucht, kann den Ertrag der Ernte nicht verringern, aber es sollte vor der Blüte gezogen oder geschnitten werden, um die Bildung von reifen Samen zu verhindern.
Es kann sich lohnen, Felder mit reifenden Pflanzen zu betreten, um große Unkräuter herauszuziehen oder auszuhacken; kleine, verkümmerte Schweinekraut unter einem Erntedach bilden nur eine kleine Anzahl von Samen. Wenn sich bereits Blütenköpfe gebildet haben, entfernen Sie abgetrennte oder entwurzelte Pigweed-Pflanzen vom Feld. Wenn Pigweed-Pflanzen bereits Samen gebildet haben, beachten Sie, dass viele der Samen bis zum Winter im Kopf bleiben. Daher kann das Entfernen des Unkrauts im Frühherbst den Pigweed-Samenregen immer noch erheblich reduzieren.
Für den Fall, dass ein starker Samenregen auftritt, empfehlen einige Unkrautforscher eine Inversionsbearbeitung, um Samen in eine Tiefe zu bringen, aus der sie nicht austreten können (Mohler und Di Tommaso, unveröffentlicht). Obwohl 5-14% der Redroot Pigweed- und Waterhemp-Samen 9-12 Jahre überlebt haben, wurden sie in Nebraska in einer Tiefe von 8 Zoll begraben (Burnside et al., 1996), andere haben berichtet, dass Pigweed-Samen in feuchteren Regionen wie Mississippi und Illinois (Buhler und Hartzler, 2001; Egley und Williams, 1990; Steckel et al., 2007). Es wurde berichtet, dass das Pflügen von Schimmelpilzen das Auftreten von Schweinekraut erhöht, wenn die Unkrautpopulationen niedrig sind, aber das Auftreten verringert, wenn die Populationen infolge eines kürzlichen Samenregens hoch sind (Schweizer und Zimdahl, 1984).
Wenn Sie Inversionsbearbeitung verwenden, um eine schwere Saatgutablagerung zu verwalten, pflügen Sie das Feld einmal mit einem Brett und vermeiden Sie dann in den nächsten Jahren eine tiefe Bodenbearbeitung, damit vergrabene Samen ihre Lebensfähigkeit verlieren können.
Dieser Artikel ist Teil einer Serie über die invasive Familie der Schweinekraut. Weitere Informationen finden Sie in den folgenden Artikeln:
- Unkrautprofil: Schweinekraut (Amaranthus spp.(Amaranthus retroflexus)
- Powell-Amaranth (Amaranthus powellii)
- Stacheliger Amaranth (Amaranthus spinosus)
- Palmer-Amaranth (Amaranthus palmeri)
- Glatter Pigweed (Amaranthus hybridus)
- Tumble Pigweed (Amaranthus albus)
- Prostrate pigweed (Amaranthus blitoides)
- Gemeinsame Waterhemp (Amaranthus rudis) und Tall Waterhemp (A. tuberculatus)
Referenzen zitiert
- Barnes, J. P. und A. R. Putnam. 1983. Roggenrückstände tragen zur Unkrautbekämpfung in Direktsaatanlagen bei. Zeitschrift für chemische Ökologie 9: 1045-1057. (Online verfügbar unter: http://dx.doi.org/10.1007) (verifiziert am 10. September 2012).
- Bell, M. S. und P. J. Tranel. Zeitbedarf von der Bestäubung bis zur Samenreife in waterhemp (Amaranthus tuberculatus). Unkrautwissenschaft 58: 167-173. (Online verfügbar unter: http://dx.doi.org/10.1614/WS-D-09-00049.1) (verifiziert am 10. September 2012).
- Blackshaw, R. E. und R. N. Brandt. 2008. Stickstoffdünger Rate Auswirkungen auf Unkraut Wettbewerbsfähigkeit ist artenabhängig. Unkrautwissenschaft 56: 743-747. (Online verfügbar unter: http://dx.doi.org/10.1614/WS-08-065.1) (verifiziert am 10. September 2012).
- Brainard, D. C., A. DiTommaso und C. A. Mohler. 2007. Intraspezifische Variation der Sameneigenschaften von Powell Amaranth (Amaranthus powellii) aus Lebensräumen mit kontrastierender Fruchtfolgegeschichte. Unkrautwissenschaft 55: 218-226. (Online verfügbar unter: http://dx.doi.org/10.1614/WS-06-134.1) (verifiziert am 10. September 2012).
- Bühler, D. D. und R. G. Hartzler. 2001. Entstehung und Persistenz von Samen von Velvetleaf, Common Waterhemp, Woolly Cupgrass und Giant Foxtail. Unkrautwissenschaft 49: 230-235. (Online verfügbar unter: http://dx.doi.org/10.1614/0043-1745(2001)049%5B0230:EAPOSO%5D2.0.CO ;2) (überprüft 10 September 2012).
- Burnside, O. C., R. G. Wilson, S. Weisberg und K. G. Hubbard. 1996. Samenlebensdauer von 41 Unkrautarten über 17 Jahre in Ost- und West-Nebraska. Unkrautwissenschaft 44: 74-86. (Online verfügbar unter: http://www.jstor.org/stable/4045786) (verifiziert am 10. September 2012).
- Collins, A. S., C. A. Chase, W. M. Stall und C. M. Hutchinson. 2008. Optimale Dichte von drei Hülsenfrüchten zur Unterdrückung von glattem Schweinekraut (Amaranthus hybridus). Unkrautwissenschaft 56: 753-761. (Online verfügbar unter: http://dx.doi.org/10.1614/WS-07-101.1) (verifiziert am 10. September 2012).
- Donald, W. W. 2000. Reihenzwischenmähen + Reihenbandherbizid zur Unkrautbekämpfung in Glycin max. Unkrautwissenschaft 48: 487-500. (Online verfügbar unter: http://www.jstor.org/stable/4046280) (verifiziert am 10. September 2012).
- Egley, G. H. 1986. Stimulation der Keimung von Unkrautsamen im Boden. Bewertungen von Weed Science 2: 67-89.
- Egley, G. H. und R. D. Williams. 1990. Rückgang von Unkrautsamen und Keimlingsauflauf über fünf Jahre als von Bodenstörungen betroffen. Unkrautwissenschaft 38: 504-510. (Online verfügbar unter: http://www.jstor.org/stable/4045064) (verifiziert am 10. September 2012).
- Fugate, L. 2009. Schweinekraut veranlasst die Landwirte, die Anbaumethoden zu überdenken. University of Arkansas Abteilung für Landwirtschaft Cooperative Extension Service News – Oktober 2009.
- Guo, P. und K. Al-Khatib. 2003. Temperatureffekte auf Keimung und Wachstum von Redroot pigweed (Amaranthus retroflexus), Palmer Amaranth (A. palmeri) und gemeinsame waterhemp (A. rudis). Unkrautwissenschaft 51: 869-875. (Online verfügbar unter: http://dx.doi.org/10.1614/P2002-127) (verifiziert am 10. September 2012).
- Horak, M. J. und T. M. Loughin. 2000. Wachstumsanalyse von vier Amaranthus-Arten. Unkrautwissenschaft 48: 347-355. (Online verfügbar unter: http://dx.doi.org/10.1614/0043-1745(2000)048%5B0347:GAOFAS%5D2.0.CO ;2) (überprüft 10 September 2012).
- Horak, M. J., D. E. Peterson, D. J. Chessman und L. M. Wax. 1994. Pigweed Identifikation: ein bildlicher Leitfaden für die gemeinsame pigweeds der Great Plains. 12 S. (Online verfügbar unter: http://www.ksre.ksu.edu/bookstore/pubs/S80.pdf) (verifiziert 6 Aug 2013).
- Hoveland, C. S., G. A. Buchanan und M. C. Harris. 1976. Reaktion von Unkräutern auf Bodenphosphor und Kalium. Unkrautwissenschaft 24: 194-201. (Online verfügbar unter: http://www.jstor.org/stable/4042586) (verifiziert 10 Sept 2012).
- Huang, J. Z., A. Shrestha, M. Tollenar, W. Deen, H. Rahimian, und C. J. Swanton. 2000. Wirkung der Photoperiode auf die phänologische Entwicklung von Redroot pigweed (Amaranthus retroflexus L.). Kanadisches Journal für Pflanzenwissenschaften 80: 929-938.
- Keeley, P. E., C. H. Carter und R. J. Thullen. 1987. Einfluss des Pflanzdatums auf das Wachstum von Palmer Amaranth (Amaranthus palmeri). Unkrautwissenschaft 35: 199-204. (Online verfügbar unter: http://www.jstor.org/stable/4044391) (verifiziert am 10. September 2012).
- Klingman, T. E. und L. R. Oliver. 1994. Palmer Amaranth (Amaranthus palmeri) Störungen in Sojabohnen (Glycine max). Unkrautwissenschaft 42: 523-527. (Online verfügbar unter: http://www.jstor.org/stable/4045448) (verifiziert am 10. September 2012).
- Knezevic, S. Z., S. F. Weise und C. J. Swanton. 1994. Interferenz von Redroot Pigweed (Amaranthus retroflexus) in Mais (Zea mays). Unkrautwissenschaft 42: 568-573. (Online verfügbar unter: http://www.jstor.org/stable/4045456) (verifiziert am 10. September 2012).
- Massinga, R. A., R. S. Currie, M. J. Horak und J. Boyer, Jr. 2001. Interferenz von Palmer Amaranth in Mais. Unkrautwissenschaft 49: 202-208. (Online verfügbar unter: http://dx.doi.org/10.1614/0043-1745(2001)049%5B0202:IOPAIC%5D2.0.CO ;2) (überprüft 10 September 2012).
- Massinga, R. A., R. S. Currie, und T. P. Trooien. 2003. Wassernutzung und Lichtabfangen unter Palmer Amaranth (Amaranthus palmeri) und Mais Wettbewerb. Unkrautwissenschaft 51: 523-531. (Online verfügbar unter: http://dx.doi.org/10.1614/0043-1745(2003)051%5B0523:WUALIU%5D2.0.CO ;2) (überprüft 10 September 2012).
- McLachlan, S. M., M. Tollenaar, C. J. Swanton und S. F. Weise. 1993. Wirkung der maisinduzierten Schattierung auf die Ansammlung, Verteilung und Architektur von Rotwurzelschweinkraut (Amaranthus retroflexus). Unkrautwissenschaft 41: 568-573. (Online verfügbar unter: http://www.jstor.org/stable/4045424) (verifiziert 10 Sept 2012).
- Mohler, C. A. 1996. Ökologische Grundlagen für die kulturelle Bekämpfung von einjährigen Unkräutern. Zeitschrift für Produktionslandwirtschaft 9: 468-474..
- Mohler, C. A. und A. DiTommaso. Unveröffentlicht. Verwalten Sie Unkraut auf Ihrem Bauernhof: ein Leitfaden für ökologische Strategien. Abteilung für Pflanzen- und Bodenwissenschaften, Cornell University. Vorveröffentlichungsentwurf, Version 5.1. Veröffentlichung voraussichtlich 2012.
- Pratt, D. B. und L. G. Clark. 2001. Amaranthus rudis und A. tuberculatus – eine oder zwei Arten? Zeitschrift der Torrey Botanical Society 128: 282-296. (Online verfügbar unter: http://www.jstor.org/stable/3088718) (verifiziert am 10. September 2012).
- Putnam, A. R., J. DeFrank und J. P. Barnes. 1983. Nutzung der Allelopathie zur Unkrautbekämpfung in einjährigen und mehrjährigen Anbausystemen. Zeitschrift für chemische Ökologie 9: 1001-1010. (Online verfügbar unter: http://dx.doi.org/10.1007) (verifiziert 10 Sept 2012).
- Santos, B. M., J. A. Dusky, D. G. schilling, W. M. Stall und T. A. Bewick. 1997. Wirkung der Phosphorfruchtbarkeit auf kompetitive Wechselwirkungen von glattem Schweinekraut (Amaranthus hubridus), stacheligem Amaranth (Amaranthus spinosus) und Portulak (Portulaca oleracea) mit Salat. Weed Science Society von Amerika Abstracts 37: 54.
- Schönbeck, M. W. und G. H. Egley. 1980 Redroot Pigweed (Amaranthus retroflexus) Samenkeimung Reaktionen auf Nachreifung, Temperatur, Ethylen und einige andere Umweltfaktoren. Unkrautwissenschaft 28: 543-548. (Online verfügbar unter: http://www.jstor.org/stable/4043277) (verifiziert am 10. September 2012).
- Schönbeck, M. W. und G. H. Egley. 1981. Veränderungen der Empfindlichkeit von Amaranthus retroflexus L.-Samen gegenüber Ethylen während der Präinkubation. II. Auswirkungen von Temperaturwechsel und Erdverlegung. Pflanze, Zelle und Umwelt 4: 237-242. (Online verfügbar unter: http://dx.doi.org/10.1111/1365-3040.ep11611005) (verifiziert am 10. September 2012).
- Schweizer, E. E. und R. L. Zimdahl. 1984. Unkrautsamen Rückgang in bewässerten Böden nach sechs Jahren der kontinuierlichen Mais (Zea mays) und Herbizide. Unkrautwissenschaft 32: 76-83. (Online verfügbar unter: http://www.jstor.org/stable/4043886) (verifiziert 10 Sept 2012).
- Sellers, B. A., R. J. Smeda, W. G. Johnson, J. A. Kendig und M. R. Ellersieck. 2003. Vergleichendes Wachstum von sechs Amaranthus-Arten in Missouri. Unkrautwissenschaft 51: 329-333. (Online verfügbar unter: http://dx.doi.org/10.1614/0043-1745(2003)051%5B0329:CGOSAS%5D2.0.CO ;2) (überprüft 10 September 2012).
- Shrefler, J. W., J. A. Dusky, D. G. Schilling, B. J. Brecke und C. A. Sanchez. 1994. Wirkung der Phosphorfruchtbarkeit auf die Konkurrenz zwischen Salat (Lactuca sativa) und stacheligem Amaranth (Amaranthus spinosus). Unkrautwissenschaft 42: 556-560. (Online verfügbar unter: http://www.jstor.org/stable/4045454) (verifiziert am 10. September 2012).
- Shrestha, A. und C. J. Swanton. 2007. Parametrisierung der phänologischen Entwicklung ausgewählter einjähriger Unkräuter unter unbeschnittenen Feldbedingungen. Unkrautwissenschaft 55: 446-454. (Online verfügbar unter: http://dx.doi.org/10.1614/WS-06-176.1) (verifiziert am 10. September 2012).Steckel, L. E., C. L. Sprague, E. W. Stoller und L. M. Wax. 2004. Temperatureffekte auf die Keimung von neun Amaranthus-Arten. Unkrautwissenschaft 52: 217-221. (Online verfügbar unter: http://dx.doi.org/10.1614/WS-03-012R) (verifiziert am 10. September 2012).Steckel, L. E., C. L. Sprague, E. W. Stoller, L. M. Wax und F. W. Simmons. 2007. Bodenbearbeitung, Anbausystem und Bodentiefe Auswirkungen auf gemeinsame waterhemp (Amaranthus rudis) Samenbank Persistenz. Unkrautwissenschaft 55: 235-239. (Online verfügbar unter: http://dx.doi.org/10.1614/WS-06-198) (verifiziert 10 Sept 2012).
- Teasdale, J. R. und C. L. Mohler. 2000. Die quantitative Beziehung zwischen dem Auftreten von Unkraut und den physikalischen Eigenschaften von Mulchen. Unkrautwissenschaft 48: 385-392. (Online verfügbar unter: http://dx.doi.org/10.1614/0043-1745(2000)048%5B0385:TQRBWE%5D2.0.CO ;2) (überprüft 10 September 2012).
- Teyker, R. H., H. D. Hölzer und R. A. Liebl. 1991. Mais und pigweed Reaktion auf Stickstoffversorgung und Form. Pflanze und Boden 135: 287-292. (Online verfügbar unter: http://dx.doi.org/10.1007) (verifiziert am 10. September 2012).
- Tisler, A. M. 1990. Fütterung im Pigweed Flohkäfer, Disonycha glabrata Fab. (Coleoptera: Chrysomelidae), an Amaranthus retroflexus. Virginia Zeitschrift der Wissenschaft 41: 243-245.
- Volenberg, D. S., W. L. Patzoldt, A. G. Hager und P. J. Tranel. 2007. Antworten von zeitgenössischen und historischen waterhemp (Amaranthus tuberculatus) Beitritte zu Glyphosat. Unkrautwissenschaft 55: 327-333. (Online verfügbar unter: http://dx.doi.org/10.1614/WS-06-121) (verifiziert am 10. September 2012).
- Weaver, S. E. und E. L. McWilliams. 1980. Die Biologie der kanadischen Unkräuter. 44. Amaranthus retroflexus L, A. powellii S. Wats und A. hybridus L. Canadian Journal of Plant Science 60: 1215-1234.
- Webster, T. M. 2006. Weed Survey – Südstaaten. Unterabschnitt Gemüse-, Obst- und Nusskulturen. Verfahren der Southern Weed Science Society 59: 260-277. (Online verfügbar unter: http://www.swss.ws/wp-content/uploads/docs/Southern%20Weed%20Survey%202006%20Vegetables%20and%20Fruits.pdf) (verifiziert am 10. September 2012).