eOrganic author:
Dr. Mark Schonbeck, Virginia Association for Biological Farming
- Resumen
- Introducción
- Descripción e identificación
- Ciclo de vida, Reproducción, Dispersión de Semillas, Latencia de Semillas y Germinación
- Hábito de crecimiento e Impacto en los cultivos
- Gestión
- Cultivo y Deshierbe a llama
- Siega y pastorea
- Mulching
- Gestión de nutrientes y humedad
- Rotación de cultivos, Cronogramas de Siembra y Semillero Rancio
- Competencia de cultivos y Cultivos de cobertura
- Gestión del Banco de Semillas de algodoncillo
- Este artículo es parte de una serie que analiza la familia invasora de las algodoncillos. Para obtener más información, consulte los siguientes artículos:
- Referencias
Resumen
Pigweed es el nombre común de varias plantas anuales de verano estrechamente relacionadas que se han convertido en las principales malezas de cultivos de hortalizas y de hileras en los Estados Unidos y gran parte del mundo. La mayoría de las algodoncillas son plantas altas, erectas a arbustivas con hojas simples, ovaladas a romboidales, alternas, e inflorescencias densas (racimos de flores) compuestas de muchas flores pequeñas y verdosas. Emergen, crecen, florecen, siembran y mueren dentro de la temporada de crecimiento libre de heladas.
Las algodoncillos prosperan en climas cálidos, toleran la sequía, responden a altos niveles de nutrientes disponibles y se adaptan para evitar el sombreado a través de un alargamiento rápido del tallo. Compiten agresivamente contra los cultivos de temporada cálida y se reproducen mediante la producción prolífica de semillas.
En los sistemas de producción orgánica, las semillas de porcino se pueden manejar mediante una combinación de:
- Cultivo oportuno, deshierbe a llama y extracción manual
- Semillero rancio
- Acolchado
- Rotaciones de cultivos que varían en el momento de la labranza y otras operaciones
- Cultivos de cobertura y cultivos comerciales competitivos
- Medidas para prevenir o minimizar la producción de semillas viables
Introducción
Prácticamente todos los agricultores de América del Norte conocen y lidian con la pigweed, un término que abarca varias especies del género Amaranthus, incluyendo:
- redroot pigweed (A. retroflexus)
- algodoncillo liso (A. hybridus)
- Amaranto Powell (A. powelii)
- Amaranto Palmer (A. palmeri)
- amaranto espinoso (A. spinosus)
- algodoncillo abatido (A. albus)
- algodoncillo postrado (A. blitoides)
- (A. tuberculatus = A. rudis)
Estas plantas anuales de verano amantes del calor emergen después de la fecha de las heladas de primavera, crecen rápidamente, compiten vigorosamente contra los cultivos de temporada cálida, se reproducen por semilla y mueren con las heladas de otoño. Las algodoncillos son las principales malas hierbas de las verduras de temporada cálida (Webster, 2006) y los cultivos en hileras (Sellers et al., 2003).
También llamadas amarantos, las pigweeds son nativas de partes de América del Norte y Central. El cultivo de cultivos y el comercio humano han abierto nuevos nichos, permitiendo que las algodoncillas invadan los ecosistemas agrícolas en América y partes de Europa, Asia, África y Australia. La mayoría de los amarantos producen vegetales verdes nutritivos o cultivos de cereales, y la siembra deliberada de alimentos ha ayudado a que algunas especies de maleza se propaguen por todo el mundo. Sin embargo, ninguna de las algodoncillas discutidas aquí se cultiva comercialmente para el grano, y las variedades modernas de amaranto de grano no se consideran malas hierbas agrícolas importantes.
Los problemas de algodoncillo han aumentado en los sistemas de producción con labranza cero con herbicidas convencionales, que dejan semillas de malas hierbas en la superficie y seleccionan poblaciones resistentes a herbicidas (Sellers et al., 2003). Sin embargo, las poblaciones altas de algodoncillo pueden ocurrir en granjas orgánicas y no orgánicas, y en sistemas convencionales, de conservación y con labranza cero.
Descripción e identificación
Las plantas porcinas son fáciles de reconocer, pero la identificación correcta de las especies de plantas porcinas puede ser complicada. Dos o más especies de algodoncillo a menudo se encuentran juntas en el mismo campo (Fig. 1), la variación significativa puede ocurrir dentro de una especie, y ocasionalmente ocurren híbridos interespecíficos (Sellers et al., 2003). Algunos investigadores consideran que la tempestad de agua alta y la tempestad de agua común son una sola especie: A. tuberculatus (Pratt y Clark, 2001). La Extensión de la Universidad Estatal de Kansas ha publicado una excelente guía de identificación de algodoncillo con ilustraciones fotográficas y una clave para distinguir plantas maduras de nueve amarantos de maleza diferentes (Horak et al., 1994).

Figura 1. Dos especies de algodoncillo, tentativamente identificadas como amaranto Palmer (izquierda) y algodoncillo liso (derecha), crecen en el borde de una cama cubierta de plástico en la producción de vegetales orgánicos en Clemson, Carolina del Sur. Crédito de la foto: Mark Schonbeck, Asociación de Agricultura Biológica de Virginia.
Las plántulas de algodoncillo recién emergidas abren un par de cotiledones largos y estrechos, de aproximadamente 0,5 pulgadas de largo por 0,1 pulgadas de ancho, seguidos de las primeras hojas verdaderas, que son de contorno más ancho (Fig. 2). Las plantas forman raíces ramificadas moderadamente profundas, y pueden mostrar una coloración rojiza distintiva en las raíces, los tallos inferiores y la parte inferior de las hojas.

Figura 2. En este flujo de plantas de semillero de malezas anuales de verano, la pigweed (Amaranthus sp.) se puede distinguir por su par de cotiledones largos y estrechos (hojas de semilla) y, en plántulas más antiguas, hojas verdaderas que son mucho más ampliamente ovaladas. Crédito de la foto: Mark Schonbeck, Asociación de Agricultura Biológica de Virginia.
La mayoría de las algodoncillas crecen hasta convertirse en plantas grandes, erectas a arbustivas, de 2 a 7 pies de altura, con hojas simples pecioladas (con tallos) dispuestas alternativamente (individualmente) en los tallos (Fig. 3a). Las hojas son generalmente de forma ovalada a romboidal, y de 2 a 6 pulgadas de largo. El algodoncillo postrado forma una estera baja que se extiende, con hojas más pequeñas (aproximadamente una pulgada) que tienen muescas distintivas en la punta (Fig. 3b).

Figura 3. a. Estas algodoncillas lisas en el rumbo inicial miden aproximadamente cuatro pies de alto. b. El algodoncillo postrado forma una estera baja y extendida. Créditos fotográficos: Mark Schonbeck, Asociación de Agricultura Biológica de Virginia.
Las flores individuales de algodoncillo son pequeñas, discretas y generalmente de color verdoso. Las flores masculinas y femeninas nacen en la misma planta (la mayoría de las especies) o plantas separadas (tempestad de agua, amaranto de Palmer). Cada planta tiene miles de flores en pequeños racimos en las axilas de las hojas, o espigas más grandes, a menudo ramificadas, densamente empaquetadas en las puntas de los tallos principales y las ramas principales (Fig. 4). Las flores femeninas forman semillas simples, pequeñas, redondas, generalmente brillantes, de color marrón rojizo oscuro a negro, de aproximadamente 0,04 pulgadas de diámetro (Fig. 5). Unas 50.000 a 90.000 semillas pesan una onza.

Figura 4. Amaranto espinoso (izquierda) y algodoncillo liso (derecha) en flor. Crédito de la foto: Mark Schonbeck, Asociación de Agricultura Biológica de Virginia.
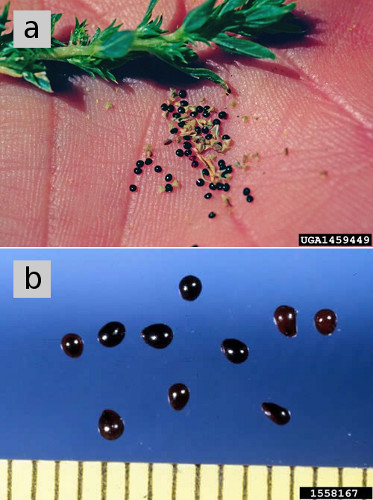
Figura 5. a) Semillas de algodoncillo. b) Semillas de algodoncillo rojo, magnificadas, con una capa oscura y brillante de semillas maduras. Créditos de la figura: (a) Steve Dewey, Universidad Estatal de Utah, Bugwood.org b) Ken Chamberlain, Universidad Estatal de Ohio, Bugwood.org.
Consulte la Tabla 1 a continuación para obtener una guía rápida de ocho especies comunes de algodoncillo de América del Norte, con enlaces a información adicional sobre cada una.
| Nombre común y científico | Hábito de crecimiento | Inflorescencia* | Rango geográfico** | Otras características de la planta |
|---|---|---|---|---|
| Algodoncillo rojo Amaranthus retroflexus | Erecto, ramificado, 2-7 pies | Picos terminales rígidos y ramificados, ramas individuales generalmente <2 en largo, más grueso que el lápiz | En toda América del Norte, incluida Alaska | Tallo superior y hojas generalmente cubiertas con hojas finas pelos; hojas grandes (6 pulg.) en plantas vigorosas |
| Algodoncillo liso Amaranthus hybridus | Erecto, ramificado, de 2-7 pies | Espigas terminales suaves y muy ramificadas, ramas individuales más delgadas que el lápiz | En toda América del Norte | Similar a la redroot pero muy variable, muchas variantes locales, pueden hibridarse con especies estrechamente relacionadas |
| Amaranto Palmer Amaranthus palmeri | Erecto, ramificado, de 2-10 pies | de largo (hasta 18 pulgadas), puntas terminales simples o escasamente ramificadas; macho suave, hembra erizada | Mitad sur de los EE., Great Plains, México | Crecimiento extremadamente rápido y agresivo en climas cálidos, flores masculinas y femeninas en plantas separadas; plantas lisas y sin pelo |
| Powell Amaranthus powellii | Erectas, ramificadas, de 2-6 pies | Espigas terminales rígidas y ramificadas, ramas de 4-8 en longitud, más gruesas que el lápiz, sostenidas cerca del eje principal | En todo el Norte América |
hojas más estrechas y más cónicas hacia la punta que redroot o lisas; La planta puede ser lisa o peluda |
| Amaranto espinoso Amaranthus spinosus | Erecto a tupido de 1-4 pies | Espigas terminales delgadas y ramificadas, en su mayoría flores masculinas; racimos axilares, en su mayoría femeninos | En toda América del Norte, pero principalmente en el sureste de EE. UU. | Par de espinas rígidas y afiladas de ½ pulgada en la base de cada hoja; tallos lisos, sin pelo, a menudo rojos |
| Waterhemp Amaranthus rudis o A. tuberculatus*** | Erecto, alto de 3-10 pies | Puntas terminales delgadas, simples o ramificadas | En todo Estados Unidos. y el sur de Canadá, excepto las áreas más secas | Flores masculinas y femeninas en plantas separadas; tallos y hojas lisos y sin pelo; hojas a menudo más largas y estrechas que otras especies |
| Algodoncillo postrado Amaranthus blitoides | Alfombra postrada a 3 pies de ancho | Racimos pequeños y densos en las axilas de las hojas | A lo largo de los EE.muesca en la punta; semillas negras opacas, más grandes que en otras algodoncillas (0.06 pulg.) | |
| Algodoncillo abatible Amaranthus albus | Arbusto globular, de 1-3 pies de diámetro | Racimos pequeños y densos en las axilas de las hojas | En toda América del Norte | Las plantas maduras se desprenden al nivel del suelo y son transportadas por el viento, dispersando semillas; tallos de color blanco a verde pálido, hojas de color verde claro |
Ciclo de vida, Reproducción, Dispersión de Semillas, Latencia de Semillas y Germinación
Las algodoncillos son plantas anuales de verano tiernas a las heladas que emergen, crecen, florecen y forman semillas maduras dentro del período libre de heladas. Las plántulas emergen durante un período prolongado, con brotes importantes a finales de primavera o principios de verano (Fig. 6). En la mayoría de las especies, la floración y el desarrollo de semillas tienen lugar principalmente después del solsticio de verano, en respuesta al acortamiento de la duración del día.
Figura 6. Una descarga de plántulas de algodoncillo lisas en una granja de verduras en la región de las Mareas de Virginia, fotografiada el 20 de junio de 2010, aproximadamente dos semanas después de la emergencia. Crédito de la foto: Mark Schonbeck, Asociación de Agricultura Biológica de Virginia.
Las algodoncillos se reproducen completamente por semilla. Una sola planta grande puede madurar de 100.000 a 600.000 semillas y poblaciones de 0.1-1 plantas por pie cuadrado pueden arrojar 10,000-45,000 semillas por pie cuadrado, o 0.4–2 mil millones por acre (Massinga et al., 2001; Sellers et al., 2003). Esta prolífica producción de semillas hace que las semillas de porcino sean especialmente difíciles de manejar, ya que la maduración exitosa de una sola planta por cada 10,000 plántulas emergentes puede permitir que las poblaciones de porcino se multipliquen varias veces de un año a otro.
Las algodoncillos generalmente comienzan a florecer y a desprender polen (antesis) aproximadamente seis semanas después de la emergencia (WAE), aunque las flores pueden aparecer tan pronto como a las 3 WAE o tan tarde como a las 9 WAE (Huang et al., 2000; Keeley, et al., 1987; Shrestha y Swanton, 2007). Las flores se abren aproximadamente 1-2 semanas después de que los capullos de las flores se hacen visibles por primera vez a simple vista.
Los intervalos de tiempo reportados desde la polinización hasta la formación de semillas viables varían de 7 a 12 días en la tempestad de agua (Bell y Tranel , 2010) a 6 semanas en poblaciones de campo de algodoncillo rojo en Ontario (Shrestha y Swanton, 2007). En California, el amaranto Palmer formó semillas viables 2-6 semanas después de la floración (Keeley et al., 1987). Las semillas se vuelven viables aproximadamente al mismo tiempo que desarrollan su color marrón oscuro o negro maduro.
El desarrollo reproductivo se acelera al acortar la duración del día después del solsticio de verano en las poblaciones de campo (Keeley et al., 1987), y avanza más rápido en fotoperiodos cortos (~12 horas) que en fotoperiodos más largos (≥14 horas) en una cámara de crecimiento (Huang et al., 2000). Aunque la mayor parte de la producción de semillas ocurre a finales de verano y principios de otoño, algunas semillas maduras se han encontrado en cabezas de semillas de algodoncillo lisas en el solsticio de verano en Virginia (observación personal).
No se ha investigado la capacidad de las plantas de algodoncillo arrancadas o cortadas en el momento de la floración para completar la maduración de las semillas. Sin embargo, en el norte del estado de Nueva York, se encontró que fragmentos de 2-4 pulgadas de inflorescencias de amaranto Powell que yacían en la superficie del suelo contenían semillas negras 3 semanas después de que las malas hierbas se limpiaran en el momento de la floración (Charles Mohler, Cornell University, pers. commun.). Aparentemente, si la polinización se lleva a cabo antes de que se extraigan o troceen las semillas, existe cierto potencial para la producción de semillas viables.
Las semillas de algodoncillo se dispersan a nuevos lugares mediante riego o agua de inundación, estiércol y tierra adherida al calzado, neumáticos de tractor o herramientas de labranza. Además, la hierba de cerdo dispersa activamente las semillas cuando las plantas maduras se desprenden y se mueven con el viento.
Las semillas de algodoncillo tienen múltiples mecanismos de latencia, de modo que las semillas producidas en una temporada dada germinan en diferentes momentos durante los próximos años, mejorando así la persistencia a largo plazo de la hierba (Egley, 1986). Las semillas de algodoncillo recién desprendidas son en su mayoría latentes, y se vuelven menos en la primavera siguiente. La germinación es promovida por temperaturas altas (95 °F), temperaturas fluctuantes diurnas (por ejemplo, 85-95 °F día, ~ 70 ° F noche) y, a veces, luz (Guo y Al-Khatib, 2003; Schonbeck y Egley, 1980 y 1981 Steckel et al., 2004).
El algodoncillo emerge más fácilmente de la parte superior de 0,5 a 1,0 pulgadas del perfil del suelo, con pocas semillas ubicadas a una profundidad de más de una pulgada (Mohler y Di Tommaso, sin publicar). Las semillas requieren una humedad adecuada y un buen contacto entre la semilla y el suelo para absorber la humedad y germinar. Las semillas enterradas más profundamente permanecen latentes y viables durante varios años, y germinan cuando salen a la superficie mediante labranza o cultivo. Aunque los brotes de emergencia comúnmente siguen a la preparación del lecho de siembra o al cultivo, el aumento de los problemas de la algodoncillo en los cultivos agronómicos se ha atribuido a la adopción generalizada de la labranza cero y la labranza mínima, que dejan semillas de malas hierbas recién desprendidas en o cerca de la superficie del suelo (Sellers et al., 2003).
Hábito de crecimiento e Impacto en los cultivos
Las algodoncillos tienen la vía fotosintética C4, que les confiere la capacidad de crecer rápidamente a altas temperaturas y altos niveles de luz, tolerar la sequía y competir agresivamente con los vegetales de temporada cálida por luz, humedad y nutrientes. El crecimiento está relacionado con días de Grado de Crecimiento acumulativo, con una temperatura base de 50 ° F (Shrestha y Swanton, 2007; Horak y Loughin, 2000); por lo tanto, las algodoncillas crecen mucho más rápido en climas cálidos que en las regiones del norte con veranos más fríos.
Las especies de algodoncillo erecto pueden sobrepasar rápidamente cultivos cortos como brócoli o frijol cocido. En cultivos más altos como el maíz, las algodoncillas responden a la sombra del dosel al aumentar el crecimiento del tallo y desplegar hojas más altas en la planta, interceptando así una fracción más grande de luz disponible (Massinga et al., 2003; McLachlan et al, 1993). De una a tres plantas de algodoncillo por cada 10 pies de hilera que emergen con maíz o soja pueden causar pérdidas significativas de rendimiento (Klingman y Oliver, 1994; Knezevic et al., 1994; Massinga et al., 2001) Las algodoncillos que emergen varias semanas después de que el cultivo haya surgido ejercen mucho menos efecto en los rendimientos.
Las algodoncillos son altamente sensibles a los nutrientes, especialmente la forma de nitrato de nitrógeno (N) (Blackshaw y Brandt, 2008; Teyker et al., 1991). La fertilización mejora tanto la biomasa de malas hierbas como la producción de semillas. Además, el nitrato puede estimular la germinación de semillas de algodoncillo (Egley, 1986). Se ha observado que, en algunos años, un mantillo de residuos de cultivos de cobertura de leguminosas aumenta la aparición de algodoncillo (Fig. 7), probablemente como resultado de la rápida mineralización de la legumbre N (Teasdale y Mohler, 2000).

Figura 7. En este ensayo de campo, una descarga de algodoncillo compite contra el brócoli plantado con labranza cero para convertirlo en veza peluda muerta (primer plano), mientras que el brócoli plantado en centeno muerto o veza de centeno está relativamente libre de veza peluda (fondo). La rápida mineralización de N de los residuos de cultivos de cobertura de leguminosas aparentemente estimuló la germinación y el crecimiento de la porcino. Crédito de la foto: Mark Schonbeck, Asociación de Agricultura Biológica de Virginia.
Debido a que las semillas pequeñas tienen reservas mínimas de nutrientes, las plántulas de algodoncillo son inicialmente más dependientes de los nutrientes fácilmente disponibles del suelo, especialmente el fósforo (P) y el potasio (K), que las plantas con semillas más grandes, como el maíz, los frijoles y las cucurbitáceas (Hoveland et al., 1976; Mohler, 1996). Sin embargo, en estudios realizados en suelos orgánicos (estiércol) en Florida, la algodoncilla lisa y el amaranto espinoso fueron menos sensibles que la lechuga a los niveles de P, y una aplicación de banda de fertilizante P mejoró la capacidad del cultivo para competir contra estas malas hierbas (Santos et al., 1997; Shrefler et al., 1994).
Las algodoncillos son intolerantes a la sombra, y el crecimiento y la reproducción de los individuos que emergen bajo un dosel de cultivo pesado se reducen sustancialmente. Sin embargo, el alargamiento rápido del tallo permite que las algodoncillos escapen del sombreado en muchas situaciones de cultivo. Las algodoncillos de temporada tardía que rompen a través de cucurbitáceas, tomates, pimientos y otros vegetales establecidos pueden promover enfermedades en los cultivos al reducir la circulación de aire, interferir con la cosecha y establecer muchos miles de semillas (Fig. 8).

Figura 8. El algodoncillo surgió varias semanas después de la siembra de calabazas y no afectó el rendimiento. Al final de la cosecha, sin embargo, cada maleza maduró miles de semillas, y hará un depósito pesado en el banco de semillas de malezas a menos que se eliminen rápidamente. Crédito de la foto: Mark Schonbeck, Asociación de Agricultura Biológica de Virginia.
Se informa de que las algodoncillas albergan nematodos de plagas (Meloidogyne spp.) y muchos patógenos de cultivos vegetales, incluidos los hongos que causan el tizón temprano en la papa y el tomate (Alternaria solani), la gota de lechuga (Sclerotinia sclerotiorum) y el tizón meridional (Sclerotium rolfsii) en una amplia gama de cultivos. Los patógenos virales, como el virus del mosaico del pepino y el virus de la marchitez manchada del tomate, también pueden transmitirse de las algodoncillas (Mohler y DiTommaso, no publicados).
Las algodoncillas se han convertido en el centro de los esfuerzos de biocontrol con patógenos fúngicos e insectos que se alimentan de plantas, aunque todavía no se han puesto a disposición de los agricultores productos de biocontrol. El escarabajo pulga del amaranto (Disonycha glabrata) se encuentra en gran parte de los Estados Unidos (Tisler, 1990), se alimenta de follaje de algodoncillo (Fig. 9), y puede convertirse en un enemigo natural significativo de pigweed en algunas áreas, incluido el condado de Floyd, Virginia (observación personal). Sin embargo, por lo general no controla las malas hierbas, y ocasionalmente se alimenta de algunas plántulas de vegetales.

Figura 9. El escarabajo pulga de amaranto se alimenta de follaje de algodoncillo, y se ha observado que causa una defoliación sustancial y reduce el vigor de las malas hierbas en algunas partes de Virginia. Este insecto ocasionalmente puede convertirse en una plaga en remolacha y acelgas al alimentarse de plántulas. Crédito de la foto: Mark Schonbeck, Asociación de Agricultura Biológica de Virginia.
Gestión
Los agricultores orgánicos gestionan las plantas porcinas aprovechando sus puntos de vulnerabilidad. Las semillas pequeñas tienen reservas mínimas de nutrientes; por lo tanto, las plántulas solo pueden emerger de semillas ubicadas dentro de una pulgada de la superficie del suelo, y dependen inmediatamente del suelo para obtener nutrientes fácilmente disponibles. Los cultivos trasplantados y de semillas grandes tienen reservas sustanciales de nutrientes y pueden obtener una ventaja competitiva sobre las plántulas de algodoncillo si se utilizan fuentes de nutrientes de liberación lenta.
Las delicadas plántulas se matan fácilmente cortándolas, arrancándolas, enterrándolas o con calor. El deshierbe a fuego oportuno o el cultivo con cualquiera de una variedad de implementos puede eliminar un flujo de plántulas de algodoncillo. El algodoncillo emergente también es susceptible al sombreado y a los obstáculos físicos por el mantillo. Un estudio de campo en Beltsville, Maryland, documenta la mayor sensibilidad de la algodoncillo a la supresión con mantillo orgánico en relación con varias otras malas hierbas comunes: redroot pigweed > lamb’s quarter > cola de zorro gigante > hoja de terciopelo (Teasdale y Mohler, 2000).
La acción oportuna es vital, ya que las puercas se vuelven rápidamente más difíciles de matar una vez que crecen más de una pulgada y desarrollan cuatro o más hojas verdaderas (Fig. 10). En climas fríos, las plántulas de algodoncillo pueden permanecer vulnerables al cultivo hasta por 4 UAE (Weaver y McWilliams, 1980); sin embargo, en climas más cálidos, pueden crecer hasta 2-4 pulgadas dentro de 2 UAE (Sellers et al., 2003).

Figura 10. La plántula de algodoncillo a la derecha se encuentra en la etapa vulnerable, en la que se puede matar fácilmente mediante un cultivo poco profundo o en llamas, o bloquearse con mantillo. Cuando el puerco crece tan grande como la plántula de la izquierda, se vuelve más difícil de matar, lo que requiere un cultivo más vigoroso. Crédito de la foto: Mark Schonbeck, Asociación de Agricultura Biológica de Virginia.
Las poblaciones de Pigweed se adaptan fácilmente a los sistemas de producción y a las tácticas de control. Por ejemplo, las respuestas de germinación de semillas muestran cambios adaptativos a diferentes rotaciones de cultivos (Brainard et al., 2007), y se ha reportado resistencia generalizada a herbicidas en varias especies (Fugate, 2009; Volenberg et al., 2007). Por lo tanto, la dependencia de una única herramienta de gestión o de la misma estrategia año tras año probablemente producirá rendimientos decrecientes con el tiempo.
Cuando se usan en combinación, las prácticas que se describen a continuación pueden proporcionar un manejo efectivo de la porcino en sistemas orgánicos.
Cultivo y Deshierbe a llama
Monitoree los cultivos regularmente para detectar la aparición de malas hierbas. Cultive cuando las algodoncillas estén en la etapa de cotiledón, o antes de que alcancen una pulgada de altura, trabajando lo más cerca posible de la hilera de cultivos. Cuando el cultivo esté suficientemente establecido, coloque cultivadores para mover una pulgada de tierra en hileras para enterrar las malas hierbas pequeñas. La capa superficial de tierra suelta y seca dejada por el cultivo (mantillo de polvo) disuade la germinación adicional de la porcino. Evite volver a compactar el suelo, ya que la compactación puede promover otro flujo de emergencia (Fig. 11).

Figura 11 El cultivo dejó un mantillo de polvo alrededor de estas plantas jóvenes de calabaza, desalentando así la germinación de la hierba de cerdo y otras malas hierbas de semillas pequeñas. Sin embargo, el tránsito peatonal recompactó el suelo lo suficiente como para restablecer el contacto entre las semillas y el suelo cerca de la superficie, lo que permitió que las semillas de malas hierbas absorbieran humedad, germinaran y crecieran en las huellas. Crédito de la foto: Mark Schonbeck, Asociación de Agricultura Biológica de Virginia.
El deshierbe a llama puede eliminar el algodoncillo y otras plántulas de hoja ancha justo antes de la aparición del cultivo. A menudo se usa para cultivos de inicio lento como zanahoria, remolacha y chirivía. Debido a que el fuego por lo general no mata las plántulas de hierba mala, no se recomienda donde las hierbas constituyen una porción significativa de la flora de malas hierbas.
Siega y pastorea
Una vez que el cultivo es demasiado grande para cultivarlo con un tractor, los agricultores a menudo cortan, cortan o tiran las malas hierbas en callejones para mantener la circulación de aire alrededor del cultivo, facilitar la cosecha y evitar la propagación de malas hierbas. Esto debe hacerse antes de que se abran las flores de algodoncillo (unos días después de que las cabezas de las flores se hagan visibles por primera vez) para evitar la formación de semillas viables.
Algunos agricultores cortan callejones entre hileras anchas o camas acolchadas de plástico con una cortadora de césped a presión o una recortadora de líneas como una alternativa al cultivo que ahorra tierra. Dos siegados oportunos antes del cierre del dosel han dado un control adecuado entre hileras de cola de zorro gigante, algodoncillos y ambrosía en soja plantada en un espacio de hileras de 30 pulgadas (Donald, 2000).
La mayoría de las porcinos son muy apetecibles para el ganado. Sin embargo, las semillas maduras pasan a través de las vías digestivas de los animales ilesas, y el estiércol es una fuente notoria de semillas de algodoncillo. Por lo tanto, el algodoncillo debe pastarse mientras aún esté vegetativo. Tenga en cuenta también que el Programa Orgánico Nacional requiere un intervalo de 120 días entre los depósitos de estiércol de los animales de pastoreo y la próxima cosecha de cultivos alimentarios.
Mulching
El mulching puede ser una táctica de control eficaz para las semillas de porcino en la producción de vegetales. Un mantillo orgánico, como 3-4 pulgadas de paja o heno (~5-10 toneladas/ca), aplicado dentro de un día después de cultivar un cultivo establecido, puede reducir la aparición posterior de algodoncillo en un 90%. Alternativamente, se puede colocar un mantillo sintético, como el plástico negro, antes de plantar el cultivo, y las malas hierbas de los callejones controladas por el cultivo, la siega, el mantillo orgánico o el cultivo de cobertura. Nota: Si se utiliza plástico u otro mantillo sintético para cultivos orgánicos, debe retirarse del campo al final de la cosecha o la temporada de crecimiento.
El trasplante orgánico con labranza cero de tomate y otras verduras de verano en cultivos de cobertura de invierno prensados en rollos o cortados puede controlar poblaciones de algodoncillo ligeras a moderadas. Los residuos de centeno liberan inhibidores naturales del crecimiento de las plantas (aleloquímicos) que suprimen el algodoncillo y algunas otras malezas anuales (Barnes y Putnam, 1983; Putnam et al., 1983) sin afectar a los vegetales trasplantados.
Gestión de nutrientes y humedad
Utilice fuentes de liberación lenta de N y otros nutrientes de los cultivos, y evite la aplicación por difusión de materiales de liberación más rápida, como harina de sangre y harina de huesos, que pueden dar el salto al cultivo. Para alimentadores pesados como el brócoli o la espinaca que necesitan un poco de N rápido, banda o materiales de preparación lateral dentro o cerca de la hilera de cultivos al inicio del crecimiento rápido de los cultivos.
Utilice riego por goteo en hilera para proporcionar agua y fertilizante orgánico líquido directamente al cultivo sin alimentar ni regar las malas hierbas entre hileras. Las líneas de goteo subsuperficiales pueden proporcionar humedad al cultivo y dejar la superficie del suelo seca, minimizando así la aparición de malas hierbas dentro de la hilera.
Rotación de cultivos, Cronogramas de Siembra y Semillero Rancio
Planificar la rotación de cultivos y programar las operaciones de campo para interrumpir los ciclos de vida de la puerca. Evite proporcionar un nicho abierto (suelo desnudo) año tras año para la aparición de algodoncillo a finales de primavera y principios de verano. Alterne las verduras de temporada cálida y fresca. Considere la posibilidad de retrasar la preparación del semillero para una verdura de verano hasta después del momento de mayor aparición de la algodoncilla. Después de varios años de producción intensiva de vegetales, gire el campo a césped perenne (por ejemplo, trébol rojo de pasto de huerta) durante dos o tres años para interrumpir los ciclos de vida del algodoncillo y fomentar la depredación de semillas de malas hierbas.
Si las poblaciones de pigweed son altas (Fig. 12), prepare un semillero rancio a finales de primavera para extraer el banco de semillas de malas hierbas. Labrar o cultivar, luego enrollar o envasar el suelo para mejorar el contacto entre las semillas y el suelo, promoviendo así la germinación de las malas hierbas. Espolvorear regar si el suelo está seco. Repita el cultivo según sea necesario. Justo antes de plantar un cultivo o de que surja un cultivo, use un cultivo poco profundo y deje la superficie suelta para desalentar la germinación adicional de malas hierbas. La descarga final también puede ser eliminada por la llama si las malas hierbas de la hierba son pocas o están ausentes.

Figura 12. Una alfombra de plántulas espinosas de amaranto surge de un gran banco de semillas de malezas. Se necesita un semillero rancio o un barbecho cultivado para controlar esta situación. Crédito de la foto: Mark Schonbeck, Asociación de Agricultura Biológica de Virginia.
Competencia de cultivos y Cultivos de cobertura
Con un buen control de malas hierbas a principios de temporada, los cultivos vigorosos como el tomate, la batata y la calabaza de invierno pueden tolerar la algodoncilla emergente más tarde. Sin embargo, es posible que la competencia en los cultivos no controle las algodoncillos, debido a su respuesta para evitar la sombra y su capacidad de atravesar el dosel de los cultivos a través de un rápido alargamiento del tallo.
Los cultivos de cobertura de verano competitivos, como el trigo sarraceno, la hierba sorgo–sudanesa, el caupí y la soja forrajera, a menudo se utilizan para suprimir las malas hierbas entre los cultivos de hortalizas de primavera y otoño. En Florida, los cultivos de cobertura de caupí, clima soleado o pana, sembrados a altas tasas, redujeron pero no eliminaron el crecimiento suave del algodoncillo (Collins et al., 2008).
Cuando use cultivos de cobertura de verano para combatir las algodoncillos, siembra a altas tasas (1.5-2 veces lo normal) y usa buenos métodos de siembra para obtener un soporte de cultivos de cobertura que suprima las malas hierbas. Combine el caupí, la soja forrajera u otra legumbre de verano con una hierba alta como el mijo perla o la hierba sudanesa de sorgo para desarrollar un dosel alto y denso. Observa la cosecha de cerca; si una cantidad significativa de algodoncillo crece con él, termine el cultivo de inmediato cuando aparezcan por primera vez las cabezas de flores de malezas.
Gestión del Banco de Semillas de algodoncillo
Debido a que las semillas de algodoncillo producen semillas de manera tan prolífica, es fundamental minimizar la lluvia anual de semillas en el suelo. Aunque un estricto control de malas hierbas durante seis años puede reducir el banco de semillas de algodoncillo en un 99%, un control de malas hierbas relajante permite que el número de semillas se recupere a niveles cercanos al original en tres años (Schweizer y Zimdahl, 1984). Es posible que el algodoncillo que emerge después del período mínimo de ausencia de malezas de un cultivo no reduzca el rendimiento del cultivo, pero debe arrancarse o cortarse antes de la floración para evitar la formación de semillas maduras.
Puede valer la pena caminar por campos de cultivos maduros para extraer o cortar malas hierbas grandes; las pequeñas y raquíticas plantas porcinas debajo de un dosel de cultivo forman solo un pequeño número de semillas. Si las cabezas de flores ya están formadas, retire las plantas de algodoncillo cortadas o arrancadas del campo. Si las plantas de algodoncillo ya han formado semillas, tenga en cuenta que muchas de las semillas permanecerán en la cabeza hasta el invierno. Por lo tanto, eliminar las malas hierbas a principios de otoño puede reducir significativamente la lluvia de semillas de algodoncillo.
En el caso de que se produzca una fuerte lluvia de semillas de algodoncillo, algunos científicos de malezas recomiendan la labranza de inversión para mover las semillas a una profundidad de la que no pueden emerger (Mohler y Di Tommaso, inédito). Aunque el 5-14% de las semillas de algodoncillo rojo y de tempestad de agua han sobrevivido a 9-12 años de enterramiento a 8 pulgadas de profundidad en Nebraska (Burnside et al., 1996), otros han reportado que las semillas de algodoncillo tienen una vida bastante corta (3-4 años) en el suelo en regiones más húmedas como Mississippi e Illinois (Buhler y Hartzler, 2001; Egley y Williams, 1990; Steckel et al., 2007). Se ha informado que el arado de la vertedera aumenta la aparición de algodoncillo si las poblaciones de malas hierbas son bajas, pero disminuye la aparición si las poblaciones son altas como resultado de una lluvia de semillas reciente (Schweizer y Zimdahl, 1984).
Cuando use labranza de inversión para manejar un depósito de semillas pesado, are el campo una vez, luego evite la labranza profunda durante los próximos años para permitir que las semillas enterradas pierdan la viabilidad.
Este artículo es parte de una serie que analiza la familia invasora de las algodoncillos. Para obtener más información, consulte los siguientes artículos:
- Perfil de malezas: Algodoncillos (Amaranthus spp.)
- Aragonés Verdolaga (Amaranto anotodus)
- Powell Kiwicha (Amaranto powellii)
- Espinosas Kiwicha (Amaranto spinosus)
- Palmer Kiwicha (Amaranto palmeri)
- Suavizar la Verdolaga (Amaranto hybridus)
- Tumble la Verdolaga (Amaranto albus)
- Postrado verdolaga (Amaranto blitoides)
- Común Waterhemp (Amaranto rudis) y de Altura Waterhemp (A. tuberculado)
Referencias
- Barnes, J. P., y A. R. Putnam. 1983. Los residuos de centeno contribuyen a la supresión de malas hierbas en los sistemas de cultivo con labranza cero. Journal of Chemical Ecology 9: 1045-1057. (Disponible en línea en: http://dx.doi.org/10.1007) (verificado el 10 de septiembre de 2012).
- Bell, M. S., and P. J. Tranel. Requisito de tiempo desde la polinización hasta la madurez de la semilla en la tempestad de agua (Amaranthus tuberculatus). Weed Science 58: 167-173. (Disponible en línea en: http://dx.doi.org/10.1614/WS-D-09-00049.1) (verificado el 10 de septiembre de 2012).
- Blackshaw, R. E., and R. N. Brandt. 2008. Los efectos de la tasa de fertilizantes nitrogenados en la competitividad de las malas hierbas dependen de las especies. Weed Science 56: 743-747. (Disponible en línea en: http://dx.doi.org/10.1614/WS-08-065.1) (verificado el 10 de septiembre de 2012).
- Brainard, D. C., A. DiTommaso, and C. A. Mohler. 2007. Variación intraespecífica en las características de las semillas del amaranto Powell (Amaranthus powellii) de hábitats con historias de rotación de cultivos contrastantes. Weed Science 55: 218-226. (Disponible en línea en: http://dx.doi.org/10.1614/WS-06-134.1) (verificado el 10 de septiembre de 2012).
- Buhler, D. D. and R. G. Hartzler. 2001. Aparición y persistencia de semillas de hoja aterciopelada, tempestad de agua común, hierba de copa lanosa y cola de zorro gigante. Weed Science 49: 230-235. (Disponible en línea en: http://dx.doi.org/10.1614/0043-1745(2001)049%5B0230:EAPOSO%5D2.0.CO; 2) (verificado el 10 de septiembre de 2012).
- Burnside, O. C., R. G. Wilson, S. Weisberg, y K. G. Hubbard. 1996. Longevidad de semillas de 41 especies de malas hierbas enterradas 17 años en el este y oeste de Nebraska. Weed Science 44: 74-86. (Disponible en línea en: http://www.jstor.org/stable/4045786) (verificado el 10 de septiembre de 2012).
- Collins, A. S., C. A. Chase, W. M. Stall, and C. M. Hutchinson. 2008. Densidades óptimas de tres cultivos de cobertura de leguminosas para la supresión de la algodoncilla lisa (Amaranthus hybridus). Weed Science 56: 753-761. (Disponible en línea en: http://dx.doi.org/10.1614/WS-07-101.1) (verificado el 10 de septiembre de 2012).Donald, W. W. 2000. Siega entre hileras + herbicida en hilera aplicado en banda para el control de malezas en Glicina máx. Weed Science 48: 487-500. (Disponible en línea en: http://www.jstor.org/stable/4046280) (verificado el 10 de septiembre de 2012).
- Egley, G. H. 1986. Estimulación de la germinación de semillas de malas hierbas en el suelo. Reviews of Weed Science 2: 67-89.
- Egley, G. H., and R. D. Williams. 1990. Disminución de las semillas de malas hierbas y la aparición de plántulas durante cinco años, afectadas por las alteraciones del suelo. Weed Science 38: 504-510. (Disponible en línea en: http://www.jstor.org/stable/4045064) (verificado el 10 de septiembre de 2012).
- Fugate, L. 2009. Porcino que hace que los agricultores reconsideren los métodos de cultivo. Noticias del Servicio de Extensión Cooperativa de la División de Agricultura de Arkansas de la Universidad-octubre de 2009.
- Guo, P., y K. Al-Khatib. 2003. Efectos de la temperatura en la germinación y el crecimiento de la algodoncilla roja (Amaranthus retroflexus), el amaranto de Palmer (A. palmeri) y la tempestad de agua común (A. rudis). Weed Science 51: 869-875. (Disponible en línea en: http://dx.doi.org/10.1614/P2002-127) (verificado el 10 de septiembre de 2012).
- Horak, M. J., and T. M. Loughin. 2000. Análisis de crecimiento de cuatro especies de Amaranto. Weed Science 48: 347-355. (Disponible en línea en: http://dx.doi.org/10.1614/0043-1745(2000)048%5B0347:GAOFAS%5D2.0.CO; 2) (verificado el 10 de septiembre de 2012).
- Horak, M. J., D. E. Peterson, D. J. Chessman, and L. M. Wax. 1994. Pigweed identification: a Pictoral guide to the common pigweeds of the Great Plains (en inglés). 12 págs. (Disponible en línea en: http://www.ksre.ksu.edu/bookstore/pubs/S80.pdf) (verificado el 6 de agosto de 2013).
- Hoveland, C. S., G. A. Buchanan, and M. C. Harris. 1976. Respuesta de las malas hierbas al fósforo y potasio del suelo. Weed Science 24: 194-201. (Disponible en línea en: http://www.jstor.org/stable/4042586) (verificado el 10 de septiembre de 2012).
- Huang, J. Z., A. Shrestha, M. Tollenar, W. Deen, H. Rahimian, and C. J. Swanton. 2000. Efecto del fotoperíodo en el desarrollo fenológico de la algodoncilla roja (Amaranthus retroflexus L.). Canadian Journal of Plant Science 80: 929-938.Keeley, P. E., C. H. Carter, and R. J. Thullen. 1987. Influencia de la fecha de siembra en el crecimiento del amaranto de Palmer (Amaranthus palmeri). Weed Science 35: 199-204. (Disponible en línea en: http://www.jstor.org/stable/4044391) (verificado el 10 de septiembre de 2012).
- Klingman, T. E., y L. R. Oliver. 1994. Interferencia de amaranto de Palmer (Amaranthus palmeri) en la soja (Glycine max). Weed Science 42: 523-527. (Disponible en línea en: http://www.jstor.org/stable/4045448) (verificado el 10 de septiembre de 2012).
- Knezevic, S. Z., S. F. Weise, and C. J. Swanton. 1994. Interferencia de la algodoncilla roja (Amaranthus retroflexus) en el maíz (Zea mays). Weed Science 42: 568-573. (Disponible en línea en: http://www.jstor.org/stable/4045456) (verificado el 10 de septiembre de 2012).
- Massinga, R. A., R. S. Currie, M. J. Horak, and J. Boyer, Jr. 2001. Interferencia del amaranto de Palmer en el maíz. Weed Science 49: 202-208. (Disponible en línea en: http://dx.doi.org/10.1614/0043-1745(2001)049%5B0202:IOPAIC%5D2.0.CO; 2) (verificado el 10 de septiembre de 2012).
- Massinga, R. A., R. S. Currie, y T. P. Trooien. 2003. Uso de agua e interceptación de luz bajo amaranto de Palmer (Amaranthus palmeri) y competencia de maíz. Weed Science 51: 523-531. (Disponible en línea en: http://dx.doi.org/10.1614/0043-1745(2003)051%5B0523:WUALIU%5D2.0.CO; 2) (verificado el 10 de septiembre de 2012).McLachlan, S. M., M. Tollenaar, C. J. Swanton, and S. F. Weise. 1993. Efecto del sombreado inducido por el maíz en la acumulación de materia seca, la distribución y la arquitectura de la algodoncilla roja (Amaranthus retroflexus). Weed Science 41: 568-573. (Disponible en línea en: http://www.jstor.org/stable/4045424) (verificado el 10 de septiembre de 2012).Mohler, C. A. 1996. Bases ecológicas para el control cultural de malezas anuales. Journal of Production Agriculture 9: 468-474..
- Mohler, C. A., and A. DiTommaso. Sin publicar. Manage Weeds on Your Farm: a Guide to Ecological Strategies (en inglés). Departamento de Ciencias de Cultivos y Suelos, Universidad de Cornell. Borrador previo a la publicación, versión 5.1. Publicación prevista para 2012.
- Pratt, D. B., and L. G. Clark. 2001. Amaranthus rudis y A. tuberculatus – ¿una especie o dos? Journal of the Torrey Botanical Society 128: 282-296. (Disponible en línea en: http://www.jstor.org/stable/3088718) (verificado el 10 de septiembre de 2012).
- Putnam, A. R., J. DeFrank y J. P. Barnes. 1983. Explotación de la alelopatía para el control de malas hierbas en sistemas de cultivo anuales y perennes. Journal of Chemical Ecology 9: 1001-1010. (Disponible en línea en: http://dx.doi.org/10.1007) (verificado el 10 de septiembre de 2012).
- Santos, B. M., J. A. Dusky, D. G. shilling, W. M. Stall, and T. A. Bewick. 1997. Efecto de la fertilidad del fósforo en las interacciones competitivas de la algodoncilla lisa (Amaranthus hubridus), el amaranto espinoso (Amaranthus spinosus) y la verdolaga común (Portulaca oleracea) con la lechuga. Weed Science Society of America Abstracts 37: 54.
- Schonbeck, M. W., and G. H. Egley. 1980 Respuestas de germinación de semillas de algodoncillo rojo (Amaranthus retroflexus) a la maduración posterior, la temperatura, el etileno y algunos otros factores ambientales. Weed Science 28: 543-548. (Disponible en línea en: http://www.jstor.org/stable/4043277) (verificado el 10 de septiembre de 2012).
- Schonbeck, M. W., and G. H. Egley. 1981. Cambios en la sensibilidad de las semillas de Amaranthus retroflexus L. al etileno durante la preincubación. II. Efectos de la alternancia de temperatura y enterramiento en el suelo. Plant, Cell, and Environment 4: 237-242. (Disponible en línea en: http://dx.doi.org/10.1111/1365-3040.ep11611005) (verificado el 10 de septiembre de 2012).
- Schweizer, E. E., and R. L. Zimdahl. 1984. Disminución de las semillas de malas hierbas en el suelo irrigado después de seis años de maíz continuo (Zea mays) y herbicidas. Weed Science 32: 76-83. (Disponible en línea en: http://www.jstor.org/stable/4043886) (verificado el 10 de septiembre de 2012).
- Sellers, B. A., R. J. Smeda, W. G. Johnson, J. A. Kendig, and M. R. Ellersieck. 2003. Comparative growth of six Amaranthus species in Missouri. Weed Science 51: 329-333. (Disponible en línea en: http://dx.doi.org/10.1614/0043-1745(2003)051%5B0329:CGOSAS%5D2.0.CO; 2) (verificado el 10 de septiembre de 2012).
- Shrefler, J. W., J. A. Dusky, D. G. Shilling, B. J. Brecke, and C. A. Sanchez. 1994. Efecto de la fertilidad del fósforo en la competencia entre lechuga (Lactuca sativa) y amaranto espinoso (Amaranthus spinosus). Weed Science 42: 556-560. (Disponible en línea en: http://www.jstor.org/stable/4045454) (verificado el 10 de septiembre de 2012).
- Shrestha, A., and C. J. Swanton. 2007. Parametrización del desarrollo fenológico de malas hierbas anuales seleccionadas en condiciones de campo no cultivado. Weed Science 55: 446-454. (Disponible en línea en: http://dx.doi.org/10.1614/WS-06-176.1) (verificado el 10 de septiembre de 2012).
- Steckel, L. E., C. L. Sprague, E. W. Stoller, and L. M. Wax. 2004. Efectos de la temperatura en la germinación de nueve especies de Amaranto. Weed Science 52: 217-221. (Disponible en línea en: http://dx.doi.org/10.1614/WS-03-012R) (verificado el 10 de septiembre de 2012).
- Steckel, L. E., C. L. Sprague, E. W. Stoller, L. M. Wax, and F. W. Simmons. 2007. Efectos de labranza, sistema de cultivo y profundidad del suelo sobre la persistencia del banco de semillas de la tempestad de agua común (Amaranthus rudis). Weed Science 55: 235-239. (Disponible en línea en: http://dx.doi.org/10.1614/WS-06-198) (verificado el 10 de septiembre de 2012).
- Teasdale, J. R., and C. L. Mohler. 2000. La relación cuantitativa entre la aparición de malas hierbas y las propiedades físicas de los mantillo. Weed Science 48: 385-392. (Disponible en línea en: http://dx.doi.org/10.1614/0043-1745(2000)048%5B0385:TQRBWE%5D2.0.CO; 2) (verificado el 10 de septiembre de 2012).
- Teyker, R. H., H. D. Hoelzer, and R. A. Liebl. 1991. Respuesta del maíz y la algodoncillo al suministro y la forma de nitrógeno. Plant and Soil 135: 287-292. (Disponible en línea en: http://dx.doi.org/10.1007) (verificado el 10 de septiembre de 2012).
- Tisler, A. M. 1990. Alimentándose del escarabajo pulga de algodoncillo, Disonycha glabrata Fab. (Coleoptera: Chrysomelidae), en Amaranthus retroflexus. Virginia Journal of Science 41: 243-245.
- Volenberg, D. S., W. L. Patzoldt, A. G. Hager, and P. J. Tranel. 2007. Responses of contemporary and historical waterhemp (Amaranthus tuberculatus) accessions to glyphosate. Weed Science 55: 327-333. (Disponible en línea en: http://dx.doi.org/10.1614/WS-06-121) (verificado el 10 de septiembre de 2012).
- Weaver, S. E., y E. L. McWilliams. 1980. The biology of Canadian weeds (en inglés). 44. Amaranthus retroflexus L, A. powellii S. Wats y A. hybridus L. Canadian Journal of Plant Science 60: 1215-1234.
- Webster, T. M. 2006. Estudio de malezas-estados del sur. Subsección de cultivos de hortalizas, frutas y frutos secos. Proceedings of the Southern Weed Science Society 59: 260-277. (Disponible en línea en: http://www.swss.ws/wp-content/uploads/docs/Southern%20Weed%20Survey%202006%20Vegetables%20and%20Fruits.pdf) (verificado el 10 de septiembre de 2012).