eOrganic author:
Dr Mark Schonbeck, Virginia Association for Biological Farming
- Résumé
- Introduction
- La description et l’identification
- Cycle de vie, Reproduction, Dispersion des graines, Dormance des graines et germination
- Habitude de croissance et impact sur les cultures
- Gestion
- Culture et désherbage à la flamme
- Fauchage et pâturage
- Paillage
- Gestion des nutriments et de l’humidité
- Rotation des cultures, Horaires de plantation et Lit de semence rassis
- Compétition des cultures et culture de couverture
- Gestion de la banque de graines d’amarante
- Cet article fait partie d’une série traitant de la famille envahissante des amarantes. Pour plus d’informations, consultez les articles suivants :
- Références citées
Résumé
L’amarante est le nom commun de plusieurs plantes annuelles d’été étroitement apparentées qui sont devenues des mauvaises herbes majeures des cultures de légumes et de rangées aux États-Unis et dans une grande partie du monde. La plupart des amarantes sont des plantes hautes, dressées à buissonnantes, aux feuilles alternes simples, ovales à losangées, et aux inflorescences denses (grappes de fleurs) composées de nombreuses petites fleurs verdâtres. Ils émergent, grandissent, fleurissent, sèment et meurent pendant la saison de croissance sans gel.
Les amarres prospèrent par temps chaud, tolèrent la sécheresse, réagissent à des niveaux élevés de nutriments disponibles et sont adaptées pour éviter l’ombrage grâce à l’allongement rapide de la tige. Ils rivalisent agressivement avec les cultures de la saison chaude et se reproduisent par une production de semences prolifique.
Dans les systèmes de production biologique, l’herbe de porc peut être gérée par une combinaison de:
- Culture en temps opportun, désherbage à la flamme et enlèvement manuel
- Lit de semences périmé
- Paillage
- Rotations des cultures qui varient selon le moment du travail du sol et d’autres opérations
- Cultures de couverture et cultures commerciales compétitives
- Mesures visant à prévenir ou à minimiser la production de semences viables
Introduction
Pratiquement tous les agriculteurs d’Amérique du Nord connaissent et luttent contre l’amarante, un terme qui couvre plusieurs espèces du genre Amaranthus, y compris :
- l’amarante à racines (A. l’amarante de Palmer (A. palmeri)
- amarante épineuse (A. spinosus)
- l’amarante de dégringolade (A. albus)
- l’amarante prostrée (A. blitoides)
- l’amarante prostrée (A. blitoides)
- la crevette d’eau (A. tuberculatus = A. rudis)
Ces annuelles estivales qui aiment la chaleur émergent après la date de gel printanier, croissent rapidement, rivalisent vigoureusement avec les cultures de la saison chaude, se reproduisent par graines et meurent avec le gel d’automne. L’herbe-de-porc est une mauvaise herbe majeure des légumes de saison chaude (Webster, 2006) et des cultures en rangs (Sellers et al., 2003).
Également appelées amarantes, les amarantes sont originaires de certaines parties de l’Amérique du Nord et de l’Amérique centrale. La culture des cultures et le commerce humain ont ouvert de nouvelles niches, permettant à l’herbe de porc d’envahir les écosystèmes agricoles des Amériques et de certaines parties de l’Europe, de l’Asie, de l’Afrique et de l’Australie. La plupart des amarantes produisent des légumes verts nutritifs ou des cultures céréalières, et la plantation délibérée pour la nourriture a aidé certaines espèces de mauvaises herbes à se répandre dans le monde. Cependant, aucune des amarantes dont il est question ici n’est cultivée commercialement pour le grain, et les variétés modernes d’amarante à grains ne sont pas considérées comme des mauvaises herbes agricoles majeures.
Les problèmes d’amarante se sont accrus dans les systèmes de production sans labour avec des herbicides conventionnels, qui laissent des graines de mauvaises herbes à la surface et sélectionnent des populations résistantes aux herbicides (Sellers et al., 2003). Cependant, des populations élevées d’amarante peuvent se produire dans les fermes biologiques et non biologiques, et dans les systèmes conventionnels, de conservation et sans labour.
La description et l’identification
Les amarantes sont faciles à reconnaître, mais l’identification correcte des espèces d’amarantes peut être délicate. Deux espèces d’amarante ou plus se rencontrent souvent dans le même champ (fig. 1), des variations importantes peuvent se produire au sein d’une espèce et des hybrides interspécifiques se produisent occasionnellement (Sellers et al., 2003). Certains chercheurs considèrent le haut-rhizome et le haut-rhizome comme une seule espèce : A. tuberculatus (Pratt et Clark, 2001). Kansas State University Extension a publié un excellent guide d’identification des amarantes avec des illustrations photo et une clé pour distinguer les plantes matures de neuf amarantes adventices différentes (Horak et al., 1994).

Figure 1. Deux espèces d’amarante, provisoirement identifiées comme l’amarante de Palmer (à gauche) et l’amarante lisse (à droite), poussent au bord d’un lit paillé en plastique dans une production de légumes biologiques à Clemson, en Caroline du Sud. Crédit photo: Mark Schonbeck, Association de Virginie pour l’agriculture biologique.
Les semis d’amarante nouvellement émergents ouvrent une paire de cotylédons longs et étroits, d’environ 0,5 pouce de long sur 0,1 pouce de large, suivis des premières vraies feuilles, plus larges (fig. 2). Les plantes forment des racines pivotantes modérément profondes et ramifiées, et peuvent montrer une coloration rougeâtre distincte sur les racines, les tiges inférieures et le dessous des feuilles.

Figure 2. Dans cette chasse d’herbe annuelle d’été, l’amarante (Amaranthus sp.) se distingue par sa paire de cotylédons longs et étroits (feuilles de graines) et, sur les plantules plus anciennes, de vraies feuilles beaucoup plus ovales. Crédit photo: Mark Schonbeck, Association de Virginie pour l’agriculture biologique.
La plupart des amarantes se développent en grandes plantes dressées à buissonnantes, de 2 à 7 pieds de hauteur, avec des feuilles simples pétiolées (pédonculées) disposées alternativement (individuellement) sur les tiges (Fig. 3 bis). Les limbes des feuilles sont généralement de forme ovale à losange et mesurent de 2 à 6 pouces de long. L’amarante prostrée forme un tapis bas et étalé, avec des feuilles plus petites (environ un pouce) qui sont nettement entaillées à l’extrémité (Fig. 3b).

Figure 3. a. Ces amarres lisses au début de la tête mesurent environ quatre pieds de haut. b. L’amarante prostrée forme un tapis bas et étalé. Crédits photos: Mark Schonbeck, Association de Virginie pour l’agriculture biologique.
Les fleurs individuelles d’amarante sont petites, discrètes et généralement de couleur verdâtre. Les fleurs mâles et femelles sont portées sur la même plante (la plupart des espèces) ou des plantes séparées (waterhemp, amarante de Palmer). Chaque plante porte des milliers de fleurs en petites grappes à l’aisselle des feuilles, ou des épis plus gros, souvent ramifiés et densément compactés à l’extrémité des tiges principales et des branches principales (fig. 4). Les fleurs femelles forment des graines simples, petites, rondes, généralement brillantes, brun rougeâtre foncé à noir, d’environ 0,04 pouce de diamètre (Fig. 5). Environ 50 000 à 90 000 graines pèsent une once.

Figure 4. Amarante épineuse (à gauche) et amarante lisse (à droite) en fleur. Crédit photo: Mark Schonbeck, Association de Virginie pour l’agriculture biologique.
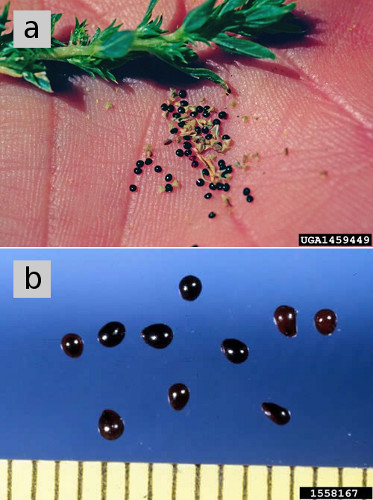
Figure 5. a) Graines d’amarante en culbutage. (b) Graines d’amarante à racines, agrandies, présentant un tégument sombre et brillant de graines matures. Crédits de la figure : (a) Steve Dewey, Université d’État de l’Utah, Bugwood.org . b) Ken Chamberlain, Université d’État de l’Ohio, Bugwood.org .
Voir le tableau 1 ci-dessous pour un guide rapide sur huit espèces d’amarantes communes d’Amérique du Nord, avec des liens vers des informations supplémentaires sur chacune d’elles.
| Nom commun et scientifique | Port de croissance | Inflorescence * | Aire géographique ** | Autres Caractéristiques de la plante |
|---|---|---|---|---|
| Amarante à racines rétroflexus | Dressée, ramifiée, de 2 à 7 pieds | Pointes terminales raides et ramifiées, branches individuelles généralement <longue de 2 po, plus épaisse que le crayon | Partout en Amérique du Nord, y compris en Alaska | Tige supérieure et feuilles généralement recouvertes de fines cheveux; Limbe des feuilles grand (6 po) sur des plantes vigoureuses |
| Amaranthus hybridus lisse | Érigé, ramifié, de 2 à 7 pi | Pointes terminales molles et très ramifiées, branches individuelles plus minces que le crayon | Partout en Amérique du Nord | Semblable à la racine rouge mais très variable, de nombreuses variantes locales peuvent s’hybrider avec des espèces étroitement apparentées |
| Amarante de Palmer Amaranthus palmeri | Épis terminaux dressés, ramifiés, de 2 à 10 pi | Longs (jusqu’à 18 po), simples ou peu ramifiés; mâle doux, femelle hérissée | Moitié sud des États-Unis, Grandes Plaines, Mexique | Croissance extrêmement rapide et agressive dans les climats chauds, fleurs mâles et femelles sur des plantes séparées; plantes lisses et glabres |
| Amarante Powell Amaranthus powellii | Dressées, ramifiées, de 2 à 6 pieds | Pointes terminales raides et ramifiées, branches de 4 à 8 po de long, plus épaisses que le crayon, tenues près de l’axe principal | Dans tout le Nord Amérique |
Première feuilles vraies plus étroites et plus effilées vers la pointe que la racine rouge ou lisse; la plante peut être lisse ou velue |
| Amarante épineuse Amaranthus spinosus | Dressée à touffue de 1 à 4 pieds | Épines terminales élancées et ramifiées, principalement des fleurs mâles; grappes axillaires, principalement des femelles | Partout en Amérique du Nord, mais surtout dans le sud-est des États-Unis | Paire d’épines ½ po raides et pointues à la base de chaque feuille; tiges lisses, glabres, souvent rouges |
| Waterhemp Amaranthus rudis ou A. tuberculatus*** | Des pointes terminales minces, simples ou ramifiées, dressées, hautes de 3 à 10 pieds | Partout aux États-Unis. fleurs mâles et femelles sur des plantes séparées; tiges et feuilles lisses et glabres; feuilles souvent plus longues et plus étroites que les autres espèces | ||
| Amaranthus blitoides prostrée | Tapis prostré à 3 pi de diamètre | Petites grappes denses à l’aisselle des feuilles | Partout aux États-Unis et dans le sud du Canada | Feuilles petites (lame d’environ 1 po) avec une encoche distincte à l’extrémité; graines d’un noir terne, plus grandes que chez les autres amarantes (0.06 po) |
| Amaranthus albus | Buisson globulaire de 1 à 3 pi de diamètre | Petites grappes denses à l’aisselle des feuilles | Partout en Amérique du Nord | Les plantes matures se détachent au niveau du sol et sont transportées par le vent, dispersant les graines; tiges blanches à vert pâle, feuilles vert clair |
| * Petites des grappes de fleurs sont généralement présentes à l’aisselle des feuilles de toutes les amarantes ** En Amérique du Nord (Canada, États-Unis, Mexique); de nombreuses espèces se sont naturalisées sur d’autres continents. *** Certains auteurs reconnaissent deux espèces, A. rudis (A. rudis) et A. tuberculatus (A. tuberculatus); d’autres les considèrent comme des sous-espèces ou des synonymes. |
||||
Cycle de vie, Reproduction, Dispersion des graines, Dormance des graines et germination
Les amarantes sont des annuelles d’été tendres au gel qui émergent, poussent, fleurissent et forment des graines matures pendant la période sans gel. Les semis émergent sur une période prolongée, avec des bouffées importantes à la fin du printemps ou au début de l’été (Fig. 6). Chez la plupart des espèces, la floraison et le développement des graines ont lieu principalement après le solstice d’été, en réponse au raccourcissement des longueurs de jour.
Figure 6. Une chasse d’eau de semis d’amarante lisse dans une ferme maraîchère de la région de Tidewater en Virginie, photographiée le 20 juin 2010, environ deux semaines après la levée. Crédit photo: Mark Schonbeck, Association de Virginie pour l’agriculture biologique.
L’herbe de porc se reproduit entièrement par graines. Une seule grande plante peut mûrir de 100 000 à 600 000 graines et des populations de 0.1 à 1 plante par pied carré peut jeter de 10 000 à 45 000 graines par pied carré, soit 0,4 à 2 milliards par acre (Massinga et al., 2001; Sellers et coll., 2003). Cette production de graines prolifique rend les amarres particulièrement difficiles à gérer, car une maturation réussie d’une seule plante pour 10 000 semis émergents peut permettre aux populations d’amarres d’augmenter plusieurs fois d’une année à l’autre.
Les amarres commencent généralement à fleurir et à répandre le pollen (anthèse) environ six semaines après la levée (EAE), bien que les fleurs puissent se produire dès 3 EAE ou aussi tard que 9 EAE (Huang et al., 2000; Keeley et coll., 1987; Shrestha et Swanton, 2007). Les fleurs s’ouvrent environ 1 à 2 semaines après que les boutons floraux deviennent visibles à l’œil nu.
Les intervalles de temps rapportés entre la pollinisation et la formation de graines viables vont de 7 à 12 jours dans la crevasse d’eau (Bell et Tranel, 2010) à 6 semaines dans les populations de champs d’amarante à racines en Ontario (Shrestha et Swanton, 2007). En Californie, l’amarante de Palmer a formé des graines viables 2 à 6 semaines après la floraison (Keeley et al., 1987). Les graines deviennent viables à peu près au même moment où elles développent leur couleur brun foncé ou noire mature.
Le développement de la reproduction est accéléré par le raccourcissement de la longueur du jour après le solstice d’été chez les populations de terrain (Keeley et al., 1987), et se déroule plus rapidement dans des photopériodes courtes (~ 12 heures) que dans des photopériodes plus longues (≥14 heures) dans une chambre de croissance (Huang et al., 2000). Bien que la plupart des graines soient produites à la fin de l’été et au début de l’automne, certaines graines matures ont été trouvées dans des têtes de graines d’amarante lisses au solstice d’été en Virginie (observation personnelle).
La capacité des plantes d’amarante déracinées ou coupées à la floraison à terminer la maturation des graines n’a pas été étudiée. Cependant, dans le nord de l’État de New York, des fragments de 2 à 4 pouces d’inflorescences d’amarante Powell se trouvant à la surface du sol contenaient des graines noires 3 semaines après que les mauvaises herbes aient été disquées à la floraison (Charles Mohler, Université Cornell, comm. commun.). Apparemment, si la pollinisation a lieu avant que les amarres ne soient arrachées ou hachées, il existe un certain potentiel de production de graines viables.
Les graines d’amarante sont dispersées à de nouveaux endroits par l’eau d’irrigation ou d’inondation, le fumier et le sol accrochés aux chaussures, aux pneus de tracteur ou aux outils de travail du sol. De plus, l’amarante en culbutage disperse activement les graines lorsque les plantes matures se détachent et se déplacent avec le vent.
Les graines d’amarante ont de multiples mécanismes de dormance, de sorte que les graines produites au cours d’une saison donnée germent à différents moments au cours des prochaines années, améliorant ainsi la persistance à long terme de la mauvaise herbe (Egley, 1986). Les graines d’amarante nouvellement rejetées sont pour la plupart dormantes et le deviennent moins au printemps suivant. La germination est favorisée par des températures élevées (95 ° F), des températures fluctuantes diurnes (par exemple, 85-95 ° F le jour, ~ 70 ° F la nuit) et parfois par la lumière (Guo et Al-Khatib, 2003; Schonbeck et Egley, 1980 et 1981 Steckel et al., 2004).
L’amarante émerge le plus facilement de la partie supérieure de 0,5 à 1,0 pouce du profil du sol, avec peu de graines situées plus profondément qu’un pouce (Mohler et Di Tommaso, non publié). Les graines nécessitent une humidité adéquate et un bon contact graine–sol pour absorber l’humidité et germer. Les graines enfouies plus profondément restent dormantes et viables pendant plusieurs années et germent lorsqu’elles sont ramenées à la surface par le travail du sol ou la culture. Bien que les poussées d’émergence suivent généralement la préparation ou la culture du lit de semence, les problèmes croissants d’amarante dans les cultures agronomiques ont été attribués à l’adoption généralisée du travail sans labour et du travail minimum du sol, qui laisse des graines de mauvaises herbes récemment rejetées à la surface du sol ou à proximité de la surface du sol (Sellers et al., 2003).
Habitude de croissance et impact sur les cultures
L’herbe de porc possède la voie photosynthétique en C4, qui lui confère une capacité à croître rapidement à des températures élevées et à des niveaux de lumière élevés, à tolérer la sécheresse et à rivaliser agressivement avec les légumes de saison chaude pour la lumière, l’humidité et les nutriments. La croissance est liée aux degrés-Jours de croissance cumulatifs, avec une température de base de 50 ° F (Shrestha et Swanton, 2007; Horak et Loughin, 2000); ainsi, les amarantes croissent beaucoup plus rapidement dans les climats chauds que dans les régions du Nord avec des étés plus frais.
Les espèces d’amarante dressées peuvent rapidement surpasser les cultures courtes comme le brocoli ou le haricot instantané. Dans les cultures plus hautes comme le maïs, l’herbe de porc réagit à l’ombre de la canopée en augmentant la croissance de la tige et en déployant les feuilles plus haut sur la plante, interceptant ainsi une plus grande fraction de la lumière disponible (Massinga et al., 2003; McLachlan et coll., 1993). Un à trois plants d’amarante par 10 pieds de rang émergeant avec du maïs ou du soja peuvent entraîner des pertes de rendement importantes (Klingman et Oliver, 1994; Knezevic et al., 1994; Massinga et coll., 2001) Qui émergent plusieurs semaines après l’émergence de la culture ont beaucoup moins d’effet sur les rendements.
L’herbe de porc est très sensible aux nutriments, en particulier à la forme nitrate de l’azote (N) (Blackshaw et Brandt, 2008; Teyker et al., 1991). La fertilisation améliore à la fois la biomasse des mauvaises herbes et la production de graines. De plus, le nitrate peut stimuler la germination des graines d’amarante (Egley, 1986). Un paillis de résidus de cultures de couverture de légumineuses a été observé pour améliorer l’émergence de l’amarante certaines années (Fig. 7), probablement en raison de la minéralisation rapide de la légumineuse N (Teasdale et Mohler, 2000).

Figure 7. Dans cet essai au champ, une chasse d’amarante rivalise avec le brocoli planté sans labour dans la vesce velue tuée (au premier plan), tandis que le brocoli planté dans le seigle tué ou la vesce de seigle sont relativement exempts d’amarante (en arrière–plan). La minéralisation rapide de l’azote provenant des résidus de cultures de couverture entièrement légumineuses a apparemment stimulé la germination et la croissance de l’amarante. Crédit photo: Mark Schonbeck, Association de Virginie pour l’agriculture biologique.
Comme les petites graines ont des réserves nutritives minimales, les plantules d’amarante dépendent au départ davantage des nutriments facilement disponibles dans le sol, en particulier du phosphore (P) et du potassium (K), que les plantes à graines plus grandes telles que le maïs, les haricots et les cucurbitacées (Hoveland et al., 1976; Mohler, 1996). Cependant, dans des études menées sur des sols organiques (boue) en Floride, l’amarante lisse et l’amarante épineuse étaient moins sensibles que la laitue aux niveaux de P, et une application en bande d’engrais à base de P améliorait la capacité de la culture à lutter contre ces mauvaises herbes (Santos et al., 1997; Shrefler et coll., 1994).
Les amarres sont intolérantes à l’ombre, et la croissance et la reproduction des individus qui émergent sous un couvert végétal lourd sont considérablement réduites. Cependant, l’allongement rapide de la tige permet aux amarantes d’échapper à l’ombrage dans de nombreuses situations de culture. L’herbe de porc en fin de saison qui brise les cucurbitacées, les tomates, les poivrons et d’autres légumes établis peut favoriser les maladies des cultures en réduisant la circulation de l’air, interférer avec la récolte et ensemencer plusieurs milliers de graines (Fig. 8).

Figure 8. L’amarante est apparue plusieurs semaines après la plantation de courges et n’a pas affecté le rendement. À la fin de la récolte, cependant, chaque mauvaise herbe a mûri des milliers de graines et fera un dépôt important dans la banque de graines de mauvaises herbes à moins qu’elles ne soient enlevées rapidement. Crédit photo: Mark Schonbeck, Association de Virginie pour l’agriculture biologique.
L’herbe de porc est signalée comme hôte de nématodes nuisibles (Meloidogyne spp.) et de nombreux agents pathogènes des cultures légumières, y compris des champignons qui causent le mildiou précoce chez la pomme de terre et la tomate (Alternaria solani), la goutte de laitue (Sclerotinia sclerotiorum) et le mildiou méridional (Sclerotium rolfsii) dans un large éventail de cultures. Des agents pathogènes viraux tels que le virus de la mosaïque du concombre et le virus de la flétrissure tachetée de la tomate peuvent également être transmis par les amarres (Mohler et DiTommaso, non publiés).
L’herbe de porc est devenue le centre des efforts de lutte biologique contre les agents pathogènes fongiques et les insectes phytopharmaceutiques, bien qu’aucun produit de lutte biologique ne soit encore disponible pour les agriculteurs. Le dendroctone de l’amarante (Disonycha glabrata) est présent dans une grande partie des États-Unis (Tisler, 1990) et se nourrit du feuillage de l’amarante (fig. 9), et peut devenir un ennemi naturel important de l’amarante dans certaines régions, y compris le comté de Floyd, en Virginie (observation personnelle). Cependant, il ne contrôle généralement pas les mauvaises herbes et se nourrit occasionnellement de plants de légumes.

Figure 9. Le scarabée de l’amarante se nourrit du feuillage de l’amarante et a été observé pour provoquer une défoliation importante et réduire la vigueur des mauvaises herbes dans certaines parties de la Virginie. Cet insecte peut parfois devenir un ravageur de la betterave et de la bette à carde en se nourrissant de semis. Crédit photo: Mark Schonbeck, Association de Virginie pour l’agriculture biologique.
Gestion
Les agriculteurs biologiques gèrent les amarres en tirant parti de leurs points de vulnérabilité. Les petites graines ont des réserves nutritives minimales; ainsi, les semis ne peuvent émerger que de graines situées à moins d’un pouce de la surface du sol et dépendent immédiatement du sol pour obtenir des nutriments facilement disponibles. Les cultures transplantées et à grandes graines ont des réserves substantielles de nutriments et peuvent avoir un avantage concurrentiel sur les semis d’amarante si des sources de nutriments à libération lente sont utilisées.
Les semis délicats sont facilement tués par sectionnement, déracinement, enfouissement ou chaleur. Le désherbage à la flamme ou la culture en temps opportun avec une variété d’outils peut éliminer une chasse d’herbe à pigeon. L’amarante émergente est également sensible à l’ombrage et aux obstacles physiques causés par le paillis. Une étude de terrain à Beltsville, dans le Maryland, documente la plus grande sensibilité de l’amarante à la suppression avec des paillis organiques par rapport à plusieurs autres mauvaises herbes communes : l’amarante à racines >quartier d’agneau>sétaire géante>velvetleaf (Teasdale et Mohler, 2000) .
Une action rapide est vitale, car les amarantes deviennent rapidement plus difficiles à tuer une fois qu’elles dépassent un pouce et développent quatre vraies feuilles ou plus (Fig. 10). Dans les climats froids, les plantules d’amarante peuvent rester vulnérables à la culture jusqu’à 4 WAE (Weaver et McWilliams, 1980); cependant, dans les climats plus chauds, elles peuvent atteindre 2 à 4 pouces dans les 2 WAE (Sellers et al., 2003).

Figure 10. La plantule d’amarante à droite est au stade vulnérable, au cours duquel elle peut être facilement tuée par une culture peu profonde ou une flambée, ou bloquée par du paillis. Lorsque l’amarante devient aussi grosse que la plantule de gauche, elle devient plus difficile à tuer, nécessitant une culture plus vigoureuse. Crédit photo: Mark Schonbeck, Association de Virginie pour l’agriculture biologique.
Les populations d’amarante s’adaptent facilement aux systèmes de production et aux tactiques de contrôle. Par exemple, les réponses à la germination des graines montrent des changements adaptatifs aux différentes rotations des cultures (Brainard et al., 2007), et une résistance généralisée aux herbicides a été signalée chez plusieurs espèces (Fugate, 2009; Volenberg et al., 2007). Ainsi, le recours à un seul outil de gestion ou à la même stratégie année après année produira probablement des rendements décroissants au fil du temps.
Lorsqu’elles sont utilisées en combinaison, les pratiques décrites ci-dessous peuvent permettre une gestion efficace de l’amarante dans les systèmes organiques.
Culture et désherbage à la flamme
Surveillez régulièrement les cultures pour détecter l’émergence des mauvaises herbes. Cultivez lorsque les amarres sont au stade du cotylédon, ou avant qu’elles n’atteignent un pouce de hauteur, en travaillant aussi près de la rangée de cultures que possible. Lorsque la culture est suffisamment établie, réglez les cultivateurs pour déplacer un pouce environ de terre en rangées pour enterrer les petites mauvaises herbes. La couche superficielle de sol meuble et sec laissée par la culture (paillis de poussière) dissuade la germination supplémentaire de l’amarante. Évitez de recompacter le sol, car le compactage peut favoriser une nouvelle levée d’émergence (Fig. 11).

Figure 11La culture a laissé un paillis de poussière autour de ces jeunes plants de courges, décourageant ainsi la germination de l’amarante et d’autres mauvaises herbes à petites graines. Cependant, la circulation piétonne a suffisamment recomposé le sol pour rétablir le contact graines-sol près de la surface, permettant ainsi aux graines de mauvaises herbes d’absorber l’humidité, de germer et de pousser dans les empreintes. Crédit photo: Mark Schonbeck, Association de Virginie pour l’agriculture biologique.
Le désherbage à la flamme permet d’éliminer l’amarante et d’autres plantules à feuilles larges juste avant la levée de la culture. Il est souvent utilisé pour les cultures à démarrage lent comme la carotte, la betterave et le panais. Parce que le flambage ne tue généralement pas les semis de mauvaises herbes, il n’est pas recommandé lorsque les herbes constituent une partie importante de la flore des mauvaises herbes.
Fauchage et pâturage
Une fois que la culture est trop grande pour être cultivée par tracteur, les agriculteurs fauchent, coupent ou arrachent souvent les mauvaises herbes dans les allées pour maintenir la circulation de l’air autour de la culture, faciliter la récolte et empêcher la propagation des mauvaises herbes. Cela devrait être fait avant l’ouverture des fleurs d’amarante (quelques jours après la première apparition des capitules) pour éviter la formation de graines viables.
Certains agriculteurs tondent des allées entre de larges rangées ou des lits paillés en plastique avec une tondeuse à pousser ou un coupe-fil comme alternative à la culture pour économiser le sol. Deux fauchages opportuns avant la fermeture de la canopée ont permis un contrôle adéquat entre les rangs de la sétaire géante, de l’herbe-de-porc et de l’herbe à poux dans le soja planté dans un espacement de rangs de 30 pouces (Donald, 2000).
La plupart des amarres sont très agréables au goût pour le bétail. Cependant, les graines matures traversent les voies digestives des animaux indemnes, et le fumier est une source notoire de graines d’amarante. Ainsi, l’amarante doit être broutée alors qu’elle est encore végétative. Notez également que le Programme biologique national exige un intervalle de 120 jours entre les dépôts de fumier par les animaux en pâturage et la prochaine récolte de cultures vivrières.
Paillage
Le paillage peut être une tactique efficace de lutte contre l’herbe de porc dans la production de légumes. Un paillis organique, tel que 3-4 pouces de paille ou de foin (~ 5-10 tonnes / ac), appliqué dans la journée suivant la culture d’une culture établie, peut réduire l’émergence ultérieure de l’amarante de 90%. Alternativement, un paillis synthétique tel que du plastique noir peut être posé avant la plantation de la culture, et les mauvaises herbes de ruelle contrôlées par la culture, la tonte, le paillis organique ou la culture de couverture. Note: Si du plastique ou un autre paillis synthétique est utilisé pour les cultures biologiques, il doit être retiré du champ à la fin de la récolte ou de la saison de croissance.
La transplantation biologique sans labour de tomates et d’autres légumes d’été dans des cultures de couverture d’hiver serties en rouleaux ou fauchées peut contrôler les populations d’amarante légères à modérées. Les résidus de seigle libèrent des inhibiteurs naturels de la croissance des plantes (composés allélochimiques) qui suppriment l’amarante et certaines autres mauvaises herbes annuelles (Barnes et Putnam, 1983; Putnam et al., 1983) sans affecter les légumes transplantés.
Gestion des nutriments et de l’humidité
Utilisez des sources d’azote à libération lente et d’autres nutriments des cultures, et évitez l’application par diffusion de matériaux à libération plus rapide comme la farine de sang et la farine d’os, ce qui peut donner à l’amarante le saut sur la culture. Pour les mangeoires lourdes comme le brocoli ou les épinards qui ont besoin de matériaux rapides de N, de bande ou de robe latérale à l’intérieur ou à proximité de la rangée de cultures au début de la croissance rapide des cultures.
Utilisez l’irrigation goutte à goutte en rangée pour fournir de l’eau et de l’engrais organique liquide directement à la culture sans nourrir ni arroser les mauvaises herbes entre les rangs. Les lignes d’égouttement souterraines peuvent fournir de l’humidité à la culture et laisser la surface du sol sèche, minimisant ainsi l’émergence des mauvaises herbes à l’intérieur des rangs.
Rotation des cultures, Horaires de plantation et Lit de semence rassis
Planifiez la rotation des cultures et planifiez les opérations au champ pour perturber le cycle de vie de l’amarante. Évitez de fournir une niche ouverte (sol nu) année après année pour l’émergence de l’amarante à la fin du printemps au début de l’été. Alterner les légumes de saison chauds et froids. Envisagez de retarder la préparation du lit de semence pour un légume d’été jusqu’après le moment de la levée maximale de l’amarante. Après plusieurs années de production intensive de légumes, faites tourner le champ vers du gazon vivace (p. ex., trèfle des prés et trèfle rouge) pendant deux ou trois ans pour perturber le cycle de vie de l’amarante et encourager la prédation des graines de mauvaises herbes.
Si les populations d’amarante sont élevées (fig. 12), préparer un lit de semence rassis à la fin du printemps pour tirer vers le bas la banque de graines de mauvaises herbes. Labourez ou cultivez, puis roulez ou cultivez le sol pour améliorer le contact graine–sol, favorisant ainsi la germination des mauvaises herbes. Saupoudrer d’irriguer si le sol est sec. Répétez la culture au besoin. Juste avant la plantation ou la levée des cultures, utilisez une culture peu profonde et laissez la surface libre pour décourager la germination supplémentaire des mauvaises herbes. La chasse finale peut également être tuée par la flamme si les mauvaises herbes sont rares ou absentes.

Figure 12. Un tapis de semis d’amarante épineuse provient d’une grande banque de graines de mauvaises herbes. Un lit de semence rassis ou une jachère cultivée est nécessaire pour maîtriser cette situation. Crédit photo: Mark Schonbeck, Association de Virginie pour l’agriculture biologique.
Compétition des cultures et culture de couverture
Avec une bonne lutte contre les mauvaises herbes en début de saison, les cultures vigoureuses comme la tomate, la patate douce et la courge d’hiver peuvent tolérer l’amarante émergente plus tard. Cependant, la compétition des cultures peut ne pas contrôler l’herbe de porc, en raison de leur réaction d’évitement de l’ombre et de leur capacité à percer la canopée de la culture grâce à un allongement rapide de la tige.
Les cultures de couverture estivales compétitives telles que le sarrasin, le sorgho–sudangrass, le niébé et le soja fourrager sont souvent utilisées pour supprimer les mauvaises herbes entre les cultures maraîchères du printemps et de l’automne. En Floride, les cultures de couverture de niébé, de niébé ou de haricot velu ensemencées à des taux élevés ont diminué, mais n’ont pas éliminé la croissance lisse de l’amarante (Collins et al., 2008).
Lorsque vous utilisez des cultures de couverture d’été pour lutter contre l’herbe de porc, semez à des taux élevés (1,5 à 2 fois la normale) et utilisez de bonnes méthodes d’ensemencement pour obtenir un peuplement de culture de couverture anti–mauvaises herbes. Combinez le niébé, le soja fourrager ou une autre légumineuse d’été avec une herbe haute comme le millet perlé ou le sorgho–sudangrass pour développer une canopée à la fois haute et dense. Surveillez la récolte de près; si une quantité importante d’amarante pousse avec elle, terminez la récolte rapidement lorsque les capitules des mauvaises herbes apparaissent pour la première fois.
Gestion de la banque de graines d’amarante
Étant donné que les amarantes produisent des graines de manière si proliférante, il est essentiel de minimiser la pluie annuelle de graines sur le sol. Bien qu’un contrôle rigoureux des mauvaises herbes pendant six ans puisse réduire la banque de graines d’amarante de 99 %, un contrôle plus rigoureux des mauvaises herbes permet au nombre de graines de revenir à des niveaux proches de ceux d’origine en trois ans (Schweizer et Zimdahl, 1984). L’amarante qui émerge après la période minimale d’absence de mauvaises herbes d’une culture peut ne pas réduire le rendement de la culture, mais elle doit être arrachée ou coupée avant la floraison pour éviter la formation de graines matures.
Il peut être payant de marcher dans des champs de cultures en maturation pour arracher ou hacher de grosses mauvaises herbes; les petites amarantes rabougries sous un couvert végétal ne forment qu’un petit nombre de graines. Si des capitules sont déjà formés, retirez les plantes d’amarante coupées ou déracinées du champ. Si les plantes d’amarante ont déjà formé des graines, notez que beaucoup de graines resteront dans la tête jusqu’à l’hiver. Par conséquent, l’élimination des mauvaises herbes au début de l’automne peut encore réduire considérablement la pluie de graines d’amarante.
En cas de forte pluie de graines d’amarante, certains spécialistes des mauvaises herbes recommandent un travail du sol par inversion pour déplacer les graines à une profondeur d’où elles ne peuvent pas émerger (Mohler et Di Tommaso, non publié). Bien que 5 à 14 % des graines d’amarante à racines et d’herbe à l’eau aient survécu à des enterrements de 9 à 12 ans à une profondeur de 8 pouces dans le Nebraska (Burnside et al., 1996), d’autres ont signalé que les graines d’amarante ont une durée de vie assez courte (3-4 ans) dans le sol dans des régions plus humides telles que le Mississippi et l’Illinois (Buhler et Hartzler, 2001; Egley et Williams, 1990; Steckel et al., 2007). Il a été signalé que le labour de la moisissure augmente l’émergence de l’amarante si les populations de mauvaises herbes sont faibles, mais diminue l’émergence si les populations sont élevées en raison d’une pluie de graines récente (Schweizer et Zimdahl, 1984).
Lorsque vous utilisez le travail du sol par inversion pour gérer un dépôt de semences lourd, labourez le champ une fois, puis évitez le travail du sol en profondeur pendant plusieurs années pour permettre aux graines enfouies de perdre leur viabilité.
Cet article fait partie d’une série traitant de la famille envahissante des amarantes. Pour plus d’informations, consultez les articles suivants :
- Profil des mauvaises herbes : Amaranthus spp.)
- Amarante de Redroot (Amaranthus retroflexus)
- Amarante de Powell (Amaranthus powellii)
- Amarante Épineuse (Amaranthus spinosus)
- Amarante de Palmer (Amaranthus palmeri)
- Amarante lisse (Amaranthus hybridus)
- Amarante de Dégringolade (Amaranthus albus)
- L’amarante prostrée (Amaranthus blitoides)
- L’Amarante commune (Amaranthus rudis) et l’Amarante haute (A. tuberculatus)
Références citées
- Barnes, J. P. et A. R. Putnam. 1983. Les résidus de seigle contribuent à la suppression des mauvaises herbes dans les systèmes de culture sans travail du sol. Journal of Chemical Ecology 9: 1045-1057. (Disponible en ligne à l’adresse suivante : http://dx.doi.org/10.1007) (vérifié le 10 septembre 2012).
- Bell, M. S., et P. J. Tranel. Temps requis entre la pollinisation et la maturité des graines chez l’Amaranthus tuberculatus (Amaranthus tuberculatus). Science des mauvaises herbes 58:167-173. (Disponible en ligne à l’adresse suivante : http://dx.doi.org/10.1614/WS-D-09-00049.1) (vérifié le 10 septembre 2012).
- Blackshaw, R. E., et R. N. Brandt. 2008. Les effets du taux d’engrais azoté sur la compétitivité des mauvaises herbes dépendent de l’espèce. Science des mauvaises herbes 56:743-747. (Disponible en ligne à l’adresse suivante : http://dx.doi.org/10.1614/WS-08-065.1) (vérifié le 10 septembre 2012).
- Brainard, D. C., A. DiTommaso et C. A. Mohler. 2007. Variation intraspécifique des caractéristiques des graines de l’amarante de Powell (Amaranthus powellii) à partir d’habitats présentant des histoires contrastées de rotation des cultures. Science des mauvaises herbes 55:218-226. (Disponible en ligne à l’adresse suivante : http://dx.doi.org/10.1614/WS-06-134.1) (vérifié le 10 septembre 2012).
- Buhler, D. D. et R. G. Hartzler. 2001. Émergence et persistance des graines de feuilles de velours, de houppier commun, d’agropyre laineux et de sétaire géante. Science des mauvaises herbes 49:230-235. (Disponible en ligne à: http://dx.doi.org/10.1614/0043-1745(2001)049%5B0230:EAPOSO%5D2.0.CO ; 2) (vérifié le 10 sept. 2012).
- Burnside, O. C., R. G. Wilson, S. Weisberg et K. G. Hubbard. 1996. Longévité des graines de 41 espèces de mauvaises herbes enfouies 17 ans dans l’est et l’ouest du Nebraska. Science des mauvaises herbes 44:74-86. (Disponible en ligne à l’adresse suivante : http://www.jstor.org/stable/4045786) (vérifié le 10 septembre 2012).
- Collins, A. S., C. A. Chase, W. M. Stall et C. M. Hutchinson. 2008. Densités optimales de trois cultures de couverture légumineuses pour la suppression de l’amarante lisse (Amaranthus hybridus). Science des mauvaises herbes 56:753-761. (Disponible en ligne à l’adresse suivante : http://dx.doi.org/10.1614/WS-07-101.1) (vérifié le 10 septembre 2012).
- Donald, W. W. 2000. Fauche entre les rangs + herbicide appliqué en bande dans les rangs pour lutter contre les mauvaises herbes dans la glycine max. Science des mauvaises herbes 48:487-500. (Disponible en ligne à l’adresse suivante : http://www.jstor.org/stable/4046280) (vérifié le 10 septembre 2012).
- Egley, G. H. 1986. Stimulation de la germination des graines de mauvaises herbes dans le sol. Avis sur la science des mauvaises herbes 2: 67-89.
- Egley, G. H. et R. D. Williams. 1990. Decline of weed seeds and seedling emergence over five years as affected by soil perturbations. Science des mauvaises herbes 38:504-510. (Disponible en ligne à l’adresse suivante : http://www.jstor.org/stable/4045064) (vérifié le 10 septembre 2012).
- Fugate, L. 2009. L’amarante pousse les agriculteurs à repenser les méthodes agricoles. Nouvelles du Service de Vulgarisation Coopérative de la Division de l’Agriculture de l’Université de l’Arkansas – Octobre 2009.
- Guo, P., et K. Al-Khatib. 2003. Effets de la température sur la germination et la croissance de l’amarante à racines rouges (Amaranthus retroflexus), de l’amarante de Palmer (A. palmeri) et de l’amarante commune (A. rudis). Science des mauvaises herbes 51:869-875. (Disponible en ligne à l’adresse suivante : http://dx.doi.org/10.1614/P2002-127) (vérifié le 10 septembre 2012).
- Horak, M. J. et T. M. Loughin. 2000. Analyse de la croissance de quatre espèces d’Amaranthus. Science des mauvaises herbes 48:347-355. (Disponible en ligne à: http://dx.doi.org/10.1614/0043-1745(2000)048%5B0347:GAOFAS%5D2.0.CO ; 2) (vérifié le 10 sept. 2012).
- Horak, M. J., D. E. Peterson, D. J. Chessman et L. M. Wax. 1994. Identification de l’amarante : un guide pictural des amarantes communes des Grandes Plaines. 12 pages. (Disponible en ligne à l’adresse suivante : http://www.ksre.ksu.edu/bookstore/pubs/S80.pdf) (vérifié le 6 août 2013).
- Hoveland, C. S., G. A. Buchanan et M. C. Harris. 1976. Réponse des mauvaises herbes au phosphore et au potassium du sol. Science des mauvaises herbes 24:194-201. (Disponible en ligne à l’adresse suivante : http://www.jstor.org/stable/4042586) (vérifié le 10 septembre 2012).
- Huang, J. Z., A. Shrestha, M. Tollenar, W. Deen, H. Rahimian et C. J. Swanton. 2000. Effet de la photopériode sur le développement phénologique de l’amarante à racines rouges (Amaranthus retroflexus L.). Revue canadienne des sciences végétales 80:929-938.
- Keeley, P. E., C. H. Carter et R. J. Thullen. 1987. Influence de la date de plantation sur la croissance de l’amarante de Palmer (Amaranthus palmeri). Science des mauvaises herbes 35:199-204. (Disponible en ligne à l’adresse suivante : http://www.jstor.org/stable/4044391) (vérifié le 10 septembre 2012).
- Klingman, T. E., et L. R. Oliver. 1994. Interférence de l’amarante de Palmer (Amaranthus palmeri) dans le soja (Glycine max). Science des mauvaises herbes 42:523-527. (Disponible en ligne à l’adresse suivante : http://www.jstor.org/stable/4045448) (vérifié le 10 septembre 2012).
- Knezevic, S. Z., S. F. Weise et C. J. Swanton. 1994. Interférence de l’amarante à racines rouges (Amaranthus retroflexus) dans le maïs (Zea mays). Science des mauvaises herbes 42:568-573. (Disponible en ligne à l’adresse suivante : http://www.jstor.org/stable/4045456) (vérifié le 10 septembre 2012).
- Massinga, R. A., R. S. Currie, M. J. Horak et J. Boyer, Jr. 2001. Interférence de l’amarante de Palmer dans le maïs. Science des mauvaises herbes 49:202-208. (Disponible en ligne à: http://dx.doi.org/10.1614/0043-1745(2001)049%5B0202:IOPAIC%5D2.0.CO ; 2) (vérifié le 10 sept. 2012).
- Massinga, R. A., R. S. Currie, et T. P. Troien. 2003. Utilisation de l’eau et interception de la lumière sous l’amarante de Palmer (Amaranthus palmeri) et la compétition du maïs. Science des mauvaises herbes 51:523-531. (Disponible en ligne à: http://dx.doi.org/10.1614/0043-1745(2003)051%5B0523:WUALIU%5D2.0.CO ; 2) (vérifié le 10 sept. 2012).
- McLachlan, S. M., M. Tollenaar, C. J. Swanton et S. F. Weise. 1993. Effect of corn-induced shading on dry matter accumulation, distribution, and architecture of redroot pigweed (Amaranthus retroflexus). Science des mauvaises herbes 41:568-573. (Disponible en ligne à l’adresse suivante : http://www.jstor.org/stable/4045424) (vérifié le 10 septembre 2012).
- Mohler, C.A. 1996. Bases écologiques pour le contrôle culturel des mauvaises herbes annuelles. Journal de l’agriculture de production 9:468-474..
- Mohler, C. A., et A. DiTommaso. Inédit. Gérer les mauvaises herbes dans votre ferme : Guide des Stratégies écologiques. Département des Sciences des Cultures et des Sols, Université Cornell. Projet de pré-publication, version 5.1. Publication prévue en 2012.
- Pratt, D. B., et L. G. Clark. 2001. Amaranthus rudis et A. tuberculatus — une espèce ou deux? Journal de la Société botanique de Torrey 128:282-296. (Disponible en ligne à: http://www.jstor.org/stable/3088718) (vérifié le 10 septembre 2012).
- Putnam, A. R., J. DeFrank et J. P. Barnes. 1983. Exploitation of allelopathy for weed control in annual and perennial cropping systems. Journal of Chemical Ecology 9:1001-1010. (Disponible en ligne à l’adresse suivante : http://dx.doi.org/10.1007) (vérifié le 10 septembre 2012).
- Santos, B. M., J. A. Dusky, D. G. shilling, W. M. Stall et T. A. Bewick. 1997. Effet de la fertilité du phosphore sur les interactions compétitives de l’amarante lisse (Amaranthus hubridus), de l’amarante épineuse (Amaranthus spinosus) et du pourpier commun (Portulaca oleracea) avec la laitue. Résumé de la Weed Science Society of America 37:54.
- Schonbeck, M. W., et G. H. Egley. 1980 Réponses de germination des graines d’amarante à la racine (Amaranthus retroflexus) à la post-maturation, à la température, à l’éthylène et à d’autres facteurs environnementaux. Science des mauvaises herbes 28:543-548. (Disponible en ligne à l’adresse suivante : http://www.jstor.org/stable/4043277) (vérifié le 10 septembre 2012).
- Schonbeck, M. W., et G. H. Egley. 1981. Changements dans la sensibilité des graines d’Amaranthus retroflexus L. à l’éthylène pendant la préincubation. II. Effets de l’alternance de la température et de l’enfouissement dans le sol. Plante, Cellule et environnement 4:237-242. (Disponible en ligne à l’adresse suivante : http://dx.doi.org/10.1111/1365-3040.ep11611005) (vérifié le 10 septembre 2012).
- Schweizer, E. E., et R. L. Zimdahl. 1984. Déclin des graines de mauvaises herbes dans le sol irrigué après six ans de maïs continu (Zea mays) et d’herbicides. Science des mauvaises herbes 32:76-83. (Disponible en ligne à l’adresse suivante : http://www.jstor.org/stable/4043886) (vérifié le 10 septembre 2012).
- Sellers, B. A., R. J. Smeda, W. G. Johnson, J. A. Kendig et M. R. Ellersieck. 2003. Croissance comparative de six espèces d’Amaranthus dans le Missouri. Science des mauvaises herbes 51:329-333. (Disponible en ligne à: http://dx.doi.org/10.1614/0043-1745(2003)051%5B0329:CGOSAS%5D2.0.CO ; 2) (vérifié le 10 sept. 2012).
- Shrefler, J. W., J. A. Dusky, D. G. Shilling, B. J. Brecke et C. A. Sanchez. 1994. Effet de la fertilité du phosphore sur la compétition entre la laitue (Lactuca sativa) et l’amarante épineuse (Amaranthus spinosus). Science des mauvaises herbes 42:556-560. (Disponible en ligne à l’adresse suivante : http://www.jstor.org/stable/4045454) (vérifié le 10 septembre 2012).
- Shrestha, A., et C. J. Swanton. 2007. Paramétrage du développement phénologique de certaines mauvaises herbes annuelles dans des conditions de champ non cultivées. Science des mauvaises herbes 55:446-454. (Disponible en ligne à l’adresse suivante : http://dx.doi.org/10.1614/WS-06-176.1) (vérifié le 10 septembre 2012).
- Steckel, L. E., C. L. Sprague, E. W. Stoller et L. M. Wax. 2004. Effets de la température sur la germination de neuf espèces d’Amaranthus. Science des mauvaises herbes 52:217-221. (Disponible en ligne à l’adresse suivante : http://dx.doi.org/10.1614/WS-03-012R) (vérifié le 10 septembre 2012).
- Steckel, L. E., C. L. Sprague, E. W. Stoller, L. M. Wax et F. W. Simmons. 2007. Effets du travail du sol, du système de culture et de la profondeur du sol sur la persistance de la banque de graines de l’amarante commune (Amaranthus rudis). Science des mauvaises herbes 55:235-239. (Disponible en ligne à l’adresse suivante : http://dx.doi.org/10.1614/WS-06-198) (vérifié le 10 septembre 2012).
- Teasdale, J. R. et C. L. Mohler. 2000. La relation quantitative entre l’émergence des mauvaises herbes et les propriétés physiques des paillis. Science des mauvaises herbes 48:385-392. (Disponible en ligne à: http://dx.doi.org/10.1614/0043-1745(2000)048%5B0385:TQRBWE%5D2.0.CO ; 2) (vérifié le 10 sept. 2012).
- Teyker, R. H., H. D. Hoelzer et R. A. Liebl. 1991. Réponse du maïs et de l’amarante à l’apport et à la forme d’azote. Plant and Soil 135:287-292. (Disponible en ligne à l’adresse suivante : http://dx.doi.org/10.1007) (vérifié le 10 septembre 2012).
- Tisler, A. M. 1990. Se nourrissant du scarabée de l’amarante, Disonycha glabrata Fab. (Coléoptères: Chrysomelidae), sur Amaranthus retroflexus. Journal des sciences de Virginie 41:243-245.
- Volenberg, D. S., W. L. Patzoldt, A. G. Hager et P. J. Tranel. 2007. Responses of contemporary and historical waterhemp (Amaranthus tuberculatus) accessions to glyphosate. Science des mauvaises herbes 55:327-333. (Disponible en ligne à: http://dx.doi.org/10.1614/WS-06-121) (vérifié le 10 septembre 2012).
- Weaver, S. E. et E. L. McWilliams. 1980. La biologie des mauvaises herbes canadiennes. 44. Amaranthus retroflexus L, A. powellii S. Wats et A. hybridus L. Revue canadienne des sciences végétales 60: 1215-1234.
- Webster, T. M. 2006. Enquête sur les mauvaises herbes – États du sud. Sous-section des cultures de légumes, de fruits et de noix. Actes de la Southern Weed Science Society 59:260-277. (Disponible en ligne à l’adresse suivante : http://www.swss.ws/wp-content/uploads/docs/Southern%20Weed%20Survey%202006%20Vegetables%20and%20Fruits.pdf) (vérifié le 10 septembre 2012).