autor:
Dr. Mark schonbeck, Virginia Association for biological Farming
- streszczenie
- wprowadzenie
- opis i identyfikacja
- cykl życia, rozmnażanie, rozpraszanie nasion, uśpienie nasion i kiełkowanie
- nawyk wzrostu i wpływ na uprawy
- Zarządzanie
- uprawa i pielenie płomieniowe
- koszenie i wypas
- ściółkowanie
- Zarządzanie składnikami odżywczymi i wilgocią
- płodozmian, harmonogramy sadzenia i stęchłe podłoże nasienne
- Konkurs upraw i uprawa okładek
- Zarządzanie bankiem nasion Pigweed
- Ten artykuł jest częścią serii omawiającej inwazyjną rodzinę świniowatych. Aby uzyskać więcej informacji, zobacz następujące artykuły:
- piśmiennictwo cytowane
streszczenie
pigwowce to wspólna nazwa dla kilku blisko spokrewnionych letnich jednorocznych, które stały się głównymi chwastami roślin warzywnych i rzędowych w Stanach Zjednoczonych i na całym świecie. Większość pigwowców to wysokie, wyprostowane do krzaczastych rośliny o prostych, owalnych do diamentowych, naprzemiennych liściach i gęstych kwiatostanach (skupiskach kwiatów) składających się z wielu małych, zielonkawych kwiatów. Pojawiają się, rosną, kwitną, sadzą nasiona i umierają w okresie wegetacji bez przymrozków.
prosiaki rozwijają się w upalne dni, tolerują suszę, reagują na wysoki poziom dostępnych składników odżywczych i są przystosowane do unikania cieniowania poprzez szybkie wydłużenie łodygi. Agresywnie konkurują z uprawami o ciepłych porach roku i rozmnażają się poprzez płodną produkcję nasion.
w systemach produkcji ekologicznej chlewy można zarządzać poprzez kombinację:
- terminowa uprawa, pielenie płomieniowe i ręczne usuwanie
- stęchłe podłoże nasienne
- mulczowanie
- płodozmian, który zmienia czas uprawy i innych operacji
- rośliny okrywowe i konkurencyjne uprawy gotówkowe
- środki zapobiegające lub minimalizujące produkcję żywotnych nasion
wprowadzenie
praktycznie każdy rolnik w Ameryce Północnej zna i zmaga się z pigwami, terminem obejmującym kilka gatunków z rodzaju Amaranthus, w tym:
- redroot pigweed (A. retroflexus)
- pigweed gładki (A. hybridus)
- Powell amaranth (A. powelii)
- Palmer amaranth (A. palmeri)
- spiny amaranth (A. spinosus)
- tumble pigweed (A. albus)
- prostrate pigweed (A. blitoides)
- waterhemp (A. tuberculatus = A. rudis)
te kochające ciepło letnie jednoroczne pojawiają się po wiosennych mrozach, szybko rosną, energicznie konkurują z uprawami o ciepłym sezonie, rozmnażają się przez nasiona i umierają wraz z jesiennymi mrozami. Chlewy to główne chwasty ciepłych warzyw sezonowych (Webster, 2006) i roślin rzędowych (Sellers et al., 2003).
zwane również amaranths, pigweeds pochodzą z części Ameryki Północnej i Środkowej. Uprawa roślin i handel ludźmi otworzyły nowe nisze, umożliwiając hodowcom świń inwazję ekosystemów rolniczych w obu Amerykach i częściach Europy, Azji, Afryki i Australii. Większość amarantsów produkuje pożywne zielone warzywa lub zboża, a celowe sadzenie żywności pomogło niektórym gatunkom chwastów rozprzestrzenić się na całym świecie. Jednak żaden z omawianych tu prosiaków nie jest uprawiany komercyjnie na zboże, a współczesne odmiany amarantusa zbożowego nie są uważane za główne chwasty rolnicze.
problemy z Pigwami wzrosły w systemach produkcji bez uprawy z konwencjonalnymi herbicydami, które pozostawiają nasiona chwastów na powierzchni i wybierają populacje odporne na herbicydy (Sellers et al., 2003). Jednak wysokie populacje pigw mogą występować w gospodarstwach ekologicznych i nieekologicznych oraz w systemach konwencjonalnych, ochronnych i bez uprawy.
opis i identyfikacja
chlewy są łatwe do rozpoznania, ale prawidłowa identyfikacja gatunków chlewów może być trudna. Dwa lub więcej gatunków pigw występują często razem na tym samym polu (rys. 1), znaczna zmienność może wystąpić w obrębie gatunku, a mieszańce międzygatunkowe sporadycznie występują (Sellers et al., 2003). Niektórzy badacze uważają, że tall waterhemp i common waterhemp to jeden gatunek: A. tuberculatus (Pratt and Clark, 2001). Kansas State University Extension opublikował doskonały przewodnik identyfikacji pigweed z ilustracjami fotograficznymi i kluczem do odróżnienia dojrzałych roślin dziewięciu różnych weedy amaranths(Horak et al., 1994).

Rysunek 1. Dwa gatunki pigw, wstępnie zidentyfikowane jako Palmer amaranth (po lewej) i smooth pigweed (po prawej), rosną na skraju plastikowego ściółki w ekologicznej produkcji warzyw w Clemson w Karolinie Południowej. Zdjęcie: Mark Schonbeck, Virginia Association for Biological Farming.
nowo powstające sadzonki pigw otwierają parę długich, wąskich liścieni, o długości około 0,5 cala i szerokości 0,1 cala, a następnie pierwsze prawdziwe liście, które są szersze w zarysie (rys. 2). Rośliny tworzą umiarkowanie Głębokie, rozgałęziające się stożki i mogą wykazywać wyraźne czerwonawe zabarwienie na korzeniach, dolnych łodygach i spodach liści.

Rysunek 2. W tym zalewie letnich rocznych sadzonek chwastów, Pigwowiec (Amaranthus sp.) można odróżnić od pary długich, wąskich liścieni (liści nasiennych), a na starszych sadzonkach prawdziwe liście, które są znacznie szerzej owalne w zarysie. Zdjęcie: Mark Schonbeck, Virginia Association for Biological Farming.
Większość prosiąt rośnie w duże, wyprostowane do krzaczastych rośliny, 2-7 stóp wysokości, z prostymi, petiolate (łodygi) liście ułożone naprzemiennie (pojedynczo) na łodygach (rys. 3A). Ostrza liści są zazwyczaj owalne do Diamentowego kształtu i 2-6 cali długości. Prostata pigweed tworzy niską, rozkładającą się matę, z mniejszymi (około jednego cala) liśćmi, które są wyraźnie karbowane na czubku (rys. 3b).

Rysunek 3. a. te gładkie prosiaki we wczesnym nagłówku mają około czterech stóp wysokości. B. Prostata pigweed tworzy niską, rozkładającą się matę. Zdjęcia kredyty: Mark Schonbeck, Virginia Association for Biological Farming.
poszczególne kwiaty pigw są małe, niepozorne i zwykle zielonkawe. Kwiaty męskie i żeńskie rodzą się na tej samej roślinie (większość gatunków) lub osobnych roślinach (waterhemp, Palmer amaranth). Każda roślina nosi tysiące kwiatów w małych skupiskach w kątach liści lub większe, często rozgałęzione, gęsto upakowane kolce na końcach głównych łodyg i głównych gałęzi (rys. 4). Kwiaty żeńskie tworzą pojedyncze, małe, okrągłe, Zwykle błyszczące, ciemne czerwonawo-brązowe do czarnych nasion, o średnicy około 0,04 cala (rys. 5). Około 50 000-90 000 nasion waży jedną uncję.

Rysunek 4. Kolczasty amarantus (po lewej) i gładkie pigweed (po prawej) w rozkwicie. Zdjęcie: Mark Schonbeck, Virginia Association for Biological Farming.
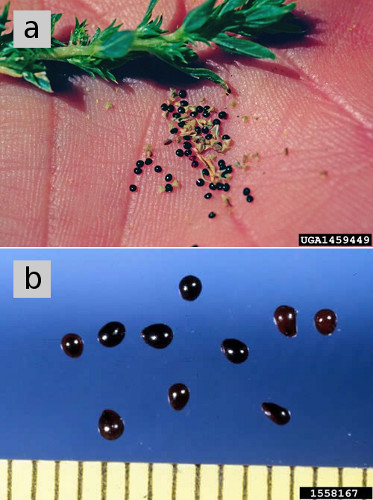
Rysunek 5. a) nasiona trzciny chlewnej. (b) nasiona Pigwowca redroot, powiększone, ukazujące ciemną, błyszczącą powłokę nasion dojrzałych nasion. Liczba punktów: a) Steve Dewey, Utah State University, Bugwood.org. B) Ken Chamberlain, Ohio State University, Bugwood.org.
Zobacz tabelę 1 poniżej, aby uzyskać krótki przewodnik po ośmiu wspólnych północnoamerykańskich gatunkach pigw, z linkami do dodatkowych informacji na temat każdego z nich.
| nazwa zwyczajowa i naukowa | zwyczaj wzrostu | kwiatostan* | zasięg geograficzny** | inne cechy roślin |
|---|---|---|---|---|
| redroot pigweed Amaranthus retroflexus | wyprostowane, rozgałęzione, 2-7 stóp | sztywne, rozgałęzione kolce końcowe, poszczególne gałęzie zwykle <2 długie, grubsze niż ołówek | w całej Ameryce Północnej, w tym na Alasce | górna łodyga i liście zwykle pokryte cienkimi włoskami; ostrza liściowe Duże (6 cali) na energicznych roślinach |
| gładkie Pigwowce Amaranthus hybridus | wyprostowane, rozgałęzione, 2-7 stóp | miękkie, silnie rozgałęzione kolce końcowe, poszczególne gałęzie cieńsze niż ołówek | w całej Ameryce Północnej | podobne do redroot, ale bardzo zmienne, wiele lokalnych wariantów, może hybrydyzować z blisko spokrewnionymi gatunkami |
| Palmer Amaranthus Amaranthus Palmeri | wyprostowany, rozgałęziony, 2-10 stóp | długie (do 18 cali), proste lub słabo rozgałęzione kolce końcowe; samiec miękki, samica Szczecina | Południowa połowa USA, Great Plains, Mexico | niezwykle szybki, agresywny wzrost w gorącym klimacie, męskie i żeńskie kwiaty na osobnych roślinach; rośliny gładkie i bezwłose |
| Powell Amaranthus Powellii | wyprostowane, rozgałęzione, 2-6 stóp | sztywne, rozgałęzione kolce końcowe, gałęzie 4-8 w długie, grubsze niż ołówek, trzymane blisko osi głównej | na całej północy Ameryka |
pierwsze prawdziwe liście węższe i bardziej zwężające się ku końcówce niż redroot lub gładkie; roślina może być gładka lub Owłosiona |
| kolczasty amarantus Amaranthus spinosus | wyprostowany do krzaczastego 1-4 stóp | smukłe, rozgałęzione kolce końcowe głównie męskie kwiaty; klastry pachowe głównie żeńskie | w całej Ameryce Północnej, ale głównie w południowo-wschodnich Stanach Zjednoczonych | para sztywnych, ostrych kolców ½ – w podstawie każdego liścia; łodygi gładkie, bezwłose, często czerwony |
| waterhemp Amaranthus Rudis lub A. Tuberculatus*** | wyprostowany, wysoki 3-10 stóp | smukłe, proste lub rozgałęzione kolce końcowe | w całych Stanach Zjednoczonych. i Południowa Kanada z wyjątkiem suchych obszarów | męskie i żeńskie kwiaty na oddzielnych roślinach; łodygi i liście gładkie i bezwłose; liście często dłuższe i węższe niż inne gatunki |
| Prostrate Pigweed Amaranthus blitoides | Prostrate mat do 3 stóp w poprzek | małe, gęste skupiska w kątach liści | w całej USA i Południowej Kanadzie | > liście małe (ostrze około 1 cala) z wyraźnym wycięciem na czubku; nasiona matowe czarne, większe niż u innych prosiąt (0.06 in) |
| Tumble Pigweed Amaranthus albus | kulisty krzew o średnicy 1-3 stóp | małe, gęste skupiska w kątach liści | w całej Ameryce Północnej | dojrzałe rośliny zrywają się na poziomie gruntu i są przenoszone przez wiatr, rozpraszając nasiona; pędy białe do bladozielonych, liście jasnozielone |
| * małe skupiska kwiatów występują zwykle w kątach liści wszystkich Amarantów ** w Ameryce Północnej (Kanada, USA, Meksyk); wiele gatunków zostało naturalizowanych na innych kontynentach. *** niektórzy autorzy uznają dwa gatunki, wodnik Zwyczajny (A. rudis) i Wodnik wysoki (A. tuberculatus); inni uważają je za podgatunki lub synonimy. |
||||
cykl życia, rozmnażanie, rozpraszanie nasion, uśpienie nasion i kiełkowanie
chlewy są wrażliwymi na mróz letnimi jednorocznymi, które pojawiają się, rosną, kwitną i tworzą dojrzałe nasiona w okresie wolnym od mrozu. Sadzonki pojawiają się w dłuższym okresie, z dużymi wypłuczeniami późną wiosną lub wczesnym latem (rys. 6). U większości gatunków kwitnienie i rozwój nasion odbywa się głównie po przesileniu letnim, w odpowiedzi na skrócenie długości dnia.
Rysunek 6. Płukanie gładkich sadzonek pigw na farmie warzywnej w regionie Tidewater w Wirginii, sfotografowane 20 czerwca 2010 r., około dwóch tygodni po pojawieniu się. Zdjęcie: Mark Schonbeck, Virginia Association for Biological Farming.
świnie rozmnażają się całkowicie przez nasiona. Pojedyncza duża roślina może dojrzeć 100 000-600 000 nasion, a populacje 0.1-1 roślin na stopę kwadratową może zrzucić 10 000-45 000 nasion na stopę kwadratową lub 0,4-2 miliardy na akr (Massinga et al., 2001; Sellers et al., 2003). Ta płodna produkcja nasion sprawia, że hodowla prosiąt jest szczególnie trudna do opanowania, ponieważ udane dojrzewanie tylko jednej rośliny na 10 000 wschodzących sadzonek może pozwolić na kilkukrotny wzrost populacji pigw z roku na rok.
prosiaki zwykle zaczynają kwitnąć i wyrzucać pyłek (antesis) około sześciu tygodni po pojawieniu się (WAE), chociaż kwiaty mogą pojawić się już w 3 WAE lub już w 9 WAE (Huang et al., 2000; Keeley, et al., 1987; Shrestha and Swanton, 2007). Kwiaty otwierają się około 1-2 tygodni po tym, jak pąki kwiatowe stają się widoczne gołym okiem.
Podane przedziały czasowe od zapylenia do utworzenia żywotnych nasion wahają się od 7-12 dni w waterhemp (Bell and Tranel , 2010) do 6 tygodni w populacjach polowych pigwowców redroot w Ontario (Shrestha and Swanton, 2007). W Kalifornii amarant Palmer uformował żywotne nasiona 2-6 tygodni po kwitnieniu (Keeley et al., 1987). Nasiona stają się żywotne mniej więcej w tym samym czasie, że rozwijają swój dojrzały ciemnobrązowy lub czarny kolor.
rozwój rozrodczy jest przyspieszony przez skrócenie długości dnia po przesileniu letnim w populacjach polowych (Keeley et al., 1987) i przebiega szybciej w krótkim (~12 godzin) niż w dłuższych (≥14 godzin) fotoperiodach w komorze wzrostu (Huang et al., 2000). Chociaż większość produkcji nasion występuje późnym latem i wczesną jesienią, niektóre dojrzałe nasiona zostały znalezione w gładkich główkach nasion pigw podczas przesilenia letniego w Wirginii (osobista obserwacja).
nie zbadano zdolności wykorzenionych lub odciętych w czasie kwitnienia roślin pigwowych do pełnego dojrzewania nasion. Jednak w północnej części stanu Nowy Jork, 2-4-calowe fragmenty kwiatostanów amarantusa Powella leżące na powierzchni gleby zostały znalezione zawierające czarne nasiona 3 tygodnie po tym, jak chwasty zostały zdekonspirowane podczas kwitnienia (Charles Mohler, Cornell University, pers. commun.). Najwyraźniej, jeśli zapylenie ma miejsce przed odciągnięciem lub posiekaniem prosiąt, istnieje pewien potencjał do żywotnej produkcji nasion.
nasiona Pigw są rozpraszane do nowych miejsc przez nawadnianie lub wodę powodziową, obornik i glebę przylegającą do obuwia, opon ciągnika lub narzędzi uprawowych. Ponadto pigweed aktywnie rozprasza nasiona, gdy dojrzałe rośliny odrywają się i poruszają się z wiatrem.
nasiona Pigw mają wiele mechanizmów uśpienia, tak że nasiona produkowane w danym sezonie kiełkują w różnych okresach w ciągu następnych kilku lat, zwiększając tym samym długotrwałą trwałość chwastów (Egley, 1986). Nowo wylane nasiona pigw są w większości uśpione i stają się mniej do następnej wiosny. Kiełkowanie jest promowane przez wysokie temperatury (95 ° F), zmienne temperatury (np. 85-95 ° f dzień, ~ 70 ° F noc), a czasami światło (Guo i Al-Khatib, 2003; Schonbeck and Egley, 1980 and 1981 Steckel et al., 2004).
Pigwowiec najchętniej wyłania się z górnej 0,5–1,0 cala profilu glebowego, z nielicznymi wyłaniającymi się z nasion położonych głębiej niż jeden cal (Mohler i Di Tommaso, niepublikowane). Nasiona wymagają odpowiedniej wilgoci i dobrego kontaktu nasiona z glebą, aby wchłonąć wilgoć i kiełkować. Głęboko zakopane nasiona pozostają uśpione i żywotne przez kilka lat, a kiełkują po wypłynięciu na powierzchnię przez uprawę lub uprawę. Chociaż uderzenia wschodów często następują po przygotowaniu przedsiewnym lub uprawie, rosnące problemy z pigwami w uprawach agronomicznych przypisano powszechnemu przyjęciu uprawy bez uprawy i minimalnej, które pozostawiają niedawno wyrzucone nasiona chwastów na powierzchni gleby lub w jej pobliżu(Sellers et al., 2003).
nawyk wzrostu i wpływ na uprawy
chlewy mają ścieżkę fotosyntetyczną C4, która nadaje zdolność do szybkiego wzrostu w wysokich temperaturach i wysokim poziomie światła, tolerowania suszy i agresywnej konkurencji z warzywami w sezonie ciepłym o światło, wilgoć i składniki odżywcze. Wzrost jest związany z kumulatywnym wzrostem stopnia dni, przy temperaturze bazowej 50 ° F (Shrestha i Swanton, 2007; Horak i Loughin, 2000); w ten sposób prosiaki rosną znacznie szybciej w gorącym klimacie niż w północnych regionach z chłodniejszym latem.
wyprostowane gatunki pigw mogą szybko obsypać krótkie uprawy, takie jak brokuły lub fasola snap. W wyższych uprawach, takich jak kukurydza, prosiaki reagują na cień baldachimu, zwiększając wzrost łodygi i umieszczając liście wyżej na roślinie, przechwytując w ten sposób większą część dostępnego światła (Massinga et al., 2003; McLachlan et al, 1993). Jedna do trzech roślin pigwowych na 10 stóp rzędu pojawiających się z kukurydzą lub soją może powodować znaczne straty plonów (Klingman and Oliver, 1994;Knezevic et al., 1994; Massinga et al., 2001) chlewy, które pojawiają się kilka tygodni po uprawie, wywierają znacznie mniejszy wpływ na plony.
Pigweeds są bardzo wrażliwe na składniki odżywcze, zwłaszcza azotanową formę azotu (N) (Blackshaw and Brandt, 2008; Teyker et al., 1991). Nawożenie zwiększa zarówno biomasę chwastów, jak i produkcję nasion. Ponadto azotan może stymulować kiełkowanie nasion pigw (Egley, 1986). Zaobserwowano, że ściółka resztek pożniwnych pokrywy roślin strączkowych zwiększa pojawienie się pigw w ciągu kilku lat(rys. 7), prawdopodobnie w wyniku szybkiej mineralizacji roślin strączkowych N (Teasdale and Mohler, 2000).

Rysunek 7. W tej próbie polowej flush pigweed konkuruje z brokułami posadzonymi no-till w zabitej hairy vetch (pierwszy plan), podczas gdy brokuły posadzone w zabitym żyta lub żyto–vetch są stosunkowo wolne od pigweed (tło). Szybka mineralizacja N z resztek roślin strączkowych najwyraźniej stymulowała kiełkowanie i wzrost pigw. Zdjęcie: Mark Schonbeck, Virginia Association for Biological Farming.
ponieważ małe nasiona mają minimalne rezerwy składników odżywczych, sadzonki pigw są początkowo bardziej zależne od łatwo dostępnych składników odżywczych z gleby, zwłaszcza fosforu (P) i potasu (K), niż rośliny o większych nasionach, takie jak kukurydza, fasola i Dyniowate (Hoveland et al., 1976; Mohler, 1996). Jednak w badaniach przeprowadzonych na glebach organicznych (obornika) na Florydzie gładkie pigwy i kolczasty amarantus były mniej wrażliwe niż sałata na poziom p, a zastosowanie pasmowego nawozu P poprawiło zdolność uprawy do konkurowania z tymi chwastami (Santos et al., 1997; Shrefler et al., 1994).
chlewy są nietolerancyjne cienia, a wzrost i reprodukcja osobników, które pojawiają się pod ciężkim baldachimem upraw, są znacznie ograniczone. Jednak szybkie wydłużenie łodygi pozwala prosiakom uniknąć cieniowania w wielu sytuacjach przycinania. Późne sezonowe prosiaki, które przebijają się przez ustalone Dyniowate, pomidory, pieprz i inne warzywa, mogą promować choroby roślin poprzez zmniejszenie cyrkulacji powietrza, zakłócać zbiory i ustawiać wiele tysięcy nasion (rys. 8).

Rysunek 8. Pigwowiec pojawił się kilka tygodni po sadzeniu squasha i nie wpłynął na plon. Jednak pod koniec zbiorów każdy chwast dojrzał tysiące nasion i dokona ciężkiego depozytu w banku nasion chwastów, chyba że zostaną natychmiast usunięte. Fotorelacja: Mark Schonbeck, Virginia Association for Biological Farming.
prosiaki są żywicielami nicieni szkodnikowych (Meloidogyne spp.) i wiele patogenów roślin warzywnych, w tym grzyby, które powodują wczesną zarazę w ziemniakach i pomidorach (Alternaria solani), kroplę sałaty (Sclerotinia sclerotiorum) i zarazę Południową (Sclerotium rolfsii) w szerokim zakresie upraw. Wirusowe patogeny, takie jak wirus mozaiki ogórka i wirus plamistego Wilta pomidora, mogą być również przenoszone z prosiąt (Mohler i DiTommaso, niepublikowane).
chlewy stały się przedmiotem działań w zakresie biokontroli z patogenami grzybiczymi i owadami żywiącymi się roślinami, chociaż rolnicy nie mają jeszcze żadnych produktów biokontroli. Amarantha Flea beetle (Disonycha glabrata) występuje w wielu Stanach Zjednoczonych (Tisler, 1990), żywi się liśćmi pigw (rys. 9), i może stać się znaczącym naturalnym wrogiem pigweed w niektórych obszarach, w tym w hrabstwie Floyd w Wirginii (osobista obserwacja). Zwykle jednak nie kontroluje chwastów, a od czasu do czasu żywi się niektórymi sadzonkami warzyw.

Rysunek 9. Amaranth Flea beetle żywi się liśćmi pigw i zaobserwowano, że powoduje znaczną defoliację i zmniejsza wigor chwastów w niektórych częściach Wirginii. Owad ten może okazjonalnie stać się szkodnikiem u buraków i boćwiny, żywiąc się sadzonkami. Zdjęcie: Mark Schonbeck, Virginia Association for Biological Farming.
Zarządzanie
Rolnicy Ekologiczni zarządzają trzodą chlewną, wykorzystując swoje słabe punkty. Małe nasiona mają minimalne zapasy składników odżywczych; tak więc sadzonki mogą wyłaniać się tylko z nasion znajdujących się w centymetrze od powierzchni gleby i są natychmiast zależne od gleby pod kątem łatwo dostępnych składników odżywczych. Przesadzone i duże uprawy mają znaczne rezerwy składników odżywczych i mogą uzyskać przewagę konkurencyjną nad sadzonkami pigw, jeśli zostaną wykorzystane wolno uwalniane źródła składników odżywczych.
delikatne sadzonki są łatwo zabijane przez zerwanie, wykorzenienie, zakopanie lub upał. Terminowe pielenie płomieniem lub uprawa za pomocą dowolnego z różnych narzędzi może wybić spłukiwanie sadzonek pigw. Pojawiające się pigwowce są również podatne na cieniowanie i fizyczne przeszkody przez ściółkę. Badanie terenowe w Beltsville w stanie Maryland dokumentuje większą wrażliwość pigw na tłumienie ściółką organiczną w stosunku do kilku innych chwastów pospolitych: Pigwowiec redroot > Baranek ćwiartka > gigantyczny foxtail > velvetleaf (Teasdale and Mohler, 2000).
ważne jest działanie w odpowiednim czasie, ponieważ prosiaki szybko stają się trudniejsze do zabicia, gdy urosną powyżej jednego cala i rozwiną cztery lub więcej prawdziwych liści (rys. 10). W chłodnym klimacie sadzonki pigw mogą pozostać podatne na uprawę do 4 WAE (Weaver i McWilliams, 1980); jednak w cieplejszym klimacie mogą rosnąć do 2-4 cali w ciągu 2 WAE (Sellers et al., 2003).

Rysunek 10. Sadzonka pigw po prawej stronie znajduje się na wrażliwym etapie, na którym może być łatwo zabita przez płytką uprawę lub płonącą lub zablokowana przez ściółkę. Kiedy pigwowce rosną tak duże, jak sadzonka po lewej stronie, staje się trudniejsze do zabicia, wymagając bardziej energicznej uprawy. Fotorelacja: Mark Schonbeck, Virginia Association for Biological Farming.
populacje Pigw łatwo dostosowują się do systemów produkcji i taktyki kontroli. Na przykład, reakcje kiełkowania nasion wykazują zmiany adaptacyjne do różnych płodozmianów (Brainard et al., 2007), a rozpowszechniona odporność na herbicydy odnotowano u kilku gatunków (Fugate, 2009; Volenberg et al., 2007). Tak więc, poleganie na jednym narzędziu zarządzania lub tej samej strategii rok po roku prawdopodobnie przyniesie malejące zyski w czasie.
stosowane w połączeniu praktyki opisane poniżej mogą zapewnić skuteczne zarządzanie pigwami w systemach organicznych.
uprawa i pielenie płomieniowe
regularnie monitoruj uprawy pod kątem pojawienia się chwastów. Uprawiaj, gdy chlewy znajdują się w stadium liścienia lub zanim osiągną jeden cal wysokości, pracując tak blisko rzędu upraw, jak to jest praktyczne. Gdy uprawa jest wystarczająco ustalona, Ustaw kultywatory, aby przesunąć cal lub tak gleby w rzędach, aby pochować małe chwasty. Powierzchniowa warstwa luźnej, suchej gleby pozostawionej przez uprawę (ściółka pyłowa) zapobiega dodatkowemu kiełkowaniu pigw. Należy unikać ponownego zagęszczania gleby, ponieważ zagęszczenie może sprzyjać ponownemu pojawieniu się gleby (rys. 11).

Rysunek 11 w wyniku uprawy wokół tych młodych roślin dyniowatych powstała ściółka kurzu, co zniechęcało do kiełkowania pigw i innych chwastów drobnoziarnistych. Jednak ruch pieszy zrekompaktował glebę na tyle, aby przywrócić kontakt nasion z glebą w pobliżu powierzchni, umożliwiając w ten sposób nasionom chwastów wchłanianie wilgoci, kiełkowanie i wzrost śladów. Fotorelacja: Mark Schonbeck, Virginia Association for Biological Farming.
pielenie płomieniowe może usunąć pigwy i inne sadzonki Liściaste tuż przed pojawieniem się plonu. Jest często używany do wolno rozpoczynających się upraw, takich jak marchew, buraki i pasternak. Ponieważ flaming zwykle nie zabija sadzonek chwastów traw, nie zaleca się tam, gdzie trawy stanowią znaczną część flory chwastów.
koszenie i wypas
gdy plon jest zbyt duży, aby uprawiać go przez ciągnik, rolnicy często kosić, ciąć lub ciągnąć chwasty w alejkach, aby utrzymać cyrkulację powietrza wokół plonu, ułatwić zbiory i zapobiec rozmnażaniu chwastów. Należy to zrobić przed otwarciem kwiatów pigw (w ciągu kilku dni po tym, jak główki kwiatów staną się widoczne), aby zapobiec tworzeniu się żywotnych nasion.
niektórzy rolnicy koszą alejki między szerokimi rzędami lub plastikowe ściółki za pomocą kosiarki pchanej lub trymera liniowego jako alternatywę dla uprawy. Dwa terminowe koszenie przed zamknięciem baldachimu dało odpowiednią kontrolę między rzędami olbrzymiego ogonka, prosiaków i ambrozji w soi posadzonej w 30-calowym odstępie między rzędami (Donald, 2000).
Większość prosiąt jest bardzo smaczna dla zwierząt gospodarskich. Jednak dojrzałe nasiona przechodzą przez przewody pokarmowe zwierząt bez szwanku,a obornik jest znanym źródłem nasion pigw. Tak więc pigwowce powinny być wypasane, gdy są jeszcze wegetatywne. Należy również zauważyć, że krajowy program Ekologiczny wymaga 120-dniowej przerwy między złożami obornika przez wypasane zwierzęta a kolejnymi zbiorami żywności.
ściółkowanie
ściółkowanie może być skuteczną taktyką kontrolną dla prosiąt w produkcji warzyw. Ekologiczna ściółka, taka jak 3-4 cale słomy lub siana (~5-10 ton/ac), stosowana w ciągu dnia po uprawie ustalonej uprawy, może zmniejszyć późniejsze pojawienie się pigw o 90%. Alternatywnie, syntetyczna ściółka, taka jak czarny plastik, może być układana przed sadzeniem roślin, a chwasty uliczne kontrolowane przez uprawę, koszenie, ekologiczną ściółkę lub uprawę okrywową. Uwaga: Jeśli do upraw ekologicznych stosuje się plastik lub inną ściółkę syntetyczną, należy ją usunąć z pola pod koniec zbioru lub sezonu wegetacyjnego.
Organiczne przesadzanie pomidorów i innych letnich warzyw na rolowane lub koszone rośliny okrywowe ozimych może kontrolować populacje pigw o lekkim lub umiarkowanym nasileniu. Pozostałości żyta uwalniają naturalne inhibitory wzrostu roślin (allelochemikalia), które hamują pigwy i inne roczne chwasty (Barnes and Putnam, 1983; Putnam et al., 1983) bez wpływu na przeszczepione warzywa.
Zarządzanie składnikami odżywczymi i wilgocią
używaj wolno uwalnianych źródeł n i innych składników odżywczych roślin uprawnych i unikaj stosowania materiałów o szybszym uwalnianiu, takich jak mączka z krwi i mączka kostna, które mogą dać pigwom skok na plon. Do ciężkich podajników, takich jak brokuły lub szpinak, które potrzebują szybkich materiałów N, band lub bocznych sukienek w obrębie lub w pobliżu rzędu upraw na początku szybkiego wzrostu plonów.
użyj nawadniania kroplowego rzędowego, aby dostarczyć wodę i płynny nawóz organiczny bezpośrednio do uprawy bez karmienia i podlewania chwastów między rzędami. Podpowierzchniowe Linie kroplujące mogą zapewnić wilgoć uprawie i pozostawić suchą powierzchnię gleby, minimalizując w ten sposób pojawianie się chwastów w obrębie rzędu.
płodozmian, harmonogramy sadzenia i stęchłe podłoże nasienne
planują płodozmian i planują operacje polowe, aby zakłócić cykle życia pigw. Unikaj tworzenia rok po roku otwartej niszy (gołej gleby) dla pojawienia się pigw późną wiosną do wczesnego lata. Naprzemiennie warzywa w ciepłym i chłodnym sezonie. Rozważ opóźnienie przygotowania przedsiewnego letniego warzywa do czasu szczytowego pojawienia się pigw. Po kilku latach intensywnej produkcji warzyw, obróć pole na wieloletnią darń (np. trawę sadowniczą-koniczynę czerwoną) na dwa lub trzy lata, aby zakłócić cykle życia pigw i zachęcić do drapieżnictwa nasion chwastów.
Jeśli populacje pigw są wysokie (rys. 12), przygotować nieświeżą podłoże nasienne późną wiosną, aby ściągnąć bank nasion chwastów. Uprawiaj lub uprawiaj, a następnie zwijaj lub kultywuj glebę, aby poprawić kontakt nasion z glebą, promując w ten sposób kiełkowanie chwastów. Posypać nawadniać, jeśli gleba jest sucha. W razie potrzeby powtórzyć uprawę. Tuż przed sadzeniem roślin lub pojawieniem się roślin, użyj płytkiej uprawy i pozostaw powierzchnię luźną, aby zniechęcić do dodatkowego kiełkowania chwastów. Końcowy kolor może być również zabity przez płomień, Jeśli chwasty trawy są nieliczne lub nie występują.

Rysunek 12. Dywan kolczastych sadzonek amarantusa powstaje z dużego banku nasion chwastów. Do opanowania tej sytuacji potrzebna jest Nieświeża gleba Siewna lub ugór uprawny. Zdjęcie: Mark Schonbeck, Virginia Association for Biological Farming.
Konkurs upraw i uprawa okładek
dzięki dobrej kontroli chwastów we wczesnym sezonie, energiczne uprawy, takie jak pomidor, słodki ziemniak i dynia zimowa, mogą tolerować później pojawiające się pigwy. Jednak konkurencja uprawowa może nie kontrolować prosiąt, ze względu na ich reakcję unikania cienia i zdolność do przebijania się przez baldachim uprawowy poprzez szybkie wydłużenie łodygi.
konkurencyjne letnie rośliny okrywowe, takie jak gryka, sorgo–sudangrass, cowpea i soja paszowa, są często używane do tłumienia chwastów między wiosennymi i jesiennymi uprawami warzyw. Na Florydzie, cowpea, sunnhemp lub velvetbean roślin okrywowych wysiewanych w wysokich tempie zmniejszone, ale nie wyeliminować gładki wzrost pigw (Collins et al., 2008).
w przypadku stosowania letnich roślin okrywowych do zwalczania chwastów, nasiona z dużą szybkością (1,5–2 razy w normie) i stosowanie dobrych metod siewu w celu uzyskania chwastów-supressive cover crop stand. Połącz krowę, soję paszową lub inne letnie rośliny strączkowe z wysoką trawą, taką jak proso perłowe lub sorgo–sudangrass, aby uzyskać wysoki i gęsty baldachim. Uważnie obserwuj uprawę; jeśli znaczna ilość pigw rośnie wraz z nią, natychmiast Zakończ uprawę, gdy pojawią się główki kwiatów chwastów.
Zarządzanie bankiem nasion Pigweed
ponieważ chlewy produkują nasiona tak prolificznie, ważne jest, aby zminimalizować roczny deszcz nasion na glebę. Chociaż rygorystyczna kontrola chwastów przez sześć lat może zmniejszyć bank nasion pigweed o 99%, relaksująca kontrola chwastów pozwala odzyskać liczbę nasion do poziomu zbliżonego do pierwotnego w ciągu trzech lat (Schweizer i Zimdahl, 1984). Pigwowce, które pojawiają się po minimalnym okresie wolnych od chwastów, nie mogą zmniejszać plonów, ale powinny być ciągnięte lub cięte przed kwitnieniem, aby zapobiec powstawaniu dojrzałych nasion.
opłaca się chodzić po polach dojrzewających roślin uprawnych w celu wyciągnięcia lub wycięcia dużych chwastów; małe, karłowate chlewy pod baldachimem roślin uprawnych tworzą tylko niewielką liczbę nasion. Jeśli główki kwiatowe są już uformowane, Usuń odcięte lub wyrwane pigwowce z pola. Jeśli pigwowce już utworzyły nasiona, zauważ, że wiele nasion pozostanie w głowie do zimy. Dlatego usuwanie chwastów wczesną jesienią może jeszcze znacznie zmniejszyć deszcz nasion pigw.
w przypadku wystąpienia silnego deszczu nasion pigw, niektórzy naukowcy od chwastów zalecają uprawę inwersyjną, aby przenieść nasiona na głębokość, z której nie mogą się wydostać (Mohler i Di Tommaso, niepublikowane). Chociaż 5-14% pigw redroot i nasion waterhemp przetrwało 9-12 lat pochówku na głębokości 8 cali w Nebrasce (Burnside et al., 1996), inni donoszą, że nasiona pigw są dość krótkotrwałe (3-4 lata) w glebie w bardziej wilgotnych regionach, takich jak Mississippi i Illinois (Buhler and Hartzler, 2001; Egley and Williams, 1990; Steckel et al., 2007). Doniesiono, że orka odkładowa zwiększa pojawienie się pigw, jeśli populacje chwastów są niskie, ale zmniejsza pojawienie się, jeśli populacje są wysokie w wyniku niedawnego deszczu nasion (Schweizer i Zimdahl, 1984).
w przypadku stosowania uprawy inwersyjnej do zarządzania ciężkim złożem nasion, odkładnica raz orze pole, a następnie uniknie głębokiej uprawy przez następne kilka lat, aby Zakopane nasiona straciły żywotność.
Ten artykuł jest częścią serii omawiającej inwazyjną rodzinę świniowatych. Aby uzyskać więcej informacji, zobacz następujące artykuły:
- profil chwastów: chlewy (Amaranthus spp.)
- Pigweed Redroot (Amaranthus retroflexus)
- Powell amarantus (Amaranthus powellii)
- kolczasty amarantus (Amaranthus spinosus)
- Palmer amarantus (Amaranthus palmeri)
- gładki Pigweed (Amaranthus hybridus)
- Tumble Pigweed (Amaranthus albus)
- prostrate pigweed (Amaranthus blitoides)
- Wodnik Zwyczajny (Amaranthus Rudis) i wodnik wysoki (A. Tuberculatus)
piśmiennictwo cytowane
- Barnes, J. P., and A. R. Putnam. 1983. Pozostałości żyta przyczyniają się do tłumienia chwastów w systemach uprawy bez uprawy. Journal of Chemical Ecology 9: 1045-1057. (Dostępne na stronie internetowej: http://dx.doi.org/10.1007) (zweryfikowane 10 września 2012).
- Bell, M. S. I P. J. Tranel. Wymaganie czasowe od zapylenia do dojrzałości nasion w oczku wodnym (Amaranthus tuberculatus). Weed Science 58: 167-173. (Dostępne na stronie: http://dx.doi.org/10.1614/WS-D-09-00049.1) (zweryfikowane 10 września 2012).
- Blackshaw, R. E., and R. N. Brandt. 2008. Wpływ nawozów azotowych na konkurencyjność chwastów jest zależny od gatunku. Weed Science 56: 743-747. (Dostępne na stronie: http://dx.doi.org/10.1614/WS-08-065.1) (zweryfikowane 10 września 2012).
- Brainard, D. C., A. DiTommaso i C. A. Mohler. 2007. Wewnątrzspecyficzne zróżnicowanie cech nasion amarantusa Powellii (Amaranthus powellii) z siedlisk o kontrastowych historiach płodozmianu. Weed Science 55: 218-226. (Dostępne na stronie internetowej: http://dx.doi.org/10.1614/WS-06-134.1) (zweryfikowane 10 września 2012).
- Buhler, D. D. and R. G. Hartzler. 2001. Pojawienie się i trwałość nasion aksamitki, płaszczki pospolitej, wełnistej trawy i olbrzymiego ogonka. Weed Science 49: 230-235. (Dostępne na stronie internetowej: http://dx.doi.org/10.1614/0043-1745(2001)049%5B0230:EAPOSO%5D2.0.CO; 2) (zweryfikowane 10 września 2012).
- Burnside, O. C., R. G. Wilson, S. Weisberg, and K. G. Hubbard. 1996. Długowieczność nasion 41 gatunków chwastów pochowanych 17 lat we wschodniej i zachodniej Nebrasce. Weed Science 44: 74-86. (Dostępne na stronie internetowej: http://www.jstor.org/stable/4045786) (zweryfikowane 10 września 2012).
- Collins, A. S., C. A. Chase, W. M. Stall i C. M. Hutchinson. 2008. Optymalne zagęszczenie trzech roślin strączkowych do tłumienia gładkich barwników (Amaranthus hybridus). Weed Science 56: 753-761. (Dostępne na stronie internetowej: http://dx.doi.org/10.1614/WS-07-101.1) (zweryfikowane 10 września 2012).
- Donald, W. W. 2000. Międzyrzędowe koszenie + pasmowy środek chwastobójczy stosowany do zwalczania chwastów w glicynie max. Weed Science 48: 487-500. (Dostępne na stronie internetowej: http://www.jstor.org/stable/4046280) (zweryfikowane 10 września 2012).
- Egley, G. H. 1986. Stymulacja kiełkowania nasion chwastów w glebie. Reviews of Weed Science 2: 67-89.
- Egley, G. H., and R. D. Williams. 1990. Spadek nasion chwastów i pojawienie się sadzonek w ciągu pięciu lat pod wpływem zaburzeń glebowych. Weed Science 38: 504-510. (Dostępne na stronie: http://www.jstor.org/stable/4045064) (zweryfikowane 10 września 2012).
- Fugate, L. 2009. Pigwowce zmuszające rolników do przemyślenia metod uprawy. University of Arkansas Division of Agriculture Cooperative Extension Service News-październik 2009.
- Guo, P., and K. Al-Khatib. 2003. Wpływ temperatury na kiełkowanie i wzrost pigweedu redroot (Amaranthus retroflexus), amarantus Palmeri (A. palmeri) i Wodnik Zwyczajny (A. rudis). Weed Science 51: 869-875. (Dostępne na stronie internetowej: http://dx.doi.org/10.1614/P2002-127) (zweryfikowane 10 września 2012).
- Horak, M. J., and T. M. Loughin. 2000. Analiza wzrostu czterech gatunków Amaranthus. Weed Science 48: 347-355. (Dostępny on-line pod adresem: http://dx.doi.org/10.1614/0043-1745(2000)048%5B0347:GAOFAS%5D2.0.CO; 2) (zweryfikowane 10 września 2012).
- Horak, M. J., D. E. Peterson, D. J. Chessman, and L. M. Wax. 1994. Pigweed identification: a Pictoral guide to the common pigweeds Of The Great Plains. 12 str. (Dostępne na stronie internetowej: http://www.ksre.ksu.edu/bookstore/pubs/S80.pdf) (zweryfikowane 6 sierpnia 2013).
- Hoveland, C. S., G. A. Buchanan, and M. C. Harris. 1976. Reakcja chwastów na fosfor i potas w glebie. Weed Science 24: 194-201. (Dostępne na stronie internetowej: http://www.jstor.org/stable/4042586) (zweryfikowane 10 września 2012).
- Huang, J. Z., A. Shrestha, M. Tollenar, W. Deen, H. Rahimian, and C. J. Swanton. 2000. Wpływ fotoperiodu na rozwój fenologiczny Pigwowca rdzawego (Amaranthus retroflexus L.). Canadian Journal of Plant Science 80: 929-938.
- Keeley, P. E., C. H. Carter, and R. J. Thullen. 1987. Wpływ daty sadzenia na wzrost amarantusa palmowego (Amaranthus palmeri). Weed Science 35: 199-204. (Dostępne na stronie: http://www.jstor.org/stable/4044391) (zweryfikowane 10 września 2012).
- Klingman, T. E., and L. R. Oliver. 1994. Amarant Palmer (Amaranthus palmeri) – mieszanka soi (Glycine max). Weed Science 42: 523-527. (Dostępne na stronie internetowej: ) (zweryfikowane 10 września 2012).
- Knezevic, S. Z., S. F. Weise i C. J. Swanton. 1994. Interferencja barwników redroot (Amaranthus retroflexus) w kukurydzy (Zea mays). Weed Science 42: 568-573. (Dostępne na stronie internetowej: http://www.jstor.org/stable/4045456) (zweryfikowane 10 września 2012).
- Massinga, R. A., R. S. Currie, M. J. Horak, and J. Boyer, Jr. 2001. Ingerencja Palmer amaranth w kukurydzę. Weed Science 49: 202-208. (Dostępne na stronie internetowej: http://dx.doi.org/10.1614/0043-1745(2001)049%5B0202:IOPAIC%5D2.0.CO; 2) (zweryfikowane 10 września 2012).
- Massinga, R. A., R. S. Currie i T. P. Trooien. 2003. Wykorzystanie wody i przechwytywanie światła pod amarantus Palmeri (Amaranthus palmeri) i konkurencja kukurydzy. Weed Science 51: 523-531. (Dostępne online pod adresem: http://dx.doi.org/10.1614/0043-1745(2003)051%5B0523:WUALIU%5D2.0.CO; 2) (zweryfikowane 10 września 2012).
- McLachlan, S. M., M. Tollenaar, C. J. Swanton, and S. F. Weise. 1993. Wpływ cieniowania wywołanego kukurydzą na gromadzenie, dystrybucję i architekturę suchej masy Pigwowca czerwonego (Amaranthus retroflexus). Weed Science 41: 568-573. (Dostępne na stronie: http://www.jstor.org/stable/4045424) (zweryfikowane 10 września 2012).
- Mohler, C. A. 1996. Ekologiczne podstawy kontroli kulturowej rocznych chwastów. Journal of Production Agriculture 9: 468-474..
- Mohler, C. A., and A. DiTommaso. Niepublikowane. Zarządzaj chwastami w gospodarstwie: Przewodnik po strategiach ekologicznych. Department of Crop and Soil Sciences, Cornell University. Wstępny projekt publikacji, Wersja 5.1. Publikacja przewidywana na 2012 rok.
- Pratt, D. B., and L. G. Clark. 2001. Amaranthus rudis i A. tuberculatus – jeden gatunek czy dwa? Journal of the Torrey Botanical Society 128: 282-296. (Dostępny on-line pod adresem: http://www.jstor.org/stable/3088718) (zweryfikowano 10.09.2012).
- Putnam, A. R., J. DeFrank, and J. P. Barnes. 1983. Wykorzystanie allelopatii do zwalczania chwastów w systemach uprawy rocznej i wieloletniej. Journal of Chemical Ecology 9: 1001-1010. (Dostępne na stronie: http://dx.doi.org/10.1007) (zweryfikowane 10 września 2012).
- Santos, B. M., J. A. Dusky, D. G. shilling, W. M. Stall, and T. A. Bewick. 1997. Wpływ żyzności fosforu na konkurencyjne interakcje gładkich pigw (Amaranthus hubridus), amarantusa (Amaranthus spinosus) i portulaki pospolitej (Portulaca oleracea) z sałatą. Weed Science Society of America Abstracts 37: 54.
- Schonbeck, M. W., and G. H. Egley. 1980 pigweed Redroot (Amaranthus retroflexus) reakcja kiełkowania nasion na po dojrzewaniu, temperaturę, etylen i niektóre inne czynniki środowiskowe. Weed Science 28: 543-548. (Dostępne na stronie: http://www.jstor.org/stable/4043277) (zweryfikowane 10 września 2012).
- Schonbeck, M. W., and G. H. Egley. 1981. Zmiany w wrażliwości nasion Amaranthus retroflexus L. na etylen podczas preinkubacji. II. skutki zmiany temperatury i pochówku w glebie. Plant, Cell, and Environment 4: 237-242. (Dostępne na stronie internetowej: http://dx.doi.org/10.1111/1365-3040.ep11611005) (zweryfikowane 10 września 2012).
- Schweizer, E. E., and R. L. Zimdahl. 1984. Spadek nasion chwastów w nawadnianej glebie po sześciu latach ciągłego stosowania kukurydzy (Zea mays) i herbicydów. Weed Science 32: 76-83. (Dostępne na stronie: http://www.jstor.org/stable/4043886) (zweryfikowane 10 września 2012).
- Sellers, B. A., R. J. Smeda, W. G. Johnson, J. A. Kendig, and M. R. Ellersieck. 2003. Wzrost porównawczy sześciu gatunków Amaranthus w Missouri. Weed Science 51: 329-333. (Dostępne online pod adresem: http://dx.doi.org/10.1614/0043-1745(2003)051%5B0329:CGOSAS%5D2.0.CO; 2) (zweryfikowane 10 września 2012).
- Shrefler, J. W., J. A. Dusky, D. G. Shilling, B. J. Brecke, and C. A. Sanchez. 1994. Wpływ płodności fosforu na konkurencję między sałatą (Lactuca sativa) i amarantusem kolczastym (Amaranthus spinosus). Weed Science 42: 556-560. (Dostępne na stronie internetowej: http://www.jstor.org/stable/4045454) (zweryfikowane 10 września 2012).
- Shrestha, A., and C. J. Swanton. 2007. Parametryzacja rozwoju fenologicznego wybranych chwastów rocznych w warunkach polowych niekoronowanych. Weed Science 55: 446-454. (Dostępne na stronie internetowej: http://dx.doi.org/10.1614/WS-06-176.1) (zweryfikowane 10 września 2012).
- Steckel, L. E., C. L. Sprague, E. W. Stoller, and L. M. Wax. 2004. Wpływ temperatury na kiełkowanie dziewięciu gatunków Amaranthus. Weed Science 52: 217-221. (Dostępne na stronie internetowej: http://dx.doi.org/10.1614/WS-03-012R) (zweryfikowane 10 września 2012).
- Steckel, L. E., C. L. Sprague, E. W. Stoller, L. M. Wax, and F. W. Simmons. 2007. Uprawa, system uprawy i wpływ głębokości gleby na trwałość banku nasion Szarłatowca (Amaranthus rudis). Weed Science 55: 235-239. (Dostępne na stronie: http://dx.doi.org/10.1614/WS-06-198) (zweryfikowane 10 września 2012).
- Teasdale, J. R., and C. L. Mohler. 2000. Ilościowy związek między pojawieniem się chwastów a fizycznymi właściwościami ściółki. Weed Science 48: 385-392. (Dostępne online pod adresem: http://dx.doi.org/10.1614/0043-1745(2000)048%5B0385:TQRBWE%5D2.0.CO; 2) (zweryfikowane 10 września 2012).
- Teyker, R. H., H. D. Hoelzer, and R. A. Liebl. 1991. Kukurydza i pigwowce reagują na dostarczanie i formowanie azotu. Plant and Soil 135: 287-292. (Dostępne na stronie: http://dx.doi.org/10.1007) (zweryfikowane 10 września 2012).
- Tisler, A. M. 1990. Żywi się chrząszczami chlewnymi, Disonycha glabrata Fab. (Coleoptera: Chrysomelidae), na Amaranthus retroflexus. Virginia Journal of Science 41: 243-245.
- Volenberg, D. S., W. L. Patzoldt, A. G. Hager, and P. J. Tranel. 2007. Odpowiedzi współczesnych i historycznych akcesji waterhemp (Amaranthus tuberculatus) do glifosatu. Weed Science 55: 327-333. (Dostępny on-line pod adresem: http://dx.doi.org/10.1614/WS-06-121) (zweryfikowano 10 września 2012).
- Weaver, S. E., and E. L. McWilliams. 1980. Biologia Kanadyjskich chwastów. 44. Amaranthus retroflexus L, A. powellii S. Wats and A. hybridus L. Canadian Journal of Plant Science 60: 1215-1234.
- Webster, T. M. 2006. Weed survey-południowe stany. Podsekcja uprawy warzyw, owoców i orzechów. Proceedings of the Southern Weed Science Society 59: 260-277. (Dostępne na stronie internetowej: http://www.swss.ws/wp-content/uploads/docs/Southern%20Weed%20Survey%202006%20Vegetables%20and%20Fruits.pdf) (zweryfikowane 10 września 2012).