- Isopropylalkohol Chemische Eigenschaften, Verwendung, Herstellung
- Beschreibung
- Herstellungsprozess
- Verwendung
- Toxizität
- Begrenzte Verwendung
- Chemische Eigenschaften
- Vorkommen
- Verwendung
- Verwendung
- Verwendet
- Verwendungen
- Verwendungen
- Begriffsbestimmung
- Herstellungsverfahren
- Herstellungsverfahren
- Aromaschwellenwerte
- Allgemeine Beschreibung
- Luft & Wasserreaktionen
- Reaktivitätsprofil
- Gefahr
- Gesundheitsgefahr
- Brandgefahr
- Chemische Reaktivität
- Pharmazeutische Anwendungen
- Sicherheit
- Chemische Synthese
- Karzinogenität
- Lagerung
- Reinigungsmethoden
- Unverträglichkeiten
- Vorsichtsmaßnahmen
- Regulatorischer Status
Isopropylalkohol Chemische Eigenschaften, Verwendung, Herstellung
Beschreibung
Isopropanol ist auch als Isopropylalkohol bekannt. Es ist der einfachste sekundäre Alkohol und gehört zu den Isomeren von n-Propanol. Es ist eine Art brennbare Flüssigkeit, die farblos ist und einen starken Geruch aufweist, der dem Geruch der Mischung aus Ethanol und Aceton ähnelt. Es ist in Wasser, Alkohol, Ether, Benzol, Chloroform und den meisten organischen Lösungsmitteln löslich und mit Wasser, Alkohol, Ether mischbar und kann mit Wasser Azeotrop bilden. Dichte (spezifisches Gewicht): 0.7863g/cm3, schmelzpunkt:-88,5 ℃, siedepunkt: 82,5 ℃, flammpunkt: 11,7 ℃, zündpunkt: 460 ℃, brechungsindex: 1,3772. Sein Dampf kann leichte Reizungen an Augen, Nase und Rachen verursachen und über die Haut aufgenommen werden. Sein Dampf kann eine explosive Mischung mit Luft bilden. Seine Explosionsgrenze beträgt 2,0% bis 12% (nach Volumen). Es gehört zu einem mäßig explosiven Gefahrstoff und einer brennbaren, wenig toxischen Substanz. Die Toxizität seiner Dämpfe ist doppelt so hoch wie bei Ethanol, während die orale Verabreichung die gegenteilige Toxizität verursacht.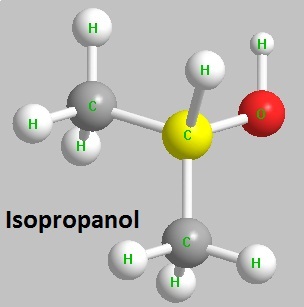
Abbildung 1 ist die Strukturformel von Isopropanol.
In vielen Fällen kann Isopropanol Ethanol als Lösungsmittel ersetzen und ist ein gutes Lösungsmittel und chemische Rohstoffe, die nicht nur auf Malerei, Pharmazeutika, Pestizide, Kosmetika und andere Industrien angewendet werden können, sondern auch die Herstellung von Aceton, Isopropylester, Isopropylamin (der Rohstoff für die Herstellung von Atrazin), Di-Isopropylether, Isopropylacetat und Thymol usw. Es war das erste Produkt, das aus dem Erdölrohstoff in der Geschichte der Entwicklung der Petrochemie hergestellt wird.
Herstellungsprozess
Im Jahr 1855 berichtete der Franzose M. Berthelot erstmals über die Herstellung von Isopropanol durch die Hydratationsreaktion zwischen Propylen und Schwefelsäure, die als indirekte Hydratation bezeichnet wird. Im Jahr 1919 hatten die Amerikaner C. Ellis industrielle Entwicklung auf diesem durchgeführt. Ende 1920 übernahm die American Standard Oil Company aus New Jersey den Ansatz von Ellis Act und etablierte die Produktionsausrüstung für die formale Produktion. Im Jahr 1951 begann die britische Firma Imperial Chemical Industries mit der Herstellung von Isopropanol mit der direkten Hydratationsmethode aus Propylen. Seitdem haben viele Länder diese Methode angewendet und damit verbundene Verbesserungen vorgenommen.
Indirekte Hydratationsreaktion: Propylen wird zuerst mit Schwefelsäure umgesetzt, um Isopropylhydrogensulfat zu erhalten, das nach der Hydrolyse Isopropanol erzeugt, und die Reaktion der Formel:
CH3CH = CH2 + H2SO4 → (CH3) 2CHOSO3H
(CH3) 2CHOSO3H + H2O4 → (CH3) 2CHOH + H2SO4
Die Konzentration der aufgebrachten Schwefelsäure ist im Allgemeinen größer als 60% (nach Masse), und die Reaktion wird bei 2 ~ 2,8 MPa und 60 ~ 65 ° C durchgeführt; Die Hydrolysereaktion erfolgt bei leicht erhöhtem Druck und unter 30 ° C.
Direkte Hydratation: Propylen hat direkt Hydratationsreaktion mit Wasser in Gegenwart eines Katalysators beim Erhitzen und erhöhtem Druck, um Isopropanol mit einer Selektivität von 96% zu erzeugen. Reaktion ist: CH3CH = CH2 + H2O → (CH3) 2CHOH; der verwendete Katalysator enthält Wolframverbindung, Phosphat und Ionenaustauscherharz; Der üblicherweise verwendete Katalysator ist Phosphorsäurekatalysator mit Träger (siehe Festsäurekatalysator) mit Bedingungen von 2 ~ 6Mpa, 240 ~ 260 ° C. Im Vergleich zur indirekten Methode hat diese Methode kein Problem in Bezug auf Schwefelsäurekorrosion und verdünnte Säurekonzentration und ist daher in der industriellen Produktion dominant.
Die obigen Informationen werden vom Chemicalbook von Dai Xiongfeng bearbeitet.
Verwendung
Isopropylalkohol ist ein wichtiges chemisches Produkt und Rohstoff. Es wird hauptsächlich auf verschiedenen Gebieten einschließlich pharmazeutisch, Kosmetik, Plastik, Düfte, Farbe sowie verwendet als das Entwässerungsmittel und Reinigungsmittel in und Elektronikindustrie angewendet. Es kann auch als Reagenz zur Bestimmung von Barium, Calcium, Magnesium, Nickel, Kalium, Natrium und Strontium verwendet werden. Es kann auch als Referenzmaterial für die chromatographische Analyse verwendet werden.
In der Fertigungsindustrie von Leiterplatten, wird es als Reinigungsmittel verwendet, und die Herstellung von Leiterplattenlöchern für die Leitfähigkeit. Viele Leute finden, dass es nicht nur das Motherboard mit ausgezeichneter Leistung reinigen kann, sondern auch die besten Ergebnisse erzielt. Zusätzlich, es ist verwendet für andere elektronische geräte, einschließlich reinigung disc patrone, diskettenlaufwerke, magnetband, und die laser spitze der disc fahrer von CD oder DVD-player.
Isopropylalkohol kann auch als Lösungsmittel für Öl und Gel sowie zur Herstellung von Fischmehlfutterkonzentrat verwendet werden. Minderwertiges Isopropanol kann auch in Kraftstoffen verwendet werden. Als Rohstoff für die Herstellung von Aceton verringert sich die Verwendungsmenge an Isopropanol. Es gibt mehrere Verbindungen, die aus Isopropanol synthetisiert werden, wie Isopropylester, Methylisobutylketon, Diisopropylamin, Diisopropylether, Isopropylacetat, Thymol und viele Arten von Estern. Wir können Isopropanol von unterschiedlicher Qualität liefern, abhängig von der Endverwendung. Die herkömmliche Qualität von wasserfreiem Isopropanol beträgt mehr als 99%, während der spezielle Isopropanolgehalt höher als 99,8% ist (für Aromen und Arzneimittel).
Toxizität
Der ADI-Wert ist nicht angegeben (FAO/WHO, 2001).
LD5050: 45 mg/kg (Ratte, oral).
Begrenzte Verwendung
FEMA (mg/kg): alkoholfreie Getränke: 25; Süßigkeiten: 10 bis 75; Backware: 75.
Chemische Eigenschaften
Isopropylalkohol ist eine klare, farblose, bewegliche, flüchtige, brennbare Flüssigkeit mit einem charakteristischen, alkoholischen Geruch, der dem einer Mischung aus Ethanol und Aceton ähnelt; es hat eine leicht bittere taste.It ist mit Wasser, Ethylether und Ethylalkohol mischbar. Isopropylalkohol ist nicht kompatibel mit starken Oxidationsmitteln, Acetaldehyd, Chlor, Ethylenoxid, Säuren und Isocyanaten.
Vorkommen
Wird in Apfel- und Cognacaromen (verestert) gefunden. Auch in Apfel, Banane, Grapefruit und Limette gefundensaft, Melone, Papaya, Birne, Zwiebel, Erbsen, Steckrübe, Tomate, Weizenbrot, Käse, Milch, gekochtes Ei, gekochtes Rindfleisch, Schweinefleisch und Hammelfleisch, Hopfen, Bier, Rum, Kakao, Kaffee, Scotch Whisky, Traubenweine, Erdnuss, Pekannuss, Soja, Honig, Bohnen, Pflaumenschnaps, Walnuss, Krabbe, Muschel,Kaktusfeige und Muskatellersalbei.
Verwendung
Isopropylalkohol wird bei der Herstellung von Aceton, Isopropylhalogeniden, Glycerin und Aluminiumisopropoxid verwendet; weit verbreitet als industrielles Lösungsmittel für Farben, Polituren und Insektizide; als Antiseptikum (Reinigungsalkohol); und in der organischen Synthese zur Einführung der Isopropyl- oder Isopropoxygruppe in das Molekül. Als übliches Laborlösungsmittel wie Methanol sind die Expositionsrisiken immer hoch; Seine Toxizität ist jedoch vergleichsweise gering.
Verwendung
Isopropylalkohol ist Träger, antibakteriell und Lösungsmittel für Hautpflegelotionen. Isopropylalkohol wird aus Propylen, einem Erdölderivat, hergestellt.
Verwendet
Im Vergleich zu Ethanol wird 50% weniger für die Nukleinsäurefällung benötigt, wodurch das Gesamtvolumen minimiert wird, das für die DNA- oder RNA-Rückgewinnung zentrifugiert werden muss.
Verwendungen
Geeignet für HPLC, Spektrophotometrie, Umweltprüfung
Verwendungen
In Frostschutzzusammensetzungen; als Lösungsmittel für Zahnfleisch, Schellack, ätherische Öle; bei der Extraktion von Alkaloiden; in schnell trocknenden Ölen; in schnell trocknenden Tinten; in denaturierendem Ethylalkohol; in Körpermassagen; Handlotionen, After-Shave-Lotionen und ähnlichen Kosmetika. Lösungsmittel für Kreosot, Harze, Gummis; bei der Herstellung von Aceton, Glycerin, Isopropylacetat. Pharmazeutisches Hilfsmittel (Lösungsmittel).
Begriffsbestimmung
Tschebi: Ein sekundärer Alkohol, der Propan ist, in dem eines der an den zentralen Kohlenstoff gebundenen Wasserstoffatome durch eine Hydroxygruppe substituiert ist.
Herstellungsverfahren
Isopropylalkohol kann aus Propylen hergestellt werden; durch katalytische Reduktion von Aceton oder durch Fermentation bestimmter Kohlenhydrate.
Herstellungsverfahren
Zwei grundlegende Herstellungsverfahren werden kommerziell verwendet: (1) Absorption von Propylen in Schwefelsäure unter Bildung von Alkylhydrogensulfat, gefolgt von der Hydrolyse des Esters; und (2) durch direkte Hydratation mit Wasser unter Verwendung eines Katalysators. Ein inhärenter Nachteil des ersten Verfahrens ist die Notwendigkeit, Schwefelsäure zu handhaben. Ferner liefert das erste Verfahren wenig mehr als 70% Isopropanol im Vergleich zum zweiten Verfahren, bei dem flüssiges Propylen als Einsatzstoff verwendet wird. Alle Direkthydratationsprozesse können dargestellt werden durch: C3H6 + H2O ??→ C3H7OH + Hitze.
Aromaschwellenwerte
Nachweis: 40 bis 601 ppm
Allgemeine Beschreibung
Flüchtige, farblose Flüssigkeit mit einem scharfen muffigen Geruch wie Alkohol. Flammpunkt von 53 ° F. Dämpfe sind schwerer als Luft und leicht reizend für Augen, Nase und Rachen. Dichte ungefähr 6.5 lb / gal. Verwendet bei der Herstellung von Kosmetika, Haut- und Haarpräparaten, Pharmazeutika, Parfums, Lackformulierungen, Farbstofflösungen, Frostschutzmitteln, Seifen, Fensterreinigern. Verkauft in 70% wässriger Lösung als Reinigungsalkohol.
Luft & Wasserreaktionen
Leicht entzündlich. Wasserlöslich.
Reaktivitätsprofil
Isopropanol reagiert mit Luft oder Sauerstoff zu gefährlich instabilen Peroxiden. Kontakt mit 2-Butanon erhöht die Geschwindigkeit der Peroxidbildung. An explosive reaction occurs when Isopropanol is heated with (aluminum isopropoxide + crotonaldehyde). Forms explosive mixtures with trinitromethane and hydrogen peroxide. Reacts with barium perchlorate to form a highly explosive compound. Ignites on contact with dioxygenyl tetrafluoroborate, chromium trioxide and potassium-tert-butoxide. Vigorous reactions occur with (hydrogen + palladium), nitroform, oleum, COCl2, aluminum triisopropoxide and oxidizing agents. Reacts explosively with phosgene in the presence of iron salts. Incompatible with acids, acid anhydrides, halogens and aluminum . Isopropanol kann mit PCL3 reagieren und giftiges HCl-Gas bilden. (Logsdon, John E., Richard A. Loke., Sopropylalkohol. Kirk-Othmer Enzyklopädie der chemischen Technologie. John Wiley & Sons, Inc. 1996.).
Gefahr
Brennbar, gefährliche Brandgefahr, explosivgrenzen in der Luft 2-12%. Giftig durch Verschlucken und Einatmen. Augen- und obere Atemwege reizend, Zentralnervensystembeeinträchtigung. Fragwürdiges Karzinogen.
Gesundheitsgefahr
Exposition gegenüber Isopropylalkohol verursacht Reizungen der Augen und Schleimhäute. Die Exposition gegenüber Isopropylalkohol für 3-5 min (400 ppm) verursachte eine leichte Reizung der Augen, Nase und Rachen, und bei 800 ppm wurden diese Symptome schwerwiegend. Die Einnahme oder eine orale Dosis von 25 ml in 100 ml Wasser führte zu Hypotonie, Gesichtsausschlag, Bradykardie und Schwindel. Die Einnahme in großen Mengen verursachte eine ausgedehnte hämorrhagische Tracheobronchitis, Bronchopneumonie und ein hämorrhagisches Lungenödem. Längerer Hautkontakt mit Isopropylalkohol verursachte Ekzeme und Empfindlichkeit. Eine verzögerte dermale Resorption wird auf eine Reihe von pädiatrischen Vergiftungen zurückgeführt, die nach wiederholtem oder längerem Schwammbaden mit Isopropylalkohol zur Fiebersenkung aufgetreten sind. In mehreren Fällen, Symptome waren Atemnot, Stupor, und Koma. Labortiere, die Isopropylalkohol ausgesetzt sind, entwickeln eine Vergiftung mit Symptomen einer Hinterbeinlähmung, Unstetigkeit, mangelnder Muskelkoordination, Atemdepression und Benommenheit. Isopropylalkohol ist ein starkes ZNS-Depressivum und verursacht in großen Dosen kardiovaskuläre Depressionen.
Brandgefahr
LEICHT ENTZÜNDLICH: Wird leicht durch Hitze, Funken oder Flammen entzündet. Dämpfe können mit Luft explosive Gemische bilden. Dämpfe können zur Zündquelle wandern und zurückblitzen. Die meisten Dämpfe sind schwerer als Luft. Sie breiten sich am Boden aus und sammeln sich in niedrigen oder engen Bereichen (Abwasserkanäle, Keller, Tanks). Dampfexplosionsgefahr in Innenräumen, im Freien oder in der Kanalisation. Abfluss in den Abwasserkanal kann zu Brand- oder Explosionsgefahr führen. Behälter können beim Erhitzen explodieren. Viele Flüssigkeiten sind leichter als Wasser.
Chemische Reaktivität
Reaktivität mit Wasser Keine Reaktion; Reaktivität mit gängigen Materialien: Keine Reaktionen; Transportstabilität: Stabil; Neutralisationsmittel für Säuren und Laugen: Nicht relevant; Polymerisation: Nicht relevant; Inhibitor der Polymerisation: Nicht relevant.
Pharmazeutische Anwendungen
Isopropylalkohol (Propan-2-ol) wird in kosmetischen und pharmazeutischen Formulierungen hauptsächlich als Lösungsmittel in topischen Formulierungen verwendet.(Es wird wegen seiner Toxizität nicht zur oralen Anwendung empfohlen.
Obwohl es in Lotionen verwendet wird, können die ausgeprägten Entfettungseigenschaften von Isopropylalkohol seine Nützlichkeit in Zubereitungen, die wiederholt verwendet werden, einschränken. Isopropylalkohol wird auch als Lösungsmittel sowohl für die Tablettenbeschichtung als auch für die Tablettengranulation verwendet, wobei der Isopropylalkohol anschließend durch Verdampfen entfernt wird. Es wurde auch gezeigt, dass es die Hautpermeabilität von Nimesulid aus Carbomer 934 signifikant erhöht.Isopropylalkohol hat eine gewisse antimikrobielle Aktivität und eine 70% ige wässrige v / v-Lösung wird als topisches Desinfektionsmittel verwendet.Therapeutisch wurde Isopropylalkohol zur Behandlung von postoperativer Übelkeit oder Erbrechen untersucht.
Sicherheit
Isopropylalkohol ist weit verbreitet in Kosmetika und topischenpharmazeutische Formulierungen. Es wird leicht aus dem Magen-Darm-Trakt resorbiert und kann langsam durch intakte Haut resorbiert werden. Längerer direkter Kontakt von Isopropylalkohol mit der Haut kannzu kardialen und neurologischen Defiziten führen. Bei Neugeborenen wurde berichtet, dass Isopropylalkohol nach topischer Anwendung Verätzungen verursacht.Isopropylalkohol wird langsamer metabolisiert als Ethanol,hauptsächlich zu Aceton. Metaboliten und unveränderter Isopropylalkoholwerden hauptsächlich im Urin ausgeschieden.
Isopropylalkohol ist etwa doppelt so giftig wie Ethanol und shouldtherefore nicht oral verabreicht werden; isopropylalkohol hat auch anunangenehmer Geschmack. Die Symptome der Isopropylalkoholtoxizität sind denen für Ethanol ähnlich, mit der Ausnahme, dass Isopropylalkohol keine anfängliche euphorische Wirkung hat und Gastritis und Erbrechen stärker ausgeprägt sind. Delta-Osmolalität kann als Schnelltest nützlich sein, um Patienten zu identifizieren, bei denen das Risiko von Komplikationen durch die Einnahme von Isopropylalkohol besteht. Die tödliche orale Dosis wird auf etwa 120-250 ml geschätzt, obwohl toxische Symptome durch 20 ml erzeugt werden können.
Nebenwirkungen nach parenteraler Verabreichung von bis zu 20 ml mit Wasser verdünntem Isopropylalkohol waren nur eine Hitzeempfindung und eine leichte Blutdrucksenkung. Isopropylalkohol wird jedoch häufig nicht in parenteralen Produkten verwendet.Obwohl Inhalation Reizungen und Koma verursachen kann, wurde die Inhalation von Isopropylalkohol in therapeutischen Anwendungen untersucht.Isopropylalkohol wird am häufigsten in topischen pharmazeutischen Formulierungen verwendet, wo es als lokales Reizmittel wirken kann. Bei Anwendung auf das Auge kann es zu Hornhautverbrennungen und Augenschäden kommen.
LD50 (Hund, oral): 4,80 g/kg
LD50 (maus, oral): 3,6 g/kg
LD50 (maus, IP): 4,48g/kg
LD50 (maus, IV): 1,51 g/kg
LD50 (kaninchen, oral): 6,41 g/kg
LD50 (kaninchen, haut): 12,8 g/kg
LD50 (ratte, IP): 2,74 g/kg
LD50 (Ratte, oral): 1,09 g/kg
LD50 (Ratte, oral): 5,05 g/kg
Chemische Synthese
Synthetisch hergestellt aus Acetylen oder Propylen.
Karzinogenität
CD-1-Mäuse wurden 18 Monate lang durch Inhalation 0, 500, 2500 oder 5000 ppm Isopropanoldampf für 6 h/Tag, 5 Tage/Woche ausgesetzt. Eine zusätzliche Gruppe von MICE (alle Expositionsniveaus) wurde einer Wiederherstellungsgruppe zugeordnet, die 12 Monate lang Isopropanol ausgesetzt und dann bis zum Studienabbruch nach 18 Monaten beibehalten wurde. Bei keinem der mit Isopropanol exponierten Tiere trat eine erhöhte Häufigkeit neoplastischer Läsionen auf. Nicht-neoplastische Läsionen warenbeschränkt auf die Hoden (Männer) und die Niere. In den Hoden trat eine Vergrößerung der Samenbläschen in Abwesenheit aufvon damit verbundenen entzündlichen oder degenerativen Veränderungen. Die Nebenwirkungen umfassten tubuläre Proteinose und / oder Tubulardilatation. Die Inzidenz von Hoden- und Niereneffekten war bei den Isopropanol-exponierten Tieren nicht erhöht.
Lagerung
Isopropylalkohol sollte an einem kühlen, trockenen und gut belüfteten Ort in dicht verschlossenen Behältern mit einem geeigneten Etikett gelagert werden. Außen- oder freistehende Lagerung ist vorzuziehen. Innerhalb der Lagerung sollte ein Lagerraum für brennbare Flüssigkeiten oder ein Schrank sein. Arbeiter sollten Isopropylalkohol nicht über 37 ° C (100 ° F) lagern. Behälter mit Isopropylalkohol sollten vor physischen Schäden und Kontakt mit Luft geschützt und getrennt von starken Oxidationsmitteln, Acetaldehyd, Chlor, Ethylenoxid, Säuren und Isocyanaten gelagert werden. Isopropylalkohol sollte so schnell wie möglich in kühlen Behältern zum nächsten Labor transportiert werden.
Reinigungsmethoden
Isopropylalkohol wird kommerziell durch Lösen von Propen in H2SO4 und anschließende Hydrolyse des Sulfatesters hergestellt. Hauptverunreinigungen sind Wasser, niedere Alkohole und Oxidationsprodukte wie Aldehyde und Ketone. Die Reinigung von Isopropanol erfolgt im Wesentlichen wie bei n-Propylalkohol. Isopropanol bildet mit Wasser ein konstant siedendes Gemisch, b 80,3o. Das meiste Wasser kann aus diesem 91% igen Isopropanol durch mehrstündiges Rückfluxen mit CaO (200 g/l) entfernt und anschließend destilliert werden. Das Destillat kann mit CaH2, Magnesiumoxid, BaO, CaSO4, Calcium, wasserfreiem CuSO4 oder Linde Typ 5A Molekularsieben weiter getrocknet werden. Die Destillation aus Sulfanilsäure entfernt Ammoniak und andere basische Verunreinigungen. Peroxide können durch Rückfluss mit festem Zinnchlorid oder mit NABH 4 entfernt werden, dann wird der Alkohol fraktioniert destilliert. Um Isopropanol zu erhalten, das nur 0,002 M Wasser enthält, wird Natrium (8 g / L) in durch Destillation aus CaSO4 getrocknetem Material gelöst. Dann wird Isopropylbenzoat (35 ml) zugegeben und nach 3 Stunden Rückfluß der Alkohol über eine 50 cm Vigreux-Säule (p 11) destilliert. Andere Reinigungsschritte für Isopropanol umfassen Rückfluss mit festem Aluminiumisopropoxid, Rückfluss mit NaBH4 für 24 Stunden und Entfernen von Aceton durch Behandlung mit und Destillation von 2,4-Dinitrophenylhydrazin. Peroxide bilden sich in Isopropanol wieder, wenn es mehrere Tage in Kontakt mit Luft gehalten wird.
Unverträglichkeiten
Unverträglich mit Oxidationsmitteln wie Wasserstoffperoxid undzitronensäure, die Zersetzung verursachen. Isopropylalkohol kann aus wäßrigen Gemischen durch Zugabe von Natriumchlorid, Natriumsulfat und anderen Salzen oder durch Zugabe von Natriumhydroxid ausgesalzen werden.
Vorsichtsmaßnahmen
Arbeiter sollten nach dem Umgang mit Isopropylalkohol Hände und Gesicht gründlich waschen. Arbeiter sollten Handschuhe, Schutzbrille und einen Gesichtsschutz, Stiefel, Schürze tragen, und ein undurchlässiger Anzug wird empfohlen, wenn ein großer Teil des Körpers exponiert werden kann.
Regulatorischer Status
In der FDA-Datenbank für inaktive Inhaltsstoffe (orale Kapseln, Tabletten und topische Präparate) enthalten. Enthalten in nichtparenteralenmedikamente in Großbritannien lizenziert. Enthalten in der kanadischen Liste vonakzeptable nicht-medizinische Inhaltsstoffe.