XeF4 nebo Xenon Tetrafluoride je chemická sloučenina z Xenonu a Fluoru atomy. Je to první objevená binární sloučenina na světě. To je druh vzácných plynů s chemickou rovnici,
Xe +2 F2 -> XeF4
XeF4 má pevné bílé vzhled a má hustotu 4.040 g cm−3 v pevné formě. Za běžných podmínek se jeví jako bezbarvá krystalická látka. Má vznešenou teplotu 115,7 stupně Celsia nebo 240,26 stupně Fahrenheita. Stejně jako ostatní Fluoridy xenonu má Tetrafluorid xenonu exergonickou tvorbu. Při normální teplotě a tlaku zůstává ve stabilním stavu. Reaguje s vodou okamžitě a uvolňuje molekulární kyslík, fluorovodík a čistý xenonový plyn.
| Name of molecule | Xenon Tetrafluoride (XeF4) |
| No of Valence Electrons in the molecule | 36 |
| Hybridization of XeF4 | sp3d2 hybridization |
| Bond Angles | 90 degrees and 180 degrees |
| Molecular Geometry of XeF4 | Square Planar |
To know more about its physical properties and chemical properties, one needs to know its Lewisova struktura a molekulární geometrie. Zjistíme Lewisovu strukturu tetrafluoridu xenonu.
pro vytvoření Lewisovy struktury potřebujeme znát valenční elektrony XeF4, abychom vytvořili její strukturu a znali umístění atomů v molekule.
Obsah
XeF4 Valenční elektrony
V této molekule máme jeden atom Xenonu a čtyři atomy Fluoru. Vypočítáme valenční elektrony obou těchto atomů, abychom určili celkový počet valenčních elektronů XeF4.
Valenční elektrony, Xenonové = 8
Valenčních elektronů Fluoru = 7*4 ( jak tam jsou čtyři atomy Fluoru, budeme ji násobit 4)
Celkový počet valenčních elektronů Xef4: 8 + 7*4
: 8 + 28
: 36
Proto existuje celkem 36 valenční elektrony v XeF4.
XeF4 Lewis Struktura
Teď, když víme, valenční elektrony, Xenon Tetrafluoride, to bude pro vás jednodušší nakreslit jeho Lewis struktury. Tento Lewis dot struktura je vyobrazení valenční elektrony kolem jednotlivých atomů v molekule spolu s dluhopisů tvoří.
vazby ve struktuře jsou zobrazeny pomocí čar, zatímco elektrony, které se neúčastní tvorby vazby, jsou zobrazeny jako tečky. Elektrony, které netvoří žádnou vazbu, se nazývají nebondingové elektrony nebo osamělé páry elektronů.
jako Xenon je nejméně elektronegativní atom, budeme místo je ve středu a ostatní atomy fluoru kolem to takhle:

Nyní, že máme umístěny všechny atomy pojďme ukázat vazby mezi jednotlivými Fluoru a Xenonové atom. Každá vazba v molekule zabírá dva elektrony, a protože v této molekule jsou čtyři jednotlivé vazby, spotřebuje se 8 elektronů z 36.
začněte umisťovat zbytek valenčních elektronů kolem atomů. Každý atom fluoru bude mít kolem sebe šest valenčních elektronů, protože jeden elektron byl použit k vytvoření vazby.
můžete si všimnout, že jsme již umístili 24 elektronů z 28 kolem atomů fluoru. Zbývající nebondující elektrony nebo osamělé páry elektronů budou umístěny na Xenon, protože se jedná o výjimku z pravidla oktetu.
Umístit tyto dva páry nonbonding elektrony na Xenon, a teď máte Lewis struktury, kde jsou dva osamělé páry elektronů na Xenon a šest nonbonding elektrony na každý atom Fluoru.
XeF4 Hybridizace
centrální Xenonové atomu orbitaly jsou hybridizaci, což má za následek vznik nově hybridizované orbitaly. Xenon má šest elektronů ve svých 5p orbitálech a dva elektrony v 5S orbitálech. V D-orbitálech a f-orbitálech v základním stavu xenonu nejsou žádné elektrony. Ale když je tento atom ve vzrušeném stavu, dva elektrony v p-orbitálech se pohybují na d-orbitaly; v důsledku toho jsou celkem čtyři nepárové elektrony. Z nichž dva jsou v p-orbitaly, a další dva nepárové elektrony v d-orbitalech. Tyto hybridizované orbitaly vedou k hybridizaci sp3d2 v XeF4.
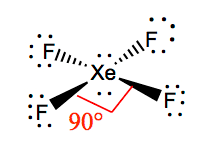
XeF4 Molekulární Geometrie
je jednodušší pochopit molekulární geometrii dané molekuly jakmile budeme znát jeho Lewis struktury. Protože Xenon má dva osamělé páry elektronů, zabírá strukturu, která těmto osamělým párům pomáhá vyhnout se odpuzujícím silám. Aby se tyto odpuzování udrželo na minimu, budou osamělé páry v kolmé rovině. A protože existují čtyři atomy fluoru, molekula bude mít uspořádání takové, že její molekulární geometrie je čtvercová rovinná. XeF4 má elektronický geometrie oktaedrická, což molekulární geometrie Xenon Tetrafluoride náměstí rovinné.

XeF4 vazebné úhly
vazebné úhly F-Xe-F jsou 90 stupňů, a osamělé páry mají úhly 180 stupňů. Atomy fluoru jsou umístěny na 90 stupňů k sobě, což vede k symetrické distribuci elektronů v rovině molekuly. Tyto úhly vazby přispívají k tvorbě čtvercové rovinné molekulární geometrie.
polarita XeF4 – je XeF4 polární nebo nepolární?
přestože vazby mezi atomy xenonu a fluoru jsou polární, XeF4 je nepolární molekula. Zajímá Vás, jak? Všechny vazby Xe-F jsou vzájemně v opozici, takže součet dipólového momentu je nulový. Protože na Atomu xenonu jsou čtyři elektrony, které jsou lokalizovány jako nevázané páry elektronů. Jako celkové uspořádání atomů a elektronů v molekule je taková, že součet vektorů dipóly je nula, XeF4, je nepolární molekula.
závěrečné poznámky
Xenon Tetrafluorid je jednou z těch molekul, které jsou relativně snadno pochopitelné. Jeho Lewisova struktura je jednou z nejméně komplikovaných struktur, protože všechny atomy fluoru jsou uspořádány v symetrickém vzoru. Osamělé páry v molekule jsou umístěny v kolmé rovině v oktaedrálním tvaru, aby udržely své odpudivé síly na minimu.
abychom shrnuli tento blogový příspěvek, můžeme říci, že XeF4 má 36 valenčních elektronů. Na centrálním atomu xenonu má dva osamělé páry nebondujících elektronů. Molekula má oktaedrální elektronovou geometrii a čtvercovou rovinnou molekulární geometrii. XeF4 je nepolární molekula a má hybridizaci sp3d2.