Le Xef4 ou tétrafluorure de Xénon est un composé chimique composé d’atomes de Xénon et de fluorure. C’est le premier composé binaire découvert au monde. C’est un type de gaz noble ayant l’équation chimique de
Xe +2 F2 ->XeF4
Le XeF4 a un aspect blanc solide et a une densité de 4,040 g cm−3 sous forme solide. Dans des conditions ordinaires, il apparaît comme un cristallin incolore. Il a une température sublime de 115,7 degrés Celsius ou 240,26 degrés Fahrenheit. Comme les autres Fluorures de Xénon, le tétrafluorure de xénon a une formation exergonique. À température et pression normales, il reste dans un état stable. Il réagit instantanément avec l’eau et libère de l’oxygène moléculaire, du fluorure d’hydrogène et du gaz xénon pur.
| Name of molecule | Xenon Tetrafluoride (XeF4) |
| No of Valence Electrons in the molecule | 36 |
| Hybridization of XeF4 | sp3d2 hybridization |
| Bond Angles | 90 degrees and 180 degrees |
| Molecular Geometry of XeF4 | Square Planar |
To know more about its physical properties and chemical properties, one needs to know its Structure de Lewis et géométrie moléculaire. Découvrons la structure de Lewis du tétrafluorure de xénon.
Pour faire la structure de Lewis, nous avons besoin de connaître les électrons de valence de XeF4 pour faire sa structure et connaître le placement des atomes dans la molécule.
Contenu
Électrons de valence XeF4
Dans cette molécule, nous avons un atome de xénon et quatre atomes de Fluor. Nous calculerons les électrons de valence de ces deux atomes pour déterminer le nombre total d’électrons de valence de XeF4.
Électrons de valence du Xénon = 8
Électrons de Valence du Fluor = 7 *4 (comme il y a quatre atomes de fluor, on va le multiplier par 4)
Nombre total d’électrons de valence de Xef4 : 8 + 7*4
: 8 + 28
:36
Il y a donc un total de 36 électrons de valence dans XeF4.
Structure de Lewis XeF4
Maintenant que nous connaissons les électrons de valence du tétrafluorure de xénon, il vous sera plus facile de dessiner sa structure de Lewis. Cette structure de point de Lewis est une représentation picturale des électrons de valence autour d’atomes individuels dans une molécule avec la liaison qu’elle forme.
Les liaisons dans la structure sont représentées à l’aide de lignes, tandis que les électrons ne participant pas à la formation de la liaison sont représentés sous forme de points. Les électrons qui ne forment aucune liaison sont appelés électrons non liés ou paires d’électrons isolées.
Ici, comme le xénon est l’atome le moins électronégatif, nous le placerons au centre et tous les autres atomes de fluor autour de lui comme ceci:

Maintenant que nous avons placé tous les atomes, montrons les liaisons entre chaque atome de fluor et de xénon. Chaque liaison dans la molécule prend deux électrons, et comme il y a quatre liaisons simples dans cette molécule, 8 électrons sur 36 sont épuisés.
Commencez à placer le reste des électrons de valence autour des atomes. Chaque atome de fluor aura six électrons de valence autour de lui, car un électron a été utilisé pour faire la liaison.
Vous remarquerez peut-être que nous avons déjà placé 24 électrons sur 28 autour des atomes de fluor. Les électrons non liés restants ou les paires d’électrons isolées seront placés sur le xénon car il s’agit d’une exception à la règle des octets.
Placez ces deux paires d’électrons non liés sur le Xénon, et maintenant vous avez une structure de Lewis où il y a deux paires d’électrons seules sur le Xénon et six électrons non liés sur chaque atome de fluor.
Hybridation XeF4
Les orbitales de l’atome de xénon central sont hybridées, ce qui entraîne la formation de nouvelles orbitales hybridées. Le xénon a six électrons dans ses orbitales 5p et deux électrons dans ses orbitales 5s. Il n’y a pas d’électrons dans les orbitales d et les orbitales f à l’état fondamental du xénon. Mais lorsque cet atome est dans un état excité, deux électrons dans les orbitales p se déplacent vers des orbitales d; par conséquent, il y a quatre électrons non appariés au total. Dont deux sont en orbitales p et les deux autres électrons non appariés sont en orbitales d. Ces orbitales hybridées conduisent à l’hybridation sp3d2 dans XeF4.
Géométrie moléculaire XeF4
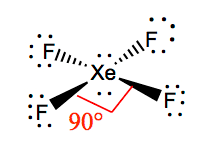
Il est plus facile de comprendre la géométrie moléculaire d’une molécule donnée une fois que nous connaissons sa structure de Lewis. Comme le xénon a deux paires d’électrons solitaires, il prendra une structure qui aide ces paires solitaires à éviter les forces de répulsion. Pour garder ces répulsions au minimum, les paires solitaires seront dans un plan perpendiculaire. Et comme il y a quatre atomes de fluor, la molécule aura une disposition telle que sa géométrie moléculaire soit plane et carrée. XeF4 a une géométrie électronique octaédrique, rendant la géométrie moléculaire du tétrafluorure de xénon plane.

Angles de liaison XeF4
Les angles de liaison de F-Xe-F sont de 90 degrés et les paires solitaires ont des angles de 180 degrés. Les atomes de fluor sont situés à 90 degrés les uns des autres, ce qui entraîne la distribution symétrique des électrons dans le plan de la molécule. Ces angles de liaison contribuent à la formation d’une géométrie moléculaire plane carrée.
Polarité XeF4 – XeF4 est-elle polaire ou non polaire?
Bien que les liaisons entre les atomes de xénon et de fluor soient polaires, XeF4 est une molécule apolaire. Vous vous demandez comment? Toutes les liaisons Xe-F sont en opposition les unes avec les autres, ce qui rend la somme du moment dipolaire nulle. Comme il y a quatre électrons sur l’atome de xénon, qui sont localisés sous forme de paires d’électrons non liées. Comme la disposition globale des atomes et des électrons dans la molécule est telle que la somme vectorielle des dipôles est nulle, XeF4 est une molécule apolaire.
Conclusion
Le tétrafluorure de xénon est l’une de ces molécules relativement faciles à comprendre. Sa structure de Lewis est l’une des structures les moins compliquées, car tous les atomes de fluor sont disposés dans le motif symétrique. Les paires solitaires de la molécule sont situées dans un plan perpendiculaire sous une forme octaédrique pour maintenir leurs forces répulsives au minimum.
Pour résumer cet article de blog, on peut dire que XeF4 possède 36 électrons de valence. Il a deux paires isolées d’électrons non liés sur l’atome central du xénon. La molécule a une géométrie électronique octaédrique et une géométrie moléculaire plane carrée. XeF4 est une molécule non polaire et possède une hybridation sp3d2.